工业锌粉中金属锌和全锌含量的分别测定
——分析化学设计实验
2020-09-26谢敏,丁琼,杨鹰
谢 敏 ,丁 琼 ,杨 鹰
(1. 生物医学分析化学教育部重点实验室,湖北 武汉 430072;2. 武汉大学 化学与分子科学学院,国家级化学实验教学示范中心,湖北 武汉 430072)
分析化学是研究物质的组成、含量、结构和形态等化学信息的分析方法及理论的一门科学,是化学化工类、生物类和医学类等专业的必修课程。分析化学实验通过操作实践支撑分析化学理论教学,巩固和加强学生对分析化学基本原理的理解和掌握的同时,使学生树立准确的“量”的概念,培养学生独立思考问题、解决问题及实际操作的能力。分析化学实验是一门相对独立且实践性和技术性很强的课程,是学习其他化学相关专业课及进行实验实践的基础。许多高校把分析化学实验课程的教学改革作为一项重要的工作来落实,通过更新实验内容、变换教学方法、改变教学模式等手段,激发学生积极性,从而提升教学效果[1-4]。
分析化学实验,特别是滴定分析要做到重现性好、准确率高,需要不断练习、反复滴定,极大考验学生的耐性,容易使学生产生疲惫和厌烦情趣。因此,在掌握基本操作技术的前提下,开设新颖的设计实验,使学生自行设计实验方案并实施,可充分调动其积极性,激发学生的学习兴趣[5-6]。此外,通过设计实验,学生在巩固原有操作技巧的同时,可培养其发现问题、解决问题的能力,做到学以致用。基于以上出发点,在实际课堂教学中,分析化学实验通常分为 2~3个层次,即基本操作练习与基础实验、设计实验及综合实验,目的是使学生循序渐进地掌握分析化学实验的基本操作技能,具备独立实验能力及综合运用知识进行科学研究的能力[7]。由此可见,开设新型的设计实验,是对基础知识和基本操作的检验,也是对学生综合素质的测评,同时可激发学生实验兴趣,保证教学效果。当前,各学校均加强了新颖的、综合性的分析化学实验在教学中的应用,极大地推动了分析化学实验课程的发展,成为提升教学质量的重要手段[8-10]。
基于此,本文介绍一个新型的分析化学设计实验,综合运用络合滴定和氧化还原滴定分别测定工业锌粉中全锌和金属锌的含量。工业锌粉主要成分为深灰色、粉末状的金属锌﹐可作颜料,遮盖力极强,具有很好的防锈及耐大气侵蚀的作用。因其强还原性,常用于制造防锈漆等,涂覆于钢铁构件表面用于钢铁构件防腐。工业锌粉中主要为金属锌亦有少量含锌化合物及其他杂质,其金属锌及全锌的含量代表着工业锌粉的等级。络合滴定法和氧化还原滴定法是国家标准《GB/T 6890—2012》测定锌粉中全锌和金属锌含量的方法[11]。通过本实验可以使学生巩固已学的理论及实验知识,并了解滴定分析方法在工业生产中的应用,摒弃滴定分析无用论,激发学生的学习兴趣,做到学以致用。
1 实验原理
在惰性气体(二氧化碳或氮气)作保护气的条件下,试料中金属锌与硫酸铁作用(铜盐作催化剂)生成相当量的硫酸亚铁,用高锰酸钾标准滴定溶液滴定,可间接计算试料中金属锌的含量。用盐酸和过氧化氢溶解试料,在pH 5~6的乙酸-乙酸钠的缓冲溶液中,以二甲酚橙为指示剂,Na2EDTA标准溶液滴定,可测定试料中全锌的含量。
2 实验材料
试剂:氮气、磷酸、硫酸(1+19)、硫酸铜溶液(200 g·L-1,称取100 g硫酸铜溶于0.5 L水中)、硫酸铁溶液(330 g·L-1,称取330 g硫酸铁溶于1 L水中,加热至完全溶解)、盐酸(1+1)、氨水(1+1)、二甲酚橙指示剂(5 g·L-1)、乙酸-乙酸钠缓冲溶液(称取150 g无水乙酸钠溶于水中,再加入18 mL 冰醋酸,加水稀释至1 L,摇匀)、高锰酸钾、Na2EDTA、草酸钠、抗坏血酸、过氧化氢(30%)、硫代硫酸钠(100 g·L-1,称取 50 g硫代硫酸钠溶解于 0.5 L水中)、氟化钾(200 g·L-1,称取100 g氟化钾溶解于0.5 L水中)等。
仪器及器材:分析天平、电子天平、酸式滴定管、滴定台、容量瓶、锥形瓶、移液管、烧杯、试剂瓶(透明及棕色)、滴管、恒温水浴锅、洗瓶、表面皿、钥匙等。
3 实验内容
3.1 工业锌粉中金属锌含量的测定
3.1.1 实验设计
单纯采用酸溶解工业锌粉无法区分金属锌及锌的化合物。因此本实验采用铜置换法将锌单质同其他形态的锌分离开来。硫酸铜与金属锌发生反应生成铜,再与硫酸铁(Ⅲ)发生反应,将铁(Ⅲ)转化为铁(Ⅱ)。随后,采用氧化还原滴定法以高锰酸钾标准溶液作为溶液剂定量滴定被还原出来的铁(Ⅱ)。最终可通过高锰酸钾法的消耗量,确定工业锌粉中金属锌的含量,其化学计量(物质的量)关系为Zn∶Mn=5∶2。实验过程中,锌粉需要在二氧化碳或氮气氛围与硫酸铜及硫酸铁发生反应,避免空气中的氧气参与氧化还原反应,影响实验结果。反应完全后加入磷酸与铁(Ⅲ)形成无色配合物,避免铁(Ⅲ)的颜色干扰对滴定终点的判断,使高锰酸钾滴定时突跃更加明显。同时由于加入了酸,使铁(Ⅱ)更容易被空气中的氧气氧化,因此加酸后需立刻滴定。
3.1.2 实验操作
3.1.2.1 KMnO4溶液的配制及标定
KMnO4溶液的配制:在台秤上称取高锰酸钾固体3.2 g,置于1 000 mL烧杯中,加入500 mL蒸馏水使其溶解,盖上表面皿,加热至沸腾并保持微沸状态约1 h,中间可补加一定量的蒸馏水,以保持溶液体积基本不变。冷却后将溶液转移至棕色瓶内,在暗处放置2~3 d,然后用G3或G4砂芯露头过滤除去 MnO2等杂质,滤液贮存于棕色试剂瓶内备用。
KMnO4溶液的标定:准确称取 0.30~0.40 g基准草酸钠(在105 ℃±5 ℃下烘箱中干燥1 h,冷却至室温)3份置于250 mL锥形瓶中,将其溶解于50 mL的硫酸(1+19)溶液中,加热至75~85 ℃,趁热用高锰酸钾溶液滴至微红色并保持30 s不褪色即为终点。平行滴定3份,根据滴定消耗高锰酸钾溶液的体积和草酸钠的量,计算高锰酸钾溶液的浓度,同时做空白实验。草酸钠标定高锰酸钾的反应原理如下:
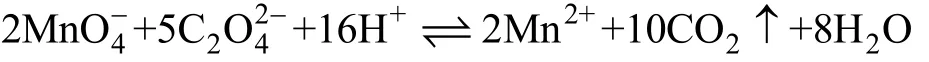
按式(1)计算高锰酸钾标准溶液的浓度:
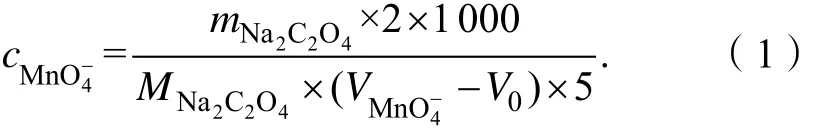
式中: cMnO-4为高锰酸钾标准溶液的实际浓度,单位为mol·L-1; mNa2C2O4为称取草酸钠基准物质的质量,单位为g; MNa2C2O4为草酸钠的摩尔质量(134.00 g·mol-1);VM nO-4为标定时消耗高锰酸钾标准滴定溶液的体积,单位为 mL; V0为空白实验消耗高锰酸钾标准滴定溶液的体积,单位为mL。
平行标定3份,结果保留4位有效数字,取平均值计为高锰酸钾标准滴定溶液的浓度。
3.1.2.2 样品测定
在250 mL锥形瓶中加入15 mL水,并预先充满氮气用胶塞密封。之后,将准确称取的0.15~0.20 g试样迅速置于锥形瓶中,立即塞好胶塞,摇动,使试样散开(避免生成聚焦物)。向锥形瓶中加入5 mL硫酸铜溶液(200 g·L-1),剧烈摇动 1 min,然后加入25 mL硫酸铁溶液(330 g·L-1),用洗瓶冲洗锥形瓶颈部及瓶内壁把附在上面的金属粒子冲下去塞紧胶塞,用手摇动15~30 min直至试样完全溶解。然后,加入10 mL磷酸和100 mL硫酸(1+19),立即用高锰酸钾标准溶液滴定至淡红色为终点,重复滴定3份。具体反应方程式如下:

式中: m试样为称取试样的质量,单位为 g;ZnM 为锌的摩尔质量(65.38 g·mol-1)。
平行标定3份,结果保留4位有效数字,取平均值计为试样中金属锌的百分含量。
3.2 工业锌粉中全锌含量的测定
3.2.1 实验设计
工业锌粉中的金属锌及其锌的化合物(主要为氧化锌等)在酸性条件下均可转换为锌离子,在pH 5~6的醋酸-醋酸钠的缓冲溶液中,二甲酚橙作为金属离子指示剂,Na2EDTA作为滴定剂,经络合滴定可知试样中全锌的含量。为了避免工业锌粉中的杂质使二甲酚橙指示剂封闭或僵化,在滴定前需加入抗坏血酸、硫代硫酸钠、氟化钾等掩蔽Cu2+、Fe3+和Al3+等金属离子。
3.2.2 实验操作
3.2.2.1 EDTA溶液的配制及标定
EDTA溶液的配制:称取9~10 g Na2EDTA于500 mL烧杯中,加200 mL水溶解,并稀释至约500 mL。
EDTA溶液的标定:①用分析天平称取 0.80 g左右的基准锌片于50 mL烧杯中,加入30 mL盐酸(1+1)盖上表面皿,直至锌片全部溶解。随后,取下并冲洗表面皿,将溶液冷至室温,定量转移至 250 mL容量瓶中定容,计算Zn2+标准溶液的浓度;②用移液管吸取25 mL的Zn2+标准溶液于250 mL锥形瓶中,加1滴甲基橙溶液,用氨水(1+1)和盐酸(1+1)调至溶液恰变红色,加入15 mL乙酸-乙酸钠缓冲溶液,再加2滴二甲酚橙,用待标定的EDTA滴至黄色,平行滴定 3次并记录数据,计算 EDTA的浓度。按式(3)计算试样中锌单质的含量:
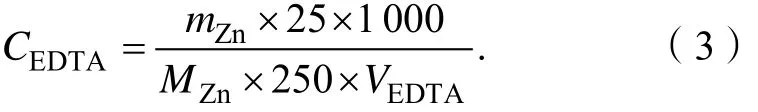
式中: CEDTA表示 EDTA标准溶液的浓度,单位为mol·L-1;mZn表示称取Zn基准物质的质量,单位为g;VEDTA表示滴定25 mL锌标准溶液消耗EDTA溶液的体积,单位为mL。
平行标定3份,结果保留4位有效数字,取平均值计为Na2EDTA标准溶液的浓度。
3.2.2.2 工业锌粉中全锌含量的测定
用分析天平称取含0.80 g左右的锌粉放入50 mL烧杯中,加入30 mL(1+1)盐酸,滴入1 mL过氧化氢,盖上表面皿,低温加热至试样完全溶解,取下表面皿,用少许水吹洗表面皿及烧杯壁,冷却后转移至250 mL容量瓶中定容。移取25 mL待测液于250 mL锥形瓶中,加 1滴甲基橙溶液,用氨水(1+1)和盐酸(1+1)调至溶液恰变红色。随后,加入0.1 g抗坏血酸,再加入15 mL乙酸-乙酸钠缓冲溶液,5 mL硫代硫酸钠溶液(100 g·L-1)及 5 mL 氟化钾溶液(200 g·L-1),摇匀。加入1~2滴二甲酚橙指示剂,此时若上述溶液为黄色则滴加氨水至紫红色,再用EDTA标准溶液滴定至刚好变为亮黄色,且摇匀后30 s不变色,即为终点。平行滴定3次,记录数据。按式(4)计算试样中锌单质的含量:
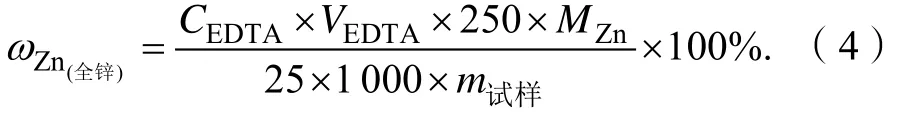
式中: ωZn(全锌)表示工业试样中全锌的百分含量。
平行标定3份,结果保留4位有效数字,取平均值计为EDTA标准溶液的浓度。
4 实验注意事项
(1)实验设计需考虑金属锌及锌的化合物化学性质的差异。金属锌具有氧化还原性,而锌的化合物不具备氧化还原性,据此可利用氧化还原滴定测定工业锌粉中金属锌的含量。金属锌及锌的化合物在酸性、氧化剂存在的条件下可全部转换为锌离子,经络合滴定测定全锌的含量。
(2)实验实施过程中应充分考虑各个步骤对测定结果准确性和重现性的影响,特别需要考虑待测样品的称量质量及滴定剂的浓度对测定结果的影响。实验过程中需优化待测样称量质量,并以此确定滴定剂的浓度范围;再依据滴定剂浓度确定基准物质的称量质量等。
(3)金属锌含量的测定需综合运用氧化还原滴定(高锰酸钾法)中的知识点,在以草酸钠为基准物质标定高锰酸钾溶液时需注意溶液的温度、酸度及滴定速度等对结果的影响;在处理锌粉试样时需考虑空气中的氧气对测定结果的影响。
(4)全锌含量的测定需综合运用络合滴定法中的各知识点,需选择适当的金属离子指示剂及缓冲溶液用于络合滴定;特别说明的是要使用掩蔽剂封闭工业锌粉中的杂质离子,避免金属离子指示剂的封闭和僵化。
5 案例教学安排
作为分析化学设计实验,学生需掌握金属及其化合物性质、分析实验基本操作、络合滴定及氧化还原滴定原理的前提下,综合运用样品前处理、缓冲溶液、滴定指示剂、掩蔽剂等知识完成相应实验内容。为了达到较好实验效果,该设计实验预计18学时共4周完成,第1、4周各3学时,2、3周各6学时,具体每周安排参见表 1[12]。整个实验应以学生为主体,自主投入到方案设计、样品测定及结果讨论等实验过程,教师引导并辅助学生完成整个实验。

表1 每周教学安排
6 本设计实验的教学特点
分析化学实验的教学要求是熟悉分析化学实验的基本知识,掌握基本操作技能,重点掌握称量、滴定(酸碱滴定、络合滴定、氧化还原滴定、沉淀滴定)、移液、定量转移等操作以及重量分析、分光光度计及pH的使用等。本实验作为分析化学设计实验,适合在学生掌握相应基本操作后开设。通过方案设计、实验实践、总结讨论等过程对前期掌握的基本理论和操作技能进行巩固和复习,进一步拓展学生的实际应用能力。通过该设计实验,可取得如下效果:①巩固无机化学及分析化学理论知识,做到学以致用;②学生自主性增强,在发现问题、解决问题的过程中,迸发学习兴趣;③学生依据实验目标设计实验方案,初步掌握科研思维,培养科研及动手能力,增强创新意识,使学生具有较强地解决分析化学实际问题的能力;④与同学的合作更加紧密,与老师的交流讨论明显增多。
总体上说,本内容作为一个分析化学设计实验用于分析化学实验教学,符合分析化学实验的教学目的;在实施后,有利于完成分析化学实验教学目标,既巩固了学生的基本操作技巧,也锻炼了学生的实践能力,利于提高学生综合素质。
