卒中后疲劳患者血清25-羟基维生素D水平变化及维生素D3干预对神经功能康复的影响*
2020-09-25
(锦州医科大学附属第一医院 神经内科,辽宁 锦州121001)
缺血性脑卒中具有高发病率、高致残率、高致死率等特点,是继心血管疾病与恶性肿瘤之后第3 大致死性疾病[1]。卒中后疲劳 (post-stroke fatigue,PSF) 是指卒中患者在发病后所呈现的无关运动强度且经休息后无法获得缓解的持续性、病理性疲劳感,是缺血性脑卒中常见的后遗症之一,也是影响卒中患者肢体功能康复及生活质量的重要因素[2]。目前,关于PSF的发病机制尚不明确,临床对其关注度仍普遍不足,探索PSF的发病机制及危险因素,积极采取防治措施具有重要意义。有研究发现,维生素D (Vitamin D,VD) 缺乏或不足与脑血管疾病、神经变性病等多种中枢神经系统的发生、发展及转归存在一定关联[3],但其与PSF的关系及是否需要补充VD 目前仍缺乏相关研究。本研究拟通过比较缺血性脑卒中后,发生与未发生PSF患者的一般临床资料及血清25-羟基维生素D[25-Hydroxyvitamin D,25 (OH) D]水平差异,分析其与PSF的关系,采取VD3干预并随访功能康复情况,以期为PSF的防治提供理论依据。
1 资料与方法
1.1 研究对象
选取2018年1月—12月赤峰学院附属医院神经内科住院的初发急性缺血性脑卒中患者100例作为研究对象。诊断符合《中国急性缺血性脑卒中诊治指南2014版》[4]相关标准,所有患者经头颅CT和/或MRI 检查证实,在发病1 周时应用疲劳严重程度量表 (fatigue severity scale,FSS)[5]对入组患者进行评分,FSS ≥4分确诊为PSF作为研究组 (50例) ;FSS<4分为病例对照组 (50例)。所有患者的急性期及康复期治疗方案基本一致。排除脑卒中病史者、严重脏器功能者、合并影响VD 代谢的疾病者及其他原因导致疲劳者。剔除研究期间因心脑血管事件或其他病因再入院者。另选同期健康体检者50例为正常对照组,年龄与性别构成与病例对照组匹配。研究经本院医学伦理委员会审核批准,所有受试者自愿参加并签署知情同意书。
1.2 方法
1.2.1 研究方法所有受试者入组后搜集一般人口学资料,病例对照组进行美国国立卫生研究院卒中量表 (national institute of health stroke scale,NIHSS) 评分,入院后次日晨取空腹静脉血进行血常规及相关血液指标检查。病例对照组发病1 周时进行FSS评分。病例对照组均接受为期6个月的病情随访。其中PSF患者根据意愿随机分为PSF-A组与PSF-B组,每组25例。
PSF-A组在无禁忌证情况下予以VD3补充剂 (维生素D滴剂,国药控股星鲨制药有限公司,国药准字H35021450) 口服,400 IU/次,1次/d,连续服用6个月;PSF-B组不予以VD3补充剂。于第3和6个月进行FSS、NIHSS、改良版Rankin量表 (modified Rankin scale,mRS)和Fugl-Meyer量表 ([7]Fugl-Meyer mark,FMA) 评分。
1.2.2 调查内容遵循知情同意与自愿参与原则,在获得患者及其家属理解与同意后进行调查。调查由经专业、系统培训的研究者发放问卷,在详细介绍调查目的、意义、填写要求及相关注意事项后,由受试者独立完成问卷填写,如无阅读或书写能力则由研究者阅读并询问受试者后帮助其填写。所有问卷当场回收,如有缺漏现场核对并补齐,150份问卷均有效回收。问卷包括4个部分:①一般资料问卷,采用一般资料调查表调查所有受试者的一般情况与检查结果,包括性别、年龄、病史 (高血压、糖尿病、高脂血症等) 、近1 周用药史、体重指数 (BMI) 、生活方式 (吸烟、饮酒) 等。②神经功能问卷,采用NIHSS量表和mRS 进行评价。NIHSS量表用于评价神经功能损伤程度,总分0~42分。0~1分为正常,>1~4分为轻度,>4~15分为中度,>15~20分为中-重度,>20~42分为重度,得分越高表示神经功能损伤越重。mRS量表评价残疾程度,由无症状至重度残疾以0~5分6级评价,mRS评分>2分为预后不良,≤2分为预后良好。③疲劳程度问卷,由2位经统一培训的神经内科医师应用FSS量表[4]进行评价,包括9个问题,每个问题由“完全不同意”至“完全同意”,以1~7分评价,得分越高则表示疲劳程度越重,以量表单项均分≥4分判定为PSF,<4分则判定为无PSF,其中,0~3分为无疲劳,>3~<5分为轻度疲劳,5~<6分为中度疲劳,≥6分为重度疲劳。量表在PSF 中信效度良好,Cronbachα系数为0.85[6]。④肢体功能问卷,采用FMA 进行评价,共17个项目,包括上肢功能 (66分) 与下肢功能 (34分),统计上下肢功能总分,总分范围0~100分。<50分为严重运动功能障碍,50~<85分为明显运动障碍,85~95分为中度运动障碍,>95~<100分为轻度运动障碍,100分为正常,得分越高则表示肢体功能恢复越好。
1.2.3 血清25 (OH) D检测纳入患者入院后次日、3和6个月后晨取空腹外周静脉血5 ml,正常对照组于体检当日采血5 ml。采用E601型全自动电化学发光免疫分析仪[罗氏 (上海) 有限公司]及其配套试剂,以电化学发光法测定血清25 (OH) D水平。血清25 (OH) D水平≥30 ng/ml为正常,20 ng/ml<25 (OH) D<30 ng/ml为轻度缺乏,10 ng/ml ≤25 (OH) D ≤20 ng/ml为中度缺乏,25 (OH) D<10 ng/ml为严重缺乏[8]。
1.3 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差 (±s)表示,比较采用t检验或单因素方差分析或重复测量设计的方差分析,进一步两两比较用SNK-q检验;计数资料以例 (%)表示,比较采用χ2检验;相关性分析用Pearson 法,影响因素的分析用多因素逐步Logistic回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料的比较
3组性别、年龄、BMI、病变部位和生活方式比较,差异无统计学意义 (P>0.05) ;研究组与病例对照组的病程比较有差异 (P<0.05),研究组的病程长于病例对照组;研究组与病例对照组的高血压、糖尿病、冠状动脉粥样硬化性心脏病、高脂血症等病史比较,差异无统计学意义 (P>0.05) ;研究组与病例对照组的NIHSS评分、FSS评分、FMA评分及25 (OH) D水平比较,差异有统计学意义 (P<0.05),研究组的NIHSS评分、FSS评分高于病例对照组,FMA评分和25 (OH) D水平低于病例对照组,且研究组和病例对照组的25 (OH) D水平低于正常对照组 (P<0.05)。见表1。
2.2 研究组PSF影响因素的多因素逐步Logistic回归分析
取单因素分析显示差异有统计学意义的指标,即病程、NIHSS评分、FSS评分、FMA评分、25 (OH) D为自变量,病程<1年赋值0,≥1年赋值1;NIHSS评分、FSS评分、FMA评分、25 (OH) D水平均为连续变量,取实际值;以是否发生PSF为因变量 (是为1,否为0),行多因素Logistic回归分析,结果显示,病程、NIHSS评分、FSS评分是影响PSF的独立危险因素 (P<0.05),而FMA评分及25 (OH) D 是保护因素 (P<0.05)。见表2。
2.3 研究组病情程度的临床评分和25 (OH) D水平比较
研究组与病例对照组的FSS评分和NIHSS评分、FMA评分和25 (OH) D水平比较,差异有统计学意义 (P<0.05),研究组的FSS评分和NIHSS评分高于病例对照组,FMA评分和25 (OH) D水平均低于病例对照组。研究组不同病情程度患者的FSS评分、NIHSS评分、FMA评分和25 (OH) D水平比较,差异有统计学意义 (P<0.05)。进一步两两比较显示,中、重度组的FSS评分和NIHSS评分高于轻度组 (P<0.05),且重度组高于中度组 (P<0.05),随着病情加重呈升高趋势;中、重度组的FMA评分和25 (OH) D水平均低于轻度组 (P<0.05),且重度组低于中度组 (P<0.05),随着病情加重呈降低趋势。见表3。

表1 3组一般资料比较 (n=50)
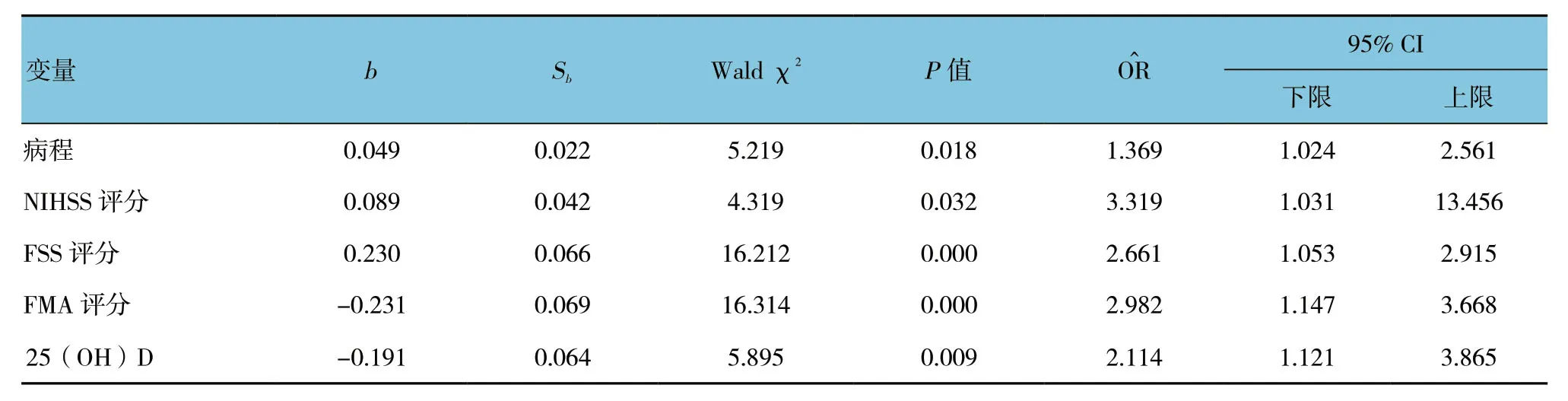
表2 PSF影响因素的多因素逐步Logistic回归分析参数
表3 不同疲劳程度患者的临床评分和25 (OH) D水平比较 (±s)
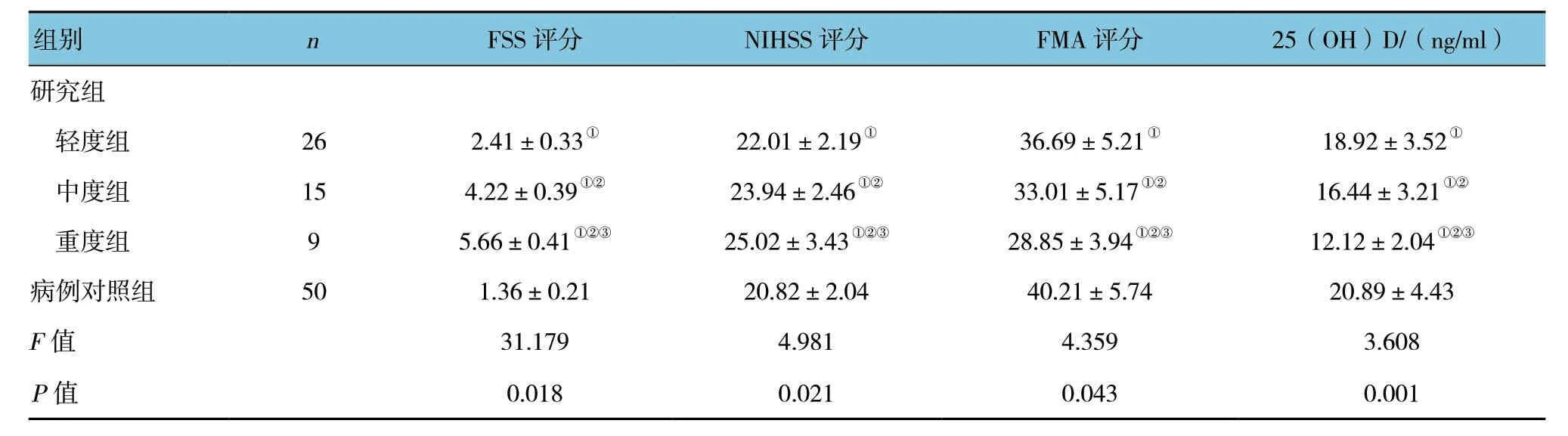
表3 不同疲劳程度患者的临床评分和25 (OH) D水平比较 (±s)
注:①与病例对照组比较,P<0.05;②与轻度组比较,P<0.05;③与中度组比较,P<0.05。
组别 n FSS评分 NIHSS评分 FMA评分 25 (OH) D/ (ng/ml) 研究组轻度组 26 2.41±0.33① 22.01±2.19① 36.69±5.21① 18.92±3.52①中度组 15 4.22±0.39①② 23.94±2.46①② 33.01±5.17①② 16.44±3.21①②重度组 9 5.66±0.41①②③ 25.02±3.43①②③ 28.85±3.94①②③ 12.12±2.04①②③病例对照组 50 1.36±0.21 20.82±2.04 40.21±5.74 20.89±4.43 F值 31.179 4.981 4.359 3.608 P值 0.018 0.021 0.043 0.001
2.4 血清25 (OH) D水平与临床评分的相关性
Pearson相关性分析显示,研究组血清25 (OH) D水平与与FSS评分、NIHSS评分呈负相关 (r=-0.525和-3.179,P=0.012和0.001),与FMA评分呈正相关 (r=0.619,P=0.005) ;FSS评分与NIHSS评分呈正相关 (r=0.413,P=0.023),与FMA评分呈负相关 (r=-0.562,P=0.011)。
2.5 VD3对患者FSS评分、NIHSS评分、FAM评分及血清25 (OH) D的影响
随访3和6个月后,病例对照组与PSF-A组、PSF-B组的FSS评分、NIHSS评分、FAM 评分及25 (OH) D水平比较,采用重复测量设计的方差分析,结果:①不同时间点的FSS评分、NIHSS评分、FAM 评分及25 (OH) D水平比较有差异 (F=19.872、14.321、12.634和12.171,均P=0.000) ;②组间FSS评分、NIHSS评分、FAM评分及25 (OH) D水平比较有差异 (F=41.733、45.852、60.179和30.216,均P=0.000) ;③组间FSS评分、NIHSS评分、FAM 评分及25 (OH) D水平变化趋势有差异 (F=17.021、12.831、9.861及9.743,均P=0.000)。见表4。
2.6 VD3对所有患者临床转归的影响
随访6个月评价临床转归显示,病例对照组39例 (78.00%) 预后良好 (mRS ≤2分),PSF-A组18例 (72.00%) 预后良好,PSF-B组15例 (60.00%) 预后良好。3组比较差异无统计学意义 (χ2=2.679,P=0.262)。
表4 VD3对患者FSS评分、NIHSS评分、FAM 评分及25 (OH) D的影响 (±s)
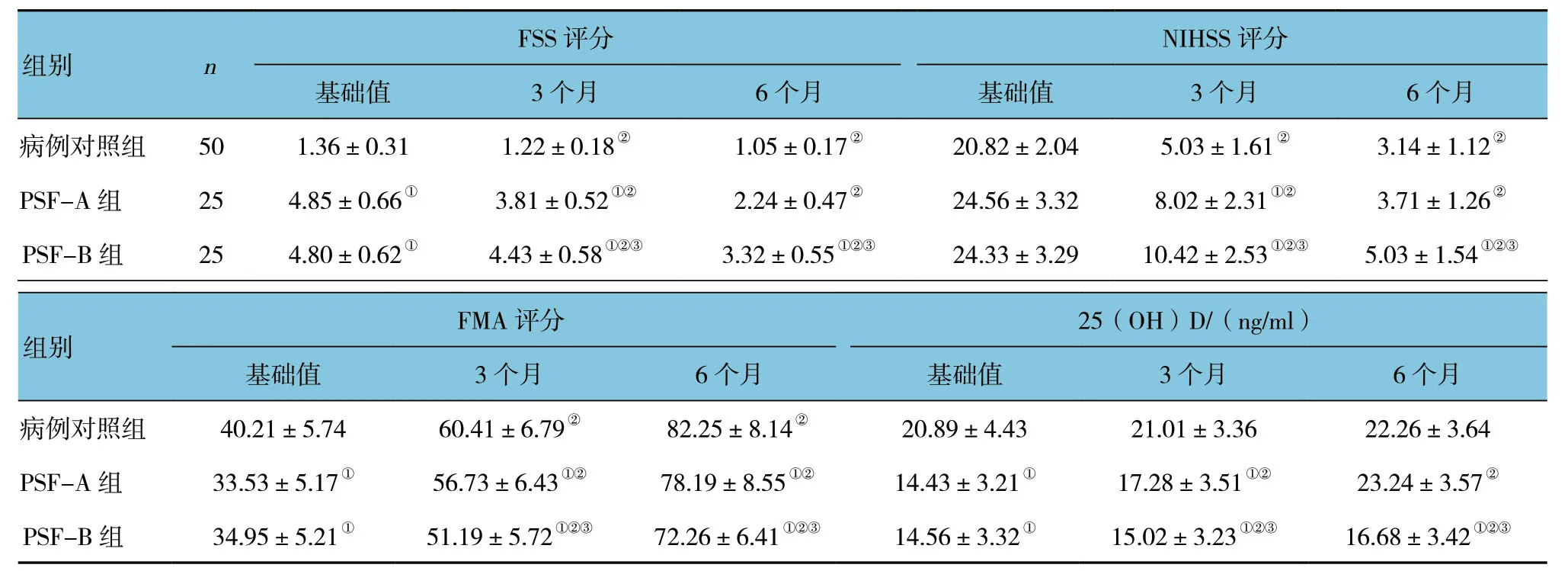
表4 VD3对患者FSS评分、NIHSS评分、FAM 评分及25 (OH) D的影响 (±s)
注:①与病例对照组比较,P<0.05;②与同组基础值比较,P<0.05;③与PSF-A组比较,P<0.05。
组别 n FSS评分 NIHSS评分基础值 3个月 6个月 基础值 3个月 6个月病例对照组 50 1.36±0.31 1.22±0.18② 1.05±0.17② 20.82±2.04 5.03±1.61② 3.14±1.12②PSF-A组 25 4.85±0.66① 3.81±0.52①② 2.24±0.47② 24.56±3.32 8.02±2.31①② 3.71±1.26②PSF-B组 25 4.80±0.62① 4.43±0.58①②③ 3.32±0.55①②③ 24.33±3.29 10.42±2.53①②③ 5.03±1.54①②③组别FMA评分 25 (OH) D/ (ng/ml) 基础值 3个月 6个月 基础值 3个月 6个月病例对照组 40.21±5.74 60.41±6.79② 82.25±8.14② 20.89±4.43 21.01±3.36 22.26±3.64 PSF-A组 33.53±5.17① 56.73±6.43①② 78.19±8.55①② 14.43±3.21① 17.28±3.51①② 23.24±3.57②PSF-B组 34.95±5.21① 51.19±5.72①②③ 72.26±6.41①②③ 14.56±3.32① 15.02±3.23①②③ 16.68±3.42①②③
3 讨论
PSF 是卒中后常见但容易被忽略的临床症状,发生率为23%~75%且可持续1年甚至更长时间[9-10]。不同于普通疲劳感,PSF 休息后不能缓解,其持续存在不仅影响患者的情绪状态、认知功能及肢体功能的康复,导致生活质量降低,而且导致远期脑血管事件发生率及病死率升高[11-12]。由于PSF症状具有较强的主观性,其量化评价与治疗均缺乏统一标准,发病机制不明确,故即便卒中患者的PSF 发病率高且危害持久,其临床关注度也不及卒中偏瘫等其他后遗症。因此,探究PSF的发病机制或危险因素,寻找有效干预治疗方法刻不容缓。
研究表明,PSF的发病因素复杂多样,不仅与年龄、性别、病变部位、情感障碍、营养障碍、神经功能损害、睡眠障碍、认知功能损伤、卒中前疲劳及卒中后疼痛等有关[13],而且还与糖脂代谢异常、神经递质代谢异常、炎症亢进等有关[14]。研究发现,体内VD缺乏可诱导胆碱类、多巴胺、去甲肾上腺素神经递质等分泌而增加疲劳程度[15]。VD 是一种多功能激素,其主要功能是参与机体钙磷代谢调节,并可通过调节细胞增殖、分化、凋亡等过程,从而在脑神经功能发育与维持、胰岛素分泌、血压调节、免疫反应等过程中发挥重要作用[16]。有研究证实,VD及其主要代谢产物能够透过血脑屏障而参与中枢神经系统功能的调节,VD 不足或缺乏与脑梗死的发生及发展密切相关,良好的VD水平对心血管系统具有一定的保护效应[17]。
本研究显示,年龄、性别、基础疾病等与PSF无关,而病程、NIHSS评分及FMA评分与PSF 有关。可能是由于病程较长、神经功能损伤较重及运动功能受限者,往往疲劳感更为明显,并有研究将27% PSF 归因于神经功能缺损[18]。本研究还显示,脑卒中患者的血清25 (OH) D水平低于正常对照组,提示VD缺乏或不足可能参与缺血性脑卒中的发生及发展过程。进一步比较发现,PSF患者的血清25 (OH) D水平低于非PSF患者,且随着PSF程度加重血清25 (OH) D水平呈降低趋势,经多因素逐步Logistic回归分析显示25 (OH) D为PSF 发生的保护因素,提示血清25 (OH) D水平是急性缺血性脑卒中患者PSF 发病及病情严重程度的预测因子,同时也是其保护因素。研究还发现,FSS评分与NIHSS评分呈正相关,而与FMA 呈负相关,血清25 (OH) D水平与FSS评分、NIHSS评分呈正相关,与FMA评分呈负相关。在一定程度上揭示缺血性脑卒中患者的疲劳程度与神经功能、肢体功能康复之间存在着复杂的相互关系,而VD缺乏可能在上述过程中起重要的作用。刘国懿等[19]研究提示,VD缺乏可能是导致多发性硬化患者疲劳程度加重的重要因素。
目前,临床尚缺乏针对PSF的系统干预措施,有研究将镇痛、抗焦虑、抗抑郁等药物用于缓解疲劳,但对PSF的效果不明确且安全性有待考证[20]。VD 能够抑制机体肾素-血管紧张素-醛固酮系统 (RAAS) 活性,对神经血管具有间接或直接性保护作用[21]。有研究证实其可促进急性脑卒中偏瘫患者康复期运动、认知功能的恢复[22]。另有研究发现,VD 有利于抑制动脉粥样硬化进程中的炎症反应及氧化应激反应,从而维护心脑血管系统及神经系统功能[23]。DORR 等[24]认为,补充VD 有利于抗炎和神经保护,缓解神经系统症状。本研究初步显示,PSF患者补充VD3干预后随访3、6个月,随着血清25 (OH) D水平升高,FSS评分、NIHSS评分呈降低趋势,FMA评分呈升高趋势,且改善幅度优于未用VD3组,但仍不及病例对照组。推测PSF 对缺血性脑卒中患者的功能康复具有较大的负面影响,而补充VD3干预可能有利于PSF患者神经功能及肢体运动功能的康复。但本研究随访结果显示,PSF-A组与PSF-B组使用与未使用VD3干预后mRS ≤2分预后良好率分别为72.00%和60.00%,比较无差异,VD3干预对患者远期神经功能康复的影响还不完全明确。
综上所述,VD缺乏或不足可能在PSF的发生中具有一定作用且可能加重PSF症状,且与PSF 预后不良有关。补充外源性VD3可能在一定程度上缓解PSF症状,促进神经功能及肢体功能的康复。但PSF 是一个复杂的病理生理过程,且其评估及观测手段目前仍较局限,加之本研究样本尚小、随访时间尚短,其具体影响因素及VD3对其的影响仍有待深入研究。
