外周血HMGB1、sTLR4表达与亚临床绒毛膜羊膜炎相关胎膜早破及早发型败血症的关系
2020-09-25
(成都市第二人民医院 产科,四川 成都 610011)
胎膜早破是妊娠期常见并发症之一,易导致新生儿出生7 d 内出现早发型败血症(early onset sepsis,EOS)[1]。而绒毛膜羊膜炎(chorioamnionitis,CAM)是引发胎膜早破最重要的危险因素,尤其多见于亚临床绒毛膜羊膜炎(histological chorioamnionitis,HCA)[2]。但由于HCA 缺乏典型的临床症状和有效的实验室诊断指标,目前只有依靠羊水穿刺和胎膜病理检测作为诊断的金标准[3]:前者属于侵入性检查;而后者只能作为诊断指标,两者都具有一定程度的临床局限性,对早期诊断胎膜早破并预警EOS 意义不大。高迁移率族蛋白B1(high-mobility group box-1,HMGB1)是较早发现具有高度保守序列的非组蛋白核蛋白,通过与Toll 样受体4(toll-like receptor 4,TLR4)和晚期糖基化终产物受体(receptor foradvanced glycation end products,RAGE)结合介导急慢性炎症反应[4],但是否可作为HCA 早期诊断分子和新生儿EOS的早期预警分子尚未见明确报道。因此笔者希望通过本研究探讨HMGB1及其受体作为HCA及EOS 早期诊断血清生物标志物的可行性,并尝试选择适合的指标建立相应的非侵入性产前诊断模型,从而为临床研究提供理论依据,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2017年5月—2018年4月成都市第二人民医院产科收治的314例足月分娩的胎膜早破产妇的临床资料。其中,男性新生儿169例,女性新生儿145例;年龄18~46岁,平均(32.48±8.65)岁;母体胎膜早破>12 h。所有受试产妇产后胎盘组织均送病理检测,根据该院病理科>2名经验丰富的病理医师阅片并确诊是否发生HCA,分为HCA组135例和非HCA组179例。根据2011年《实用新生儿学(第四版)》[5]关于新生儿败血症的诊断标准,21例患儿确诊为EOS。EOS诊断标准:①经外周血标本病原菌抗原或DNA检测呈阳性;②≥2条非特异性检查指标异常,包括白细胞计数(WBC)<5×109/L、血小板计数(PLT)≤1×1011/L、出生12 h 杆状粒细胞/中性粒细胞(I/T)≥0.16、C反应蛋白(CRP)≥8μg/ml及微量红细胞沉降率≥5 mm/h 等[5]。
1.2 纳入标准和排除标准
1.2.1 纳入标准①经阴道足月分娩;②经临床表现、妇科阴道检查、阴道液涂片检查及羊膜镜检查确诊为产妇胎膜早破,且胎膜早破>12 h;③分娩前血常规检查正常,无宫外感染;④具有母婴完整的临床资料;⑤由受试孕产妇签署知情同意书。
1.2.2 排除标准①分娩合并染色体异常、严重先天畸形、先天性心脏病及遗传代谢性疾病新生儿的孕妇;②合并严重的免疫系统疾病、急慢性严重感染、血液系统疾病、伴有出血性疾病及恶性肿瘤的产妇;③生殖道畸形产妇。
1.3 方法
1.3.1 血液标本采集采集产妇第一产程静脉血5 ml,置于采集管中,静置30 min,3 000 r/min 离心5 min,收集血清,置于-80℃备用;同时采集肘静脉血3 ml,置于EDTA 抗凝管中,2 h 内送检。所有检验均由该院检验科完成。
1.3.2 血常规检测采用DXC800 全自动生化分析仪(美国Beckman公司)检测WBC、PLT、糖化血红蛋白(HbA1c)等。采用葡萄糖氧化酶法测定空腹血糖(FPG)和餐后2 小时血糖(2 hPG)。采用免疫比浊法检测CRP。
1.3.3 酶联免疫吸附试验(ELISA)收集受试对象外周循环血清,采用ELISA试剂盒检测HMGB1、可溶性TLR4(sTLR4)、可溶性RAGE(sRAGE)水平。采用Elx808 全自动定量绘图酶标仪(美国Bio-Tek公司)在450 nm 波长处测定光密度(OD)值。HMGB1、sTLR4、sRAGE ELISA试剂盒购自上海江莱生物科技有限公司。
1.4 统计学方法
数据分析采用SPSS 17.0 统计软件。计量资料以均数±标准差 (±s)或中位数和四分位数[M(P25,P75)]表示,比较用t检验或秩和检验;计数资料以构成比或率(%)表示,比较用χ2检验;绘制ROC曲线,影响因素的分析用多因素Logistic回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 两组一般临床资料及血液生物化学指标比较
HCA组与非HCA组年龄、分娩孕周、收缩压、舒张压、CRP、HbAlc、FPG、2 hPG及sRAGE比较,差异无统计学意义(P>0.05);而外周血WBC、HMGB1及sTLR4水平比较,经独立样本t检验,差异有统计学意义(P<0.05),HCA组高于非HCA组。见表1。
表1 两组一般临床资料及血液生物化学指标比较 (±s)
组别 n年龄/岁分娩孕周 收缩压/mmHg 舒张压/mmHg WBC/(×109/L)CRP/(mg/L)HCA组 135 34.02±7.38 37.15±0.91 145.37±17.62 99.35±9.37 15.24±3.85 17.81±10.84非HCA组 179 32.28±8.11 37.32±0.78 142.41±15.70 97.32±10.34 12.76±3.62 15.53±9.75 t值 1.956 1.779 1.569 1.774 5.848 1.955 P值 0.051 0.076 0.118 0.077 0.000 0.052组别 HbAlc/% FPG/(mmol/L)2 hPG/(mmol/L)HMGB1/(ng/ml)sTLR4/(ng/ml)sRAGE/(ng/ml)HCA组 7.14±1.20 6.75±1.42 9.52±1.59 7.49±3.93 56.51±10.12 44.55±18.54非HCA组 6.97±1.05 6.46±1.37 9.19±1.44 3.61±3.54 34.37±8.86 47.53±16.52 t值 1.335 1.828 1.922 9.168 20.614 1.501 P值 0.183 0.069 0.056 0.000 0.000 0.134
2.2 胎膜早破孕妇发生HCA的影响因素
基于上述两组各项指标的初步分析,进一步以是否发生HCA为因变量,以WBC、HMGB1及sTLR4作为自变量,以逐步向后条件参数方法进行多因素Logistic回归分析(α入=0.05,α出=0.10;Backward:LR),产妇临产外周血HMGB1是发生HCA的独立危险因素(P<0.05);而sTLR4是发生HCA的独立保护因素(P<0.05)。见表2。
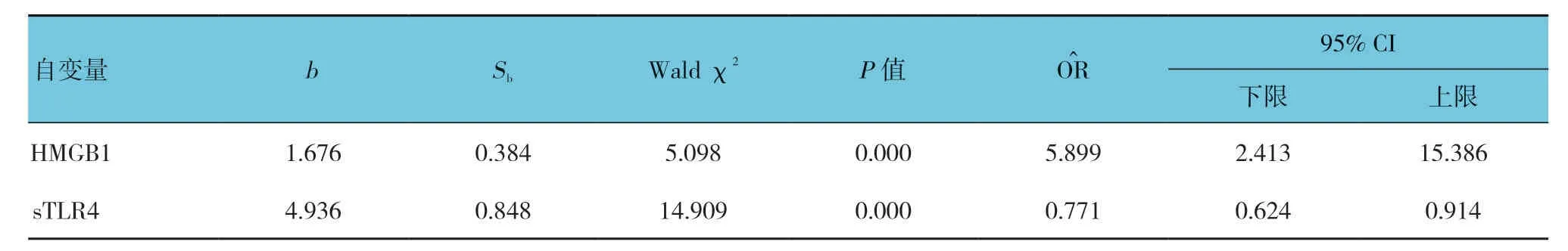
表2 影响HCA 发生的多因素Logistic回归分析参数
2.3 HMGB1、sTLR4、WBC 对HCA的诊断价值
经ROC曲线分析,HMGB1、sTLR4、WBC 联合诊断HCA的曲线下面积(area under the curve,AUC)为0.864(95% CI:0.826,0.895),敏感性和特异性分别为0.686(95% CI:0.623,0.694)和0.901(95% CI:0.871,0.925)。见图1。
2.4 胎膜早破产妇血清学指标、是否发生HCA与新生儿发生EOS的关系
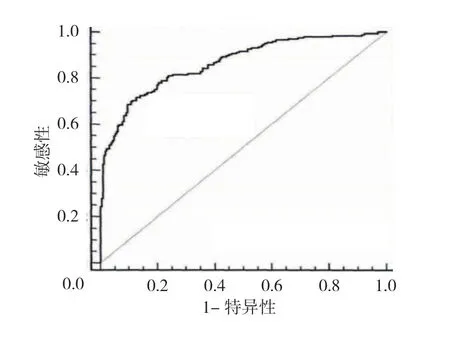
图1 外周血HMGB1、sTLR4、WBC 联合诊断HCA的ROC曲线
追踪新生儿EOS的发生情况,结果显示21例(6.69%)新生儿发生EOS,其余293例(93.31%)新生儿未发生EOS。根据诊断结果,比较EOS组产妇和非EOS组产妇临床资料及第一产程时血液生物化学指标,EOS组与非EOS组外周血HMGB1、sTLR4水平及是否合并HCA例数比较,经非参数检验或t检验或χ2检验,差异有统计学意义(P<0.05),EOS组HMGB1、sTLR4水平高于非EOS组,合并HCA例数多于非EOS组。而两组其余临床资料及血液生物化学指标比较,差异无统计学意义(P>0.05)。见表3。
2.5 HMGB1、sTLR4 对EOS的预测价值
经ROC曲线分析,HMGB1、sTLR4 联合预测EOS的AUC为0.888(95% CI:0.840,0.926),敏感性和特异性分别为0.861(95% CI:0.837,0.882)和0.768(95% CI:0.717,0.804)。见图2。

表3 两组临床资料及血液生物化学指标比较

图2 外周血HMGB1、sTLR4 联合预测EOS的ROC曲线
3 讨论
胎膜早破是指由于感染、胎膜发育不良、宫内压异常或子宫功能异常等原因导致分娩前胎膜自然破裂,若胎膜破裂>24 h,新生儿发生败血症的风险将大大增加[6]。普遍认为CAM是发生胎膜早破最重要的危险因素之一,我国感染率较高[7]。但是由于大部分CAM患者在发病早期并不会出现典型的感染症状,临床将其定义为HCA;只有部分晚期患者会出现体温升高、血常规异常及阴道分泌物异味等情况。CAM对母婴结局影响极大,>40% CAM患者可发生早产,更是引发胎儿窘迫、宫内感染、新生儿窒息及早期败血症等并发症最重要的危险因素[8]。临床一旦确诊为CAM,需在抗炎基础上及时终止妊娠,因此早诊断、早干预对改善CAM 妊娠结局及降低胎儿死亡率具有极其重要的临床价值。
炎症反应是机体通过识别一系列危险因子后对病原菌、创伤等危险事件作出的防御反应[9]。其中警报素就属于一类内源性危险因子,可以募集活化抗原提呈细胞,同时诱导固有免疫细胞应答[9]。HMGB1 属于典型的警报素家族成员,定位于细胞核和细胞质中,通过与TLR4和RAGE 受体结合,参与炎症反应、免疫反应及细胞生物学行为调控等多种生理病理过程[10]。sTLR4与sRAGE是其受体在血清中的可溶形式。目前临床逐渐有学者开始关注羊水中HMGB1与HCA的关系,但是鲜少有研究探讨外周血中HMGB1及其相应受体对HCA的诊断价值。本研究发现,产妇外周血中HMGB1和sTLR4水平与HCA的发生关系密切,且联合WBC 可作为诊断HCA的有效指标,从而为建立非侵入性HCA 早产诊断模型奠定了实验基础。本研究中,HCA组孕妇HMGB1、sTLR4水平高于非HCA组孕妇,HCA组和非HCA组孕妇外周血sRAGE 水平比较无差异,说明同样作为HMGB1 受体的可溶性片段,两者在发生HCA 中扮演的角色存在一定的差异,而且产妇临产外周血HMGB1是发生HCA的独立危险因素,而sTLR4是发生HCA的独立保护因素。sTLR4是由TLR4 mRNA 选择性剪切体编码的一种具有稳定结构的可溶性蛋白分子,而sRAGE则是RAGE 胞外段的截断形式。KACEROVSKY 等学者[11]对102例孕妇进行羊膜穿刺检测sTLR4水平,结果显示羊水中sTLR4水平升高与HCA的发生呈正相关。推测主要是由于sTLR4与TLR4 受体胞外结构域十分相似,可作为诱饵受体阻断TLR4与HMGB1 配体结合,因此sTLR4 被认为是TLR4的负调节机制之一,在炎症时水平会升高,可作为急性炎症反应期诊断的生物标志物。而RAGE 属于免疫球蛋白超家族成员,BASTEK 等学者[12]证实孕产妇分娩前外周血清sRAGE 水平与早产呈负相关,sRAGE 水平降低预示着早产发生的风险更高。HMGB1/RAGE是介导慢性炎症的重要通路,因此在HCA 发生过程中,由TLR4介导的急性炎症反应可能发挥更为重要的作用。
除此以外,CAM和HCA 都是引发EOS 最重要的独立危险因素[13]。近年来,随着医疗技术和护理水平的提高,新生儿败血症的死亡率有所下降,但是仍然是导致早产儿或胎膜早破围产儿死亡的重要原因。EOS是新生儿出生7 d 内发生的全身炎症反应,起病隐匿且进展迅速,加上免疫系统发育不完善,极易引发脓毒血症甚至死亡,因此早诊断、早干预对降低死亡率、改善预后具有重要的临床价值。目前国内外最常使用的检测手段包括外周血血常规、CRP、PCT及血培养等。血培养是公认的诊断新生儿细菌感染的金标准,但是由于培养时间长,对培养条件和血液标本要求较高;同时新生儿采血困难、血液标本量较少,因此导致早期阳性率较低,容易延误病情。WBC、PLT及CRP 等非特异性指标作为EOS诊断的敏感性较低,因此笔者进一步考虑HMGB1是否也可作为EOS的预警分子。
笔者在证实HMGB1及其受体sTLR4 在CAM相关胎膜早破的产妇血清中水平升高,由此推断HMGB1可能会参与炎症因子造成的胎儿和新生儿损伤。既往有研究提出,HMGB1及其受体在感染性疾病所造成的的胎儿脑、肝等器官损伤中具有重要作用[14]。因此本研究中,笔者分析了HMGB1 对EOS的预警价值,且联合sTLR4的预测效能较高。需要指出的是,笔者在分析HMGB1及其受体与EOS的关系时,并未采用新生儿的数据,主要是考虑到临床可操作性,希望通过探讨母体警报素HMGB1及其可溶性受体水平的生物标志物意义,构建一个非侵入型预测模型。
综上所述,HCA相关胎膜早破产妇血清中HMGB1及其受体sTLR4水平升高,有望成为早期诊断孕妇发生HCA 潜在的敏感性指标。此外母体外周血HMGB1水平升高是新生儿发生EOS的独立危险因素,因此HMGB1和sTLR4 对预测新生儿EOS 也具有一定的临床价值。
