不同病理级别膀胱神经内分泌肿瘤CT表现
2020-09-25谌丹丹江新青杨蕊梦刘国顺魏新华
谌丹丹,江新青,杨蕊梦,刘国顺,魏新华
(广州市第一人民医院放射科,广东 广州 510180)
神经内分泌肿瘤(neuroendocrine tumor, NET)是起源于神经内分泌系统的一组异质性肿瘤,可发生于全身任何部位,以肺、胃肠道和胰腺最常见,原发于膀胱者罕见,占膀胱恶性肿瘤比例<1%[1]。肿瘤分级与其生物学行为、预后及治疗方式密切相关,而不同病理级别NET的影像学表现存在差异。本研究观察不同病理级别膀胱NET的CT特征。
1 资料与方法
1.1 一般资料 回顾性分析2003年1月—2019年5月17例于广州市第一人民医院经病理确诊的膀胱NET患者,男13例,女4例,年龄39~86岁,平均(63.5±13.8)岁。纳入标准:①术前1个月内接受盆腔CT检查,此前未接受任何治疗;②临床、影像学及病理资料完整。临床表现:阵发性高血压2例,伴排尿时心悸、出汗;尿痛、排尿困难2例;间断或全程肉眼血尿,伴或不伴尿痛、尿急等症状12例。1例无症状,为体检偶然发现。
1.2 仪器与方法 检查前嘱患者适度饮水以充盈膀胱。采用Toshiba Aquilion ONE 320层或16层螺旋CT机行盆腔扫描,范围自髂棘连线至耻骨联合水平,参数:管电压120 kV,管电流180~300 mA,层厚2 mm,层间距2 mm,平扫后经肘静脉注入非离子型对比剂优维显(300 mgI/ml)1.5~2.0 ml/kg体质量行动态增强扫描,分别于注射对比剂后25~40 s(动脉期)、54~60 s(静脉期)及5 min(延迟期)开始采集。
1.3 图像分析 由2名具有10年腹盆部疾病影像学诊断经验的副主任医师采用盲法分析所有图像,意见不一致时经讨论决定,观察肿瘤CT表现,包括最大径、边界(清或不清)、内部成分(包括囊变坏死、钙化)、周围侵犯及转移(有无侵犯浆膜、邻近组织器官、是否存在淋巴结或远处转移),淋巴结转移指短径≥1 cm且增强后强化不均。于各期图像上手动勾画病灶ROI,尽量避开囊变坏死、钙化或血管区域,将增强图像ROI置于病灶强化最显著处,获得病灶平扫CT值(CTps)、动脉期CT值(CTa)及静脉期CT值(CTv),每期图像测量3次,取其均值为最后结果,并计算肿瘤动脉期绝对强化程度(A)=CTa-CTps,静脉期绝对强化程度(V)=CTv-CTps。
1.4 病理分级 由于膀胱NET镜下形态与其他部位(肺、胃肠道及胰腺等)NET类似[2],参照2010年WHO消化道NET分级标准,将膀胱NET分为G1~G3级。G1级:核分裂象数<2/10 HPF和/或Ki-67增殖指数≤2%;G2级:核分裂象数2~20/10 HPF和/或Ki-67增殖指数3%~20%;G3级:核分裂象数>20/10 HPF和/或Ki-67增殖指数>20%。其中G1和G2级(以下简称G1/2级)为低级别NET,G3级为高级别NET[3]。
1.5 统计学分析 采用SPSS 18.0统计分析软件。计量资料以±s表示,计数资料以频数表示。将17例膀胱NET分为低级别组(G1/2级)和高级别组(G3级)。采用两独立样本t检验比较2组年龄、肿瘤最大径、CTps、A值及V值差异;以Fisher精确概率分析比较组间性别及肿瘤边界、囊变坏死、钙化及周围侵犯转移差异。P<0.05为差异有统计学意义。
2 结果
17例膀胱NET均为单发病灶,包括2例类癌(1例G1级、1例G2级)、6例副神经节瘤(5例G1级、1例G2级)、1例恶性副神经节瘤(G3级)及8例小细胞癌(G3级)。低级别组8例,男4例,女4例,平均年龄(54.1±12.7)岁;高级别组9例,均为男性,平均年龄(72.0±8.6)岁;2组间年龄(t=-3.43)及性别差异均有统计学差异(P=0.04、0.03),高级别组年龄大于低级别组,且以男性多见。
低级别组肿瘤最大径(1.35±0.61)cm,其中6例密度均匀,未见囊变坏死;8例均未见周围侵犯及远处转移。高级别组肿瘤最大径(3.08±1.34)cm,8例内见囊变坏死,8例见周围侵犯及转移(包括8例侵犯邻近膀胱壁及周围脂肪间隙、1例侵犯前列腺及2例淋巴结转移)。组间肿瘤最大径、囊变坏死、周围侵犯及转移差异均有统计学意义(P均<0.05),而肿瘤边界(P=0.05)及内部钙化差异无统计学意义(P=1.00)。增强后低级别组肿瘤动脉期均呈明显强化,CTa值78~128 HU,A值43~73 HU;高级别组肿瘤7例表现为动脉期轻-中度强化,CTa值41~68 HU,A值16~37 HU。组间A值差异有统计学意义(P<0.01),CTps值及V值差异无统计学意义(P均>0.05)。见表1及图1~3。
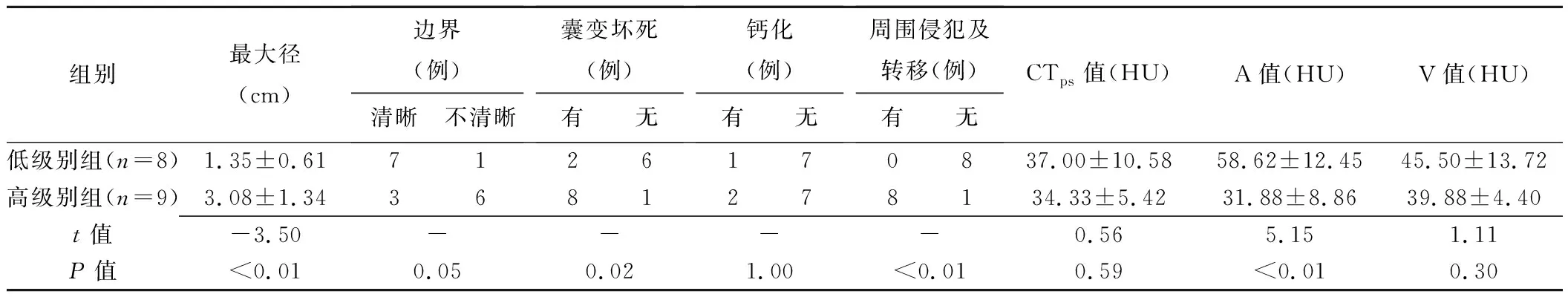
表1 2组膀胱NET的CT特征比较

图1 患者女,51岁,膀胱NET(G1级,类癌,Ki-67阳性率1%) A.平扫CT示膀胱右侧壁小结节以短蒂与膀胱壁相连,最大径约2.5 cm,边界清,密度均匀,未见囊变坏死,短蒂内见斑点状钙化; B.增强动脉期CT示病灶明显均匀强化
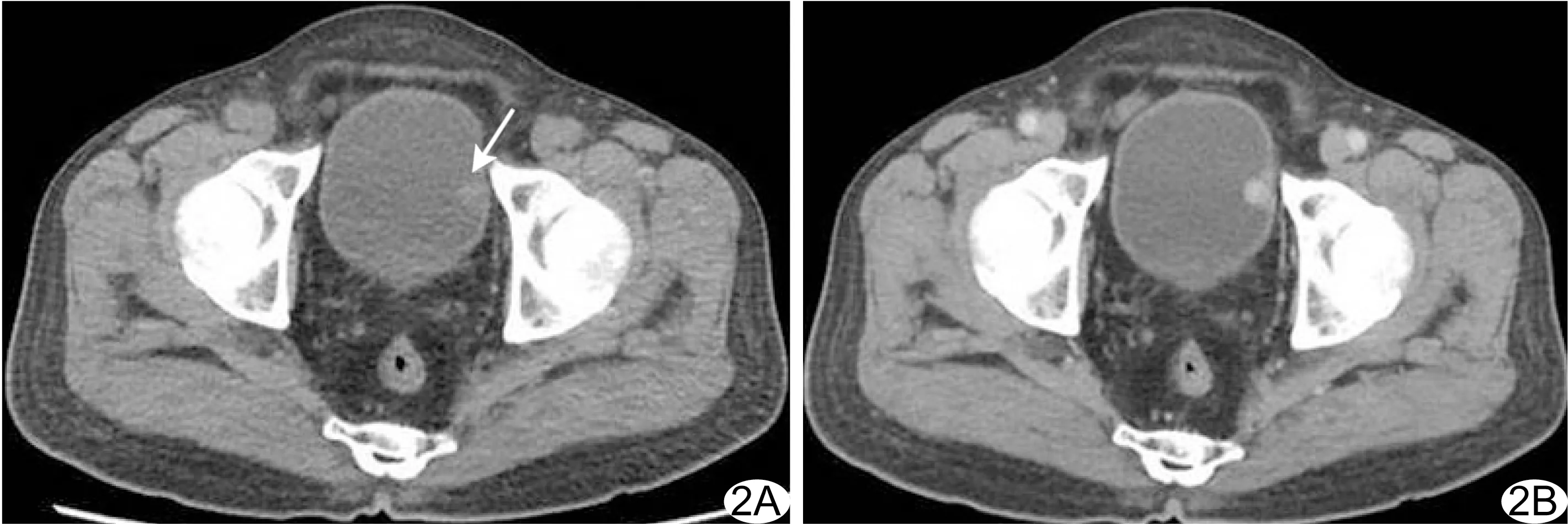
图2 患者男,76岁,膀胱NET(G2级,副神经节瘤,Ki-67阳性率5%) A.平扫CT示膀胱左侧壁小类圆形等-稍低密度结节,最大径约1.2 cm,密度均匀,宽基底,凸向腔内,边界欠清(箭示病灶); B.增强动脉期CT示病灶明显均匀强化,周围脂肪间隙清晰
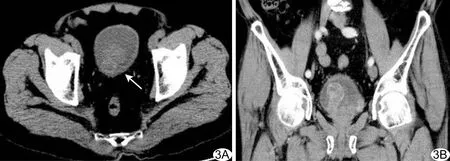
图3 患者男,63岁,膀胱NET(G3级,小细胞癌,Ki-67阳性率90%) A.平扫CT示膀胱右后壁不规则形软组织肿块,最大径约5.5 cm,密度不均,内见低密度囊变坏死区(箭示病灶); B.增强动脉期CT示病灶轻-中度不均匀强化,凸向膀胱腔内,邻近膀胱壁不规则增厚,与后下方前列腺分界不清,周围脂肪间隙模糊
3 讨论
2016年WHO泌尿系肿瘤新分类[4]根据分化程度将膀胱NET分为高分化肿瘤(包括类癌和不典型类癌)、低分化肿瘤(包括小细胞神经内分泌癌、大细胞神经内分泌癌)和副神经节瘤(排除发生于皮下交感神经节者);根据核分裂象和Ki-67指数可将其分为3个病理级别,即G1~G3,分化程度较高的低级别(G1、G2级)肿瘤恶性程度低,预后良好,可行单纯手术切除,而分化不良的高级别(G3级)肿瘤恶性程度高,预后差,手术切除病灶后应辅以放射及化学治疗。术前明确肿瘤病理级别,对临床选择治疗方案及预防复发具有重要意义。
原发于膀胱的NET较罕见,可见于膀胱壁任何部位,以侧壁多见,其次是顶壁和后壁;好发于50岁以上中老年人,男性略多于女性。本研究高级别组年龄大于低级别组,且以男性多见,推测与小细胞神经内分泌癌好发于老年男性,且在高级别肿瘤中最多[5]有关。膀胱NET临床无特异性表现,以血尿和排尿刺激症状最常见。膀胱起源于后肠末端膨大的泄殖腔腹侧,无嗜银或亲银特性的Kultschitzky细胞,因此发生于膀胱的NET无类癌综合征表现。本组中12例(12/17)以血尿为首发症状,均无类癌综合征表现,仅2例(2/17)副神经节瘤患者出现阵发性高血压。
KIM等[6]发现随病理级别升高,肿瘤最大径有增大趋势,本研究结果与之相符,高级别组肿瘤最大径大于低级别组,高组别组6例(6/9)最大径92.5 cm,而低级别组7例(7/8)最大径<2.0 cm。低级别肿瘤密度多均匀,与周围组织分界清晰;而高级别肿瘤密度多不均匀,内多见囊变坏死,与周围组织分界不清,易侵犯邻近组织或转移,与既往报道[7-8]相符,即肿瘤病理级别越高,异质性越大,囊变坏死越明显,侵袭性越强,突破包膜侵犯周围脏器及发生淋巴结转移的可能性越大。
本研究中2组肿瘤增强后动脉期强化程度不一,低级别组均见明显强化,强化程度≥40 HU,而高级别组以轻-中度强化为主,强化程度≤40 HU;低级别组A值高于高级别组,即A值减低可能提示肿瘤病理分级更高。本研究结果与多项胰腺NET研究[9-11]结果均显示动脉期肿瘤强化程度随病理级别升高而减低。肿瘤血流量与微血管密度(microvascular density, MVD)成正比[12],低级别肿瘤MVD高,增强后强化明显;而高级别肿瘤MVD较低,增强后强化程度较低。但吕海娟等[13]发现直肠NET动脉期强化程度增高者病理分级更高,本研究结果与其相左,有待进一步观察。
综上所述,不同病理级别膀胱NET的CT表现有一定特征性,结合临床有助于诊断。本研究不足之处: 样本量小;研究比较G1级与G2级肿瘤特征;延迟扫描膀胱内对比剂充填,影响测量病灶CT值,未能全面描述增强CT特征。
