温度处理对六堡茶茶苗抗性生理和DNA甲基化水平的影响
2020-09-24叶锦培陈仕香唐世斌黄欣宇黄爱萍黎敏芝李晓丽
叶锦培 陈仕香 唐世斌 黄欣宇 黄爱萍 黎敏芝 李晓丽

摘要:于25 ℃(CK)、15 ℃和5 ℃条件下,水培六堡茶茶苗1个月后,测定叶片中MDA含量,CAT、SOD、POD活性及DNA甲基化水平。结果表明,温度从25 ℃降到5 ℃时,六堡茶茶苗MDA含量、CAT活性和DNA甲基化水平呈现“低-高-低”的趋势,15 ℃时高于对照组,表明适当低温对MDA含量、CAT活性和DNA甲基化水平有较强的刺激作用,当温度低到一定程度时,则会对其有一定的抑制作用;SOD、POD活性呈现“高-低-高”的趋势,15 ℃时低于对照组,5 ℃时高于对照组,表明适当的低温对SOD、POD活性有一定的抑制作用,而随着温度继续降低则会对其有促进作用。研究结果有利于了解六堡茶的抗寒机理,并为六堡茶的耐寒种质资源选择提供参考依据和理论指导。
关键词:温度;胁迫;抗性生理;DNA甲基化;六堡茶
中图分类号:S571.101;TS272
文献标志码:A
文章编号:1002-1302(2020)16-0164-04
在生长过程中,植物可能会遇到各种环境胁迫。植物处在逆境状态下,其体内的活性氧会大量积累,导致其不能正常生长,甚至死亡。植物体内的保护酶可以清除过量的活性氧,維持其动态平衡。保护酶CAT(过氧化氢酶)、SOD(超氧化物歧化酶)、POD(过氧化物酶)在植物抗逆性方面发挥重要作用。低温诱导下抗氧化酶基因表达提高,增强了这些抗氧化酶的活性以维持植物体内活性氧的动态平衡,增强植物对低温的抗性。同时,胁迫下植物叶片中MDA含量也会增大,膜脂过氧化加剧,膜透性增强。
DNA甲基化是植物生长发育中普遍存在的一种现象。研究植物DNA甲基化与环境胁迫之间的关联,可为环境胁迫对植物生长发育的影响提供理论基础,为农林业生产发展提供指导。
六堡茶因最早产自于广西梧州市苍梧县六堡镇而得名[1],其生产历史悠久,被列为全国二十四名茶之一[2]。20世纪50年代,六堡茶主导香港市场,后热销东南亚[3]。近年来,随着黑茶的消费热潮,六堡茶的年产量和出口量均出现快速增长[4]。六堡茶的区域品牌价值在黑茶类中一直稳居前列,梧州市政府出台多项政策措施扶持六堡茶的健康可持续发展。
六堡茶原产地广西梧州地处北回归线以南,气候温暖湿润,因此六堡茶对于低温的适应性相对较弱,特别是2008年的雨雪冰冻灾害席卷全国,六堡茶产区也不能幸免。随着全球变暖,近年来极端天气和气候事件频繁发生,探讨六堡茶对低温的抗性以及遭受低温时的生理生化变化,对于六堡茶的选育和栽培乃至产业的发展有重要意义。本研究通过在不同温度环境下对六堡茶茶苗进行水培,探讨低温胁迫下六堡茶茶苗的抗性生理和DNA甲基化水平差异,不仅可揭示六堡茶的抗寒机理,同时为六堡茶的耐寒种质资源选择提供参考依据。
1 材料与方法
1.1 试验材料及处理
本次试验材料选自广西苍梧县国有天洪岭林场六堡茶六堡群体种扦插苗,所选茶苗长势大体一致(苗高约30 cm)。把茶苗根系土壤洗净后放入盛有1 L 1/2Hoagland营养液的水桶中水培,使茶苗适应水培环境,期间每周更换营养液。水培1个月后,将茶苗分别置于全光照培养箱中培养,温度设置3个处理,分别为5 ℃、15 ℃和25 ℃(CK),每处理3个重复水桶,每个水桶放置茶苗11株。在恒温条件下培养1个月,每周更换营养液。每日光照时间为12 h(07:00—19:00),光照度为7 500 lx。各处理1个月后,茶苗都长出嫩叶,采集枝条顶部新长出的2~3张嫩叶和芽保存在4 ℃低温下用以测定生物指标。
1.2 抗性生理指标测定
采用南京建成生物工程研究所的试剂盒提取MDA、CAT、SOD和POD,提取步骤参照试剂盒说明书。采用TBA法测定MDA含量,采用可见光法测定CAT、POD活性,采用羟胺法测定SOD活性。
1.3 DNA甲基化水平
1.3.1 DNA提取 六堡茶茶苗叶片基因组DNA的提取采用康为世纪生物科技有限公司的新型植物基因组DNA试剂盒,提取步骤参照试剂盒说明书,提取的DNA保存于-20 ℃下。取10 μL DNA提取液,采用紫外分光光度计测定D260 nm和D280 nm,以D260 nm估算DNA产率,D260 nm/D280 nm判断DNA样品纯度。
1.3.2 DNA甲基化水平测定 六堡茶茶苗叶片DNA中5-甲基胞嘧啶和胞嘧啶的测定主要参照黑淑梅等的方法[5],首先配制好2 mol/L HCl溶液和 4 mol/L NaOH溶液各1 L。移取上述DNA溶液 20 μL于1.5 mL离心管中,再吸取20 μL 2 mol/L HCl于其离心管中,于恒温水浴锅中80 ℃水解 120 min,水解后吸取20 μL 4 mol/L NaOH于离心管中以中和HCl,4 000 r/min离心分离1 min,移取上清液于新的离心管中,待测5-甲基胞嘧啶(5-MeC)的含量。
将50 mg胞嘧啶标准品溶解于500 μL的TE缓冲液中(浓度为100 μg/μL),再取0.75 μL溶于1.5 mL TE缓冲液配制成浓度为50 μg/μL的胞嘧啶标准品溶液。5-甲基胞嘧啶标准品溶液也以相同方式制备。
用高效液相色谱法测定六堡茶茶苗DNA甲基化水平。色谱柱:Hypersil BDS-C18键合柱(5 μm,150 mm×46 mm)。流动相的组成成分:5%甲醇,4.75 mmol/L己烷磺酸钠,0.2%三乙醇胺。流动相用娃哈哈纯净水配制,再用磷酸将其pH值调为5.5。流速:0.7 mL/min。检测波长:273 nm,进样量:10 μL,运行时间:15 min。胞嘧啶和5-甲基胞嘧啶标准品进样量分别为2、4、6、8、10 μL,其对应的浓度为10、20、30、40、50 μg/μL。
1.4 数据分析
六堡茶茶苗叶片DNA的胞嘧啶(C)和5-甲基胞嘧啶(5-MeC)的含量,运用外标准法计算。先比较样品和标准品的峰面积,再根据公式[5-MeC/(C+5-MeC)]×100%计算5-MeC的百分含量。用MS Excel 2007對所有数据进行整理后,用SPSS 19.0进行数据分析。
2 结果与分析
2.1 低温对六堡茶茶苗抗性生理的影响
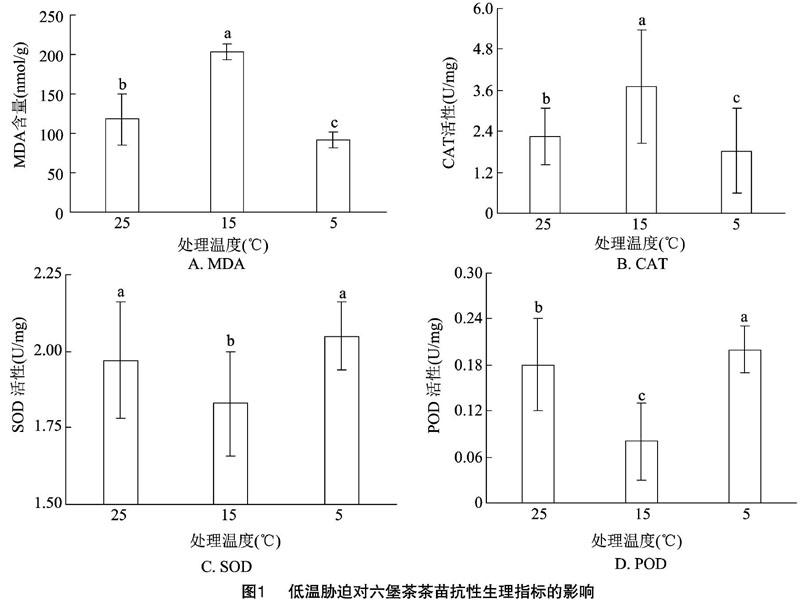
2.1.1 MDA含量 从对照温度(25 ℃)降到5 ℃时,MDA含量呈现“低—高—低”的趋势(图1-A)。对照MDA含量为117.66 nmol/g,15 ℃时MDA含量高于对照组73.07%(203.63 nmol/g),而5 ℃时则低于对照组22.37%(91.34 nmol/g)。适当的低温对MDA有较强的刺激作用,当温度低到一定程度时,则对MDA有一定的抑制作用。
2.1.2 CAT活性 从对照温度(25 ℃)降到 5 ℃ 时,CAT活性呈现“低-高-低”的趋势(图1-B)。对照CAT活性为2.25 U/mg,15 ℃时CAT活性高于对照组64.44%(3.70 U/mg),而5 ℃时则低于对照组19.11%(1.82 U/mg)。适当的低温对CAT有较强的刺激作用,当温度低到一定程度时,则对CAT有一定的抑制作用。
2.1.3 SOD活性 从对照温度(25 ℃)降到 5 ℃ 时,SOD活性呈现“高—低—高”的趋势(图1-C)。对照SOD活性为1.97 U/mg,15 ℃时SOD活性低于对照组7.11%(1.83 U/mg),而5 ℃时则高于对照组4.06%(2.05 U/mg)。适当的低温对SOD有一定的抑制作用,温度为5 ℃时对SOD有促进作用。
2.1.4 POD活性 从对照温度(25 ℃)降到 5 ℃ 时,POD活性呈现“高—低—高”的趋势(图1-D)。对照POD活性为0.18 U/mg,15 ℃时POD活性低于对照组55.56%(0.08 U/mg),而5 ℃时则高于对照组11.11%(0.20 U/mg)。适当的低温对POD有一定的抑制作用,随着温度的继续降低对POD有刺激作用。
2.2 低温对六堡茶茶苗DNA 5-甲基化的影响
如图2-A和2-B,以浓度(μg/μL)为横坐标,峰面积(×10 000)为纵坐标绘制标准曲线。
标准品胞嘧啶的线性方程为y=12 590x+3 212,r2=0.999 6;标准品5-甲基胞嘧啶线性方程为y=37 715x-16 156,r2=0.999 6;说明胞嘧啶和5-甲基胞嘧啶在0~50 μg/μL范围内,分别都有良好的线性关系。
从对照温度(25 ℃)降到5 ℃时,六堡茶DNA甲基化水平呈现“低-高-低”的趋势,如图3所示。对照组DNA甲基化水平为9.79%,15 ℃时为27.36%,高于对照组179.47%,而5 ℃时为24.14%,高于对照组146.58%。结果表明,适当的低温对DNA甲基化水平有一定刺激作用,当温度低到一定程度时,则对DNA甲基化水平有一定的抑制作用。
3 讨论与结论
3.1 低温胁迫对六堡茶茶苗抗性生理的影响
活性氧是与氧代谢有关过程的中间产物,其中以自由基形式存在的活性氧会导致植物不能正常生长发育,加速植物衰老,甚至导致死亡[6]。六堡茶茶苗体内的活性氧和活性氧清除系统,在正常情况下能够保持着动态平衡。当遭受到胁迫时,六堡茶茶苗的光合作用受阻,部分氧气被作为电子受体形成超氧阴离子自由基(O-2·),其体内就会累积超过动态平衡的活性氧,超越活性氧清除系统的能力范围,就会破坏细胞结构和功能,使六堡茶茶苗的生长受阻。
CAT、SOD和POD是六堡茶茶苗体内酶催清除系统中的主要成员。在清除活性氧时,SOD是第一个发挥作用的抗氧化酶,催化O-2·发生歧化反应,产生H2O2和水。CAT和POD可以阻断自由基链式反应,通过不同的方式把H2O2分解为水和氧气。六堡茶茶苗体内非酶系统产生的氧自由基,能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并由此形成脂质过氧化物,使茶苗组织细胞受损伤。MDA是脂质氧化终产物,作为膜脂过氧化指标,直接反映六堡茶茶苗的受损程度。
本研究表明,随着温度降低,MDA含量先呈现上升状态,膜脂过氧化程度增大,在15 ℃后开始下降,膜脂过氧化程度减小,说明15 ℃的低温对六堡茶茶苗的生长有抑制作用,受损程度最大。随着温度降低,六堡茶茶苗的CAT活性先增加后降低,SOD和POD则随着温度的降低先下降后上升。当SOD和POD活性较低时,为了维持活性氧与活性氧清除系统的平衡,CAT活性增大,在维持活性氧平衡中发挥主要作用。在15 ℃时,SOD和POD活性降低的原因目前尚不明确,推测可能与茶苗对低温的适应机制有关,15 ℃可以导致酶活性的下降但并不足以使SOD和POD在茶苗体内高度表达。同时,SOD、POD活性与MDA含量紧密相关[7],MDA是自由基引起的膜脂过氧化的产物,而SOD则是清除自由基的主要抗氧化酶[8],随着温度降低,六堡茶茶苗的MDA含量先升高后降低,SOD活性先下降后升高,两者呈现负相关。低温抑制了六堡茶茶苗的SOD活性,使活性氧大量积累,MDA含量增大,加大了膜脂过氧化程度,破坏了膜的完整性,使得茶苗叶片不能正常生长,进而危害六堡茶茶苗的整体。
3.2 低温胁迫对六堡茶茶苗DNA甲基化水平的影响
DNA甲基化是六堡茶茶苗调控其基因表达的重要手段之一,在低温驯化过程中,某些与耐寒相关的基因被激活,从而使六堡茶茶苗适应低温逆境。Choi等的研究表明,低温胁迫下植物的相关抗逆基因发生去甲基化,增加相应基因的表达量来应对低温逆境[9]。因此,低温(15 ℃和5 ℃)下,六堡茶茶苗为了适应低温而使基因组总体上趋向于去甲基化从而调控某些耐寒基因表达,进而增强了六堡茶茶苗对低温的适应性。周艳华等利用MSAP技术分析发现,与对照组相比,低温处理期间茶树样品和低温处理之后茶树样品,其基因组DNA同时发生甲基化和去甲基化,甲基化水平高于去甲基化水平,因此总体甲基化水平呈现增加趋势[10],这与本研究结果相一致。
低温胁迫下,六堡茶茶苗DNA甲基化水平呈现先升高后降低的趋势,可能是因为温度从25 ℃降到15 ℃,对甲基转移酶、染色质甲基化酶和重新甲基化酶的活性抑制不大,甚至还有所促进,从而提高了六堡茶茶苗DNA甲基化水平。当温度进一步降低,则抑制了这些参与DNA甲基化酶的活性,从而使六堡茶茶苗的DNA甲基化水平有所降低。
本研究分别于25 ℃、15 ℃和5 ℃下水培六堡茶茶苗,测定叶片中MDA含量,CAT、SOD和POD活性以及叶片中DNA甲基化水平。研究表明,适当低温对六堡茶茶苗叶片中MDA含量、CAT活性和DNA甲基化水平有较强的刺激作用,当温度低到一定程度时,则会对其有一定的抑制作用。同时,适当的低温对六堡茶茶苗叶片中SOD和POD活性也有一定的抑制作用,而随着温度继续降低,则会对其有促进作用。本研究结果不仅可以揭示六堡茶的抗寒机理,而且可为六堡茶的耐寒种质资源选择提供理论指导。
参考文献:
[1]龙志荣,邱瑞瑾,马士成,等. 六堡茶研究进展[J]. 中国茶叶加工,2017(1):40-45.
[2]龙志荣,马士成,梅 宇,等. 2013年全国六堡茶产销形势分析报告[J]. 茶世界,2013(7):16-22.
[3]溫志杰,石荣强,何勇强,等. 六堡茶渥堆过程中微生物种群变化的研究[J]. 安徽农业科学,2012,40(2):1009-1011.
[4]陈小强,叶 阳,成 浩,等. 六堡茶的理化分析研究[J]. 中国农学通报,2008(7):77-80.
[5]黑淑梅. 重金属铬对小麦根系DNA甲基化水平的影响[J]. 吉林农业科学,2012,37(2):14-15,26.
[6]陈巧艳,李迎迎,陈刘平,等. 低温胁迫对不同小麦品种结实率和活性氧代谢的影响[J]. 江苏农业科学,2018,46(11):63-65.
[7]王宝山,赵思齐. 干旱对小麦幼苗膜脂过氧化及保护酶的影响[J]. 山东师大学报:自然科学版,1987(1):29-38.
[8]勾晓华,王勋陵. 氟化氢对植物叶片中SOD酶活力和MDA含量的影响[J]. 西北植物学报,1995(5):71-76.
[9]Choi C S,Sano H. Abiotic-stress induces demethylation and transcriptional activation of ageneencoding a glycero phosphodie sterase-like protein in tobacco plants[J]. Molecular Genetics and Genomics,2007,277(5):589-600.
[10]周艳华,曹红利,岳 川,等. 冷驯化不同阶段茶树DNA甲基化模式的变化[J]. 作物学报,2015(7):1047-1055.