绿色木霉与哈茨木霉对黄瓜幼苗促生作用机理的研究
2020-09-24刘畅张欣玥蔡汶妤徐洪伟周晓馥
刘畅 张欣玥 蔡汶妤 徐洪伟 周晓馥
摘要:为探究绿色木霉和哈茨木霉对黄瓜幼苗生长的影响,设置4种处理:以绿色木霉和哈茨木霉混合菌液灌根处理的黄瓜幼苗、绿色木霉灌根处理的黄瓜幼苗、哈茨木霉灌根处理的黄瓜幼苗、PD培养基灌根处理的黄瓜幼苗,对株高、茎粗、叶宽、叶绿素含量和荧光特性、丙二醛(MDA)含量、过氧化物酶(POD)活性等进行测定。结果表明,与对照相比,施加混合木霉的黄瓜幼苗株高、叶宽、茎粗、叶绿素含量显著增加,最大光化学效率(Fv/Fm)、PSⅡ潜在活性(Fv/Fo)、光化学淬灭系数(qP)、光合电子传递速率(ETR)、PSⅡ实际光量子产量[Y(Ⅱ)]以及POD活性显著增加,同时非光化学淬灭系数(NPQ)及MDA含量显著降低,表明绿色木霉和哈茨木霉混合菌液能够显著促进黄瓜幼苗生长,效果优于施加单种菌液。
关键词:哈茨木霉;绿色木霉;黄瓜幼苗;促生效应
中图分类号:S642.201
文献标志码:A
文章编号:1002-1302(2020)16-0156-04
黄瓜(Cucumis sativus L.)是葫芦科一年生蔓生或攀援草本植物。黄瓜是我国最主要的食用蔬菜种类之一,其种植面积逐年增长,所以促进黄瓜生长在蔬菜生产中具有重要意义。
木霉菌(Trichodema spp.) 是生防真菌,在自然界中广泛存在,通常分布于植物残体、植物根以及土壤等环境中。目前,绿色木霉(Trichoderma aviride) 和哈茨木霉(Trichoderma harzianum)是木霉菌中常用的2种木霉[1]。Gajera等以黑曲霉侵染的花生为试验材料,研究表明,木霉菌处理可以提高花生超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)、抗坏血酸过氧化物酶(APX)活性[2]。Metwally等以洋葱为试验材料,研究表明,绿色木霉和丛枝菌根真菌不仅能提高洋葱的鲜干质量、根长、茎长和叶面积等生长参数,而且能提高洋葱叶片的叶绿素、类胡萝卜素和总色素含量[3]。李艳娟等研究表明,木霉可以促进杉木种子萌发与幼苗生长,且可以提高其抗逆性[4]。Poveda等研究發现,哈茨木霉在十字花科植物根部定植和诱导系统防御中起着关键作用[5]。Elkelish等以番茄幼苗为试验材料,研究表明,哈茨木霉可通过调节生理生化及分子机制,减轻水涝后番茄幼苗的生长变化[6]。Panitch等研究发现,生防剂、哈茨木霉和枯草芽孢杆菌共同处理可以提高木瓜愈伤组织中咔唑类生物碱的积累量[7]。
绿色木霉和哈茨木霉能有效地促进植物生长,同时有着成本低廉、使用安全、持续效果好、增产稳定等多种优点。前人的研究多以单一木霉菌种处理的植物为试验材料,本研究采用绿色木霉和哈茨木霉菌液灌根处理的黄瓜幼苗为试验材料,观察绿色木霉和哈茨木霉对黄瓜幼苗生长的影响,比较分析施加混合木霉与施加单种木霉的作用效果,以期为2种菌株在农业生产上的应用提供依据。
1 材料与方法
1.1 供试材料
供试黄瓜品种:津研四号。
供试培养基:马铃薯葡萄糖琼脂(PDA)固体培养基;马铃薯葡萄糖(PD)液体培养基。
供试菌株:绿色木霉和哈茨木霉菌种由笔者所在实验室保存。
供试土壤:黑土,在高压灭菌锅中高温灭菌2 h,放凉备用。
1.2 试验设计
盆栽试验于2019年10—12月在吉林省植物资源科学与绿色生产重点实验室内进行。盆栽使用的花盆直径为28 cm、高为25 cm,每盆播种4穴,每穴 5~6粒种子。在黄瓜播种后 5 d 即真叶初展时,挑取长势较一致的黄瓜幼苗,利用木霉发酵液进行灌根接种,每2 d浇1次处理后,35 d进行指标测定。试验设4个处理:①绿色木霉和哈茨木霉灌根处理,施10 mL混合木霉发酵液;②绿色木霉灌根处理,施10 mL绿色木霉发酵液;③哈茨木霉灌根处理,施10mL哈茨木霉发酵液;④PD培养基灌根处理(对照),施10 mL PD培养基。
菌液制备:将2种木霉接种于PDA固体培养基上进行活化,5 d后产生大量绿色分生孢子,用无菌水冲洗分生孢子,收集分生孢子液,用血球计数板计数,将孢子浓度调整为1.5×108 CFU/mL。将分生孢子液以体积分数为5%的接种量接种到装有100 mL PD液体培养基的 250 mL三角瓶中,在 28 ℃、180 r/min 摇床中培养3 d,制成木霉发酵液,备用。
1.3 测定项目及方法
1.3.1 植株株高、叶宽、茎粗的测定 利用直尺测定植株株高与叶宽,利用游标卡尺测定植株茎粗。
1.3.2 叶绿素含量的测定 分别在相同位置的叶片上选取6个测量点,采用叶绿素测定仪TYS-A测定叶片的SPAD值,最后计算记录数据的平均值。
1.3.3 叶绿素荧光参数的测定 利用IMAGING-PAM调制叶绿素荧光成像系统(Heinz Walz,德国)测定叶绿素荧光参数,叶片暗适应30 min后,测量光下诱导产生的初始荧光(Fo)以及用饱和脉冲光激发产生的最大荧光(Fm)。荧光从最大值降至Fo时,利用光化光[1 600 μmol/(m2·s)]诱导测定荧光动力学,每隔20 s 打开饱和脉冲测定,当PSⅡ反应中心处于关闭状态时的最大荧光产量(Fm′)和任何时间的实际荧光强度(F)。最后测出的参数包括光系统Ⅱ(PSⅡ)最大光化学效率(Fv/Fm)、光化学荧光淬灭系数(qP)、非光化学荧光淬灭系数(NPQ)、PSⅡ潜在活性(Fv/Fo)等。
1.3.4 过氧化物酶活性及丙二醛含量的测定 过氧化物酶(POD)活性采用愈创木酚法测定。丙二醛(MDA)含量采用硫代巴比妥酸法测定[8]。
1.4 数据处理与分析
本研究采用SPSS 22.0和SigmaPlot 12.5分别对数据进行差异性分析及绘制作图。
2 结果与分析
2.1 绿色木霉与哈茨木霉对黄瓜幼苗生长的影响
如表1所示,通过数据分析表明,施加混合木霉处理的黄瓜幼苗株高、茎粗以及叶宽都显著高于对照。单独施加绿色木霉和哈茨木霉处理的黄瓜幼苗的株高、茎粗、叶宽同样比对照显著增加。施加混合木霉处理与单独施加木霉处理相比,株高和茎粗增加,但叶宽比单独施加绿色木霉处理降低8%,比单独施加哈茨木霉处理增加10%。结果表明,绿色木霉与哈茨木霉对黄瓜幼苗的生长有明显的促进作用,使黄瓜幼苗长势更好、植株粗壮。
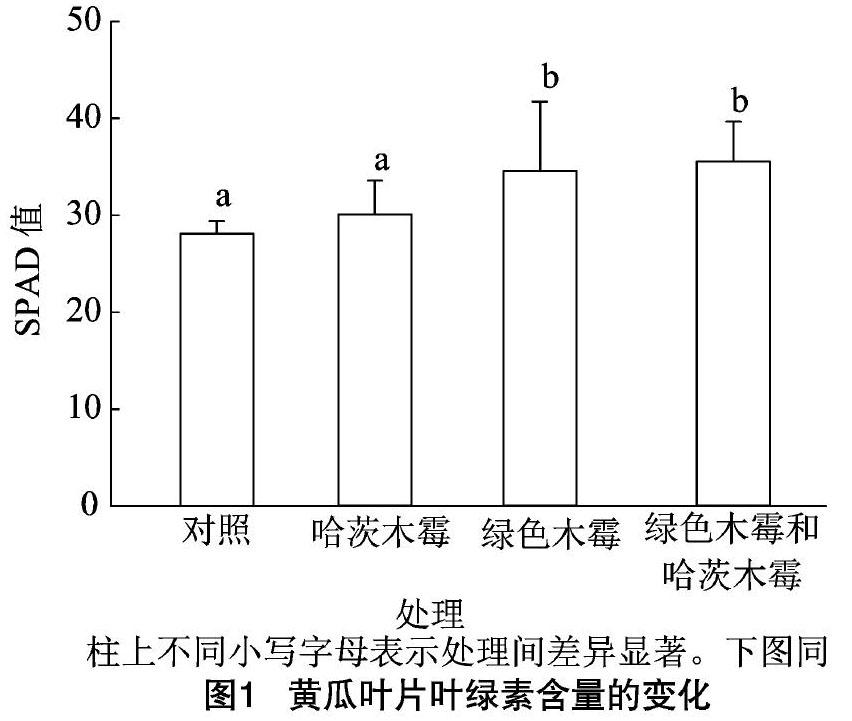
2.2 绿色木霉与哈茨木霉对黄瓜幼苗叶绿素含量的影响
叶绿素能够影响植物的光合能力和光合活性。通过测定植株叶片的SPAD 值,研究叶片叶绿素含量的变化。如图1所示,4种处理的黄瓜幼苗叶绿素含量(SPAD值)分别为35.58、34.59、30.09和28.10,混合木霉和绿色木霉灌根处理的黄瓜幼苗比哈茨木霉灌根处理和对照显著增加,但施加混合木霉的黄瓜幼苗与施加绿色木霉的黄瓜幼苗之间差异不显著。表明绿色木霉和哈茨木霉可使黄瓜幼苗叶片中叶绿素含量增加,其中哈茨木霉作用更加明显,利于植株进行光合作用。
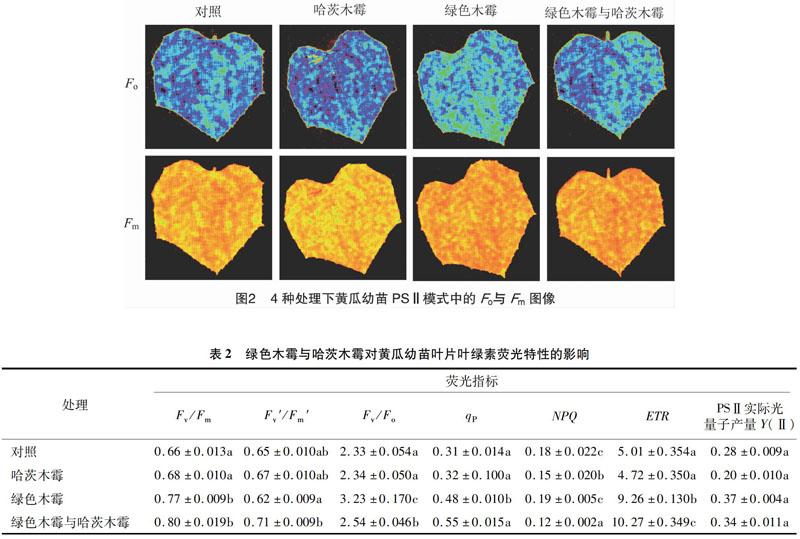
2.3 綠色木霉与哈茨木霉对黄瓜幼苗叶绿素荧光特性的影响
叶绿素荧光参数可以指示光合机构的性能。图2为不同处理下黄瓜幼苗PSⅡ模式中的初始荧光(Fo)与最大荧光(Fm)图像。通过Fv/Fm能够较好地判断植物光合性能,由表2可知,施加混合木霉的黄瓜幼苗的最大光化学效率值最大,与施加哈茨木霉和对照间差异显著,但施加混合木霉与施加绿色木霉间差异不显著;施加混合木霉的黄瓜幼苗与施加哈茨木霉和对照组间相比,有效光化学效率(Fv′/Fm′)增加,说明绿色木霉和哈茨木霉混合可使最大光化学效率和有效光化学效率增加。施加混合木霉的黄瓜幼苗叶片Fv/Fo与施加绿色木霉、哈茨木霉和对照间差异显著,施加绿色木霉与施加哈茨木霉和对照间同样差异显著,所以施加混合木霉可促进光化学电子进入碳还原过程。与对照相比,施加木霉的黄瓜幼苗叶片qP增加,其中施加混合木霉与施加绿色木霉相比显著增加,施加混合木霉、绿色木霉与施加哈茨木霉相比显著增加,施加哈茨木霉与对照相比增加,但差异不显著。说明混合木霉中绿色木霉作用明显,是使黄瓜幼苗 PSⅡ光化学电子传递活性增高的主要原因。NPQ反映植物耗散过剩光能为热的能力,经过混合木霉灌根后的黄瓜幼苗的NPQ比另外3组显著减少。表明黄瓜幼苗经过绿色木霉和哈茨木霉灌根后未能利用的光能减少。施加混合木霉处理与另外3个处理的光合电子传递效率(ETR)差异显著。叶绿色荧光数据总体表明,混合木霉中绿色木霉促进植株生长的作用明显。
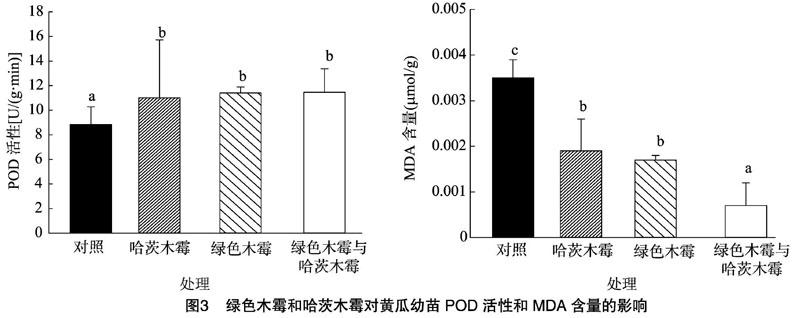
2.4 绿色木霉与哈茨木霉对黄瓜幼苗POD活性与MDA含量的影响
由图3可知,施加混合木霉、绿色木霉和哈茨木霉后,黄瓜幼苗中POD活性升高,与对照组相比分别显著增加30%、29%、28%,施加混合木霉对比施加绿色木霉与哈茨木霉增加,说明绿色木霉与哈茨木霉混合后对黄瓜幼苗POD活性的提高有明显的促进作用。经木霉处理后,3种黄瓜幼苗中MDA含量有所降低,施加混合木霉的黄瓜幼苗MDA含量明显低于对照组,且与施加绿色木霉和哈茨木霉都差异显著,说明绿色木霉与哈茨木霉都对黄瓜幼苗的生长起到了促进作用。
3 讨论与结论
目前,对木霉的研究主要集中于生物防治方面,本研究以黄瓜幼苗为试验材料,研究了绿色木霉与哈茨木霉对黄瓜幼苗生长的影响,结果表明,绿色木霉与哈茨木霉能显著提高黄瓜幼苗的株高、茎粗、叶宽等生长因素,这与陆宁海等以番茄幼苗为试验材料的研究结果[9]一致。株高是衡量作物生长量的基本标志之一,在栽培与耕作实践中,通常以株高动态来衡量各种技术措施的效果,尤其在相对值比较中更具有重要的参考价值[10]。茎是植株主要支撑系统,其高度、粗度和节间长度影响植株的株型,从而影响植株生长[11]。施加绿色木霉与哈茨木霉的混合木霉可增加黄瓜幼苗的株高、茎粗、叶宽等,且效果优于对黄瓜幼苗施加单一菌种。
SPAD值是反映叶绿素含量的指标[12]。施加绿色木霉与哈茨木霉的混合木霉可以显著增加黄瓜幼苗叶片的叶绿素含量,使最大光化学效率、有效光化学效率、PSⅡ潜在活性、光化学淬灭系数、光合电子传递速率、PSⅡ实际光量子产量等叶绿素荧光参数显著增加,其中,施加混合木霉的黄瓜幼苗PSⅡ潜在活性、光化学淬灭系数、光合电子传递速率与单独施加绿色木霉和哈茨木霉的差异显著,施加混合木霉的黄瓜幼苗最大光化学效率与单独施加哈茨木霉差异显著,施加混合木霉的黄瓜幼苗有效光化学效率与施加绿色木霉差异显著。与杨雄等以湿地松为试验材料结果一致[13]。NPQ反映的是耗散掉的光能部分,表示PSⅡ的一种自我保护能力[14]。在本试验中,采用绿色木霉与哈茨木霉的混合木霉灌根的幼苗NPQ值显著降低,说明绿色木霉与哈茨木霉的混合木霉可提高黄瓜幼苗的光合能力,促进植株生长,效果优于单一菌种。
过氧化物酶是果蔬中存在的一种重要的氧化还原酶,它与果蔬的许多生理过程和生化代谢过程都有密切关系[15]。本试验研究绿色木霉和哈茨木霉对黄瓜幼苗的影响,结果表明,2种木霉的施加可使黄瓜幼苗的POD活性显著增加,使黄瓜幼苗抗病性增强,且施加混合木霉的效果优于施加单种木霉。遇文婧等研究表明,经木霉处理的山新杨的SOD、POD、过氧化氢酶(CAT)、L-苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)活性明显升高[16]。丙二醛的积累会对细胞质膜等造成伤害,所以试验中通常利用丙二醛的含量作为膜脂过氧化指标[17]。本试验表明,绿色木霉和哈茨木霉处理的黄瓜幼苗丙二醛含量显著降低,说明绿色木霉和哈茨木霉处理后黄瓜幼苗细胞膜脂过氧化程度降低,因此可促进黄瓜幼苗生长。
参考文献:
[1]Prisana W,Shin-Ichi I,Anurag S. Volatile organic compounds emitted from endophytic fungus Trichoderma asperellum T1 mediate antifungal activity,defense response and promote plant growth in lettuce (Lactuca sativa)[J]. Fungal Ecology,2020,43:100867.
[2]Gajera H P,Katakpara Z A,Patel S V,et al. Antioxidant defense response induced by Trichoderma viride against Aspergillus niger van Tieghem causing collar rot in groundnut (Arachis hypogaea L.)[J]. Microbial Pathogenesis,2016,91:26-34.
[3]Metwally R A,Al-amri S M. Individual and interactive role of Trichoderma viride and arbuscular mycorrhizal fungi on growth and pigment content of onion plants[J]. Letters in Applied Microbiology,2020,70(2):79-86.
[4]李艳娟,刘 博,庄 正,等. 哈茨木霉与绿色木霉对杉木种子萌发和幼苗生长的影响[J]. 应用生态学报,2017,28(9):2961-2966.
[5]Poveda J,Hermosa R,Monte E,et al. The Trichoderma harzianum kelch protein ThKEL1 plays a key role in root colonization and the induction of systemic defense in brassicaceae plants[J]. Frontiers in Plant Science,2019,10:3389.
[6]Elkelish A A,Alhaithloul H A S,Qari S H,et al. Pretreatment with Trichoderma harzianum alleviates waterlogging-induced growth alterations in tomato seedlings by modulating physiological,biochemical,and molecular mechanisms[J]. Environmental and Experimental Botany,2020,171:103946.
[7]Panitch B,Supawadee D,Tharita K,et al. Increased carbazole alkaloid accumulation in clausena harmandiana callus culture by treatments of biocontrol agent,Trichoderma harzianum and bacillus subtilis[J]. Applied Biochemistry and Biotechnology,2019,189(3):871-883.
[8]曹建康,姜微波,趙玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2007.
[9]陆宁海,吴利民,徐瑞富. 哈茨木霉RT-12对番茄幼苗生长的影响[J]. 湖南农业科学,2006(6):53-54.
[10]何坤辉,常立国,崔婷婷,等. 多环境下玉米株高和穗位高的QTL定位[J]. 中国农业科学,2016,49(8):1443-1452.
[11]吴洋洋,徐婷婷,迟天华,等. 切花菊茎秆性状的生长动态与遗传分析[J]. 核农学报,2020,34(1):55-61.
[12]侯红乾,林洪鑫,刘秀梅,等. 长期施肥处理对双季晚稻叶绿素荧光特征及籽粒产量的影响[J]. 作物学报,2020,46(2):280-289.
[13]杨 雄,刘乐平,李兴山,等. 哈茨木霉对湿地松幼苗光合作用和生物量累积的影响[J]. 湖北林业科技,2018,47(6):27-30.
[14]Wittenberghe S V,Alonso L,Malenovs Z,et al. In vivo photoprotection mechanisms observed from leaf spectral absorbance changes showing VIS-NIR slow-induced conformational pigment bed changes[J]. Photosynthesis Research,2019,142(3):283-305.
[15]刘建新,欧晓彬,王金成,等. 镉胁迫下裸燕麦幼苗对外源H2O2的生理响应[J]. 草业学报,2020,29(1):125-134.
[16]遇文婧,杨 帅,刁桂萍. 深绿木霉对山新杨生长及抗叶枯病能力的影响[J]. 东北林业大学学报,2019,47(1):71-75.
[17]张 庆,魏树和,代惠萍,等. 硒对茶树镉毒害的缓解作用研究[J]. 南京林业大学学报(自然科学版),2020,44(1):200-204.