2型糖尿病合并肿瘤患者血清维生素D水平及其危险因素分析
2020-09-24刘东玲赵崇强李春君陈丽琴邱慧娜林静娜
刘东玲 赵崇强 李春君 陈丽琴 邱慧娜 林静娜
1天津市滨海新区大港医院内分泌科 300270; 2天津市第一中心医院心内科 300192; 3天津市人民医院内分泌科 300012
糖尿病和肿瘤是常见的慢性疾病,在同一患者中经常共存,随着我国人口老龄化与生活方式的变化,糖尿病患病率从1980年的0.67%飙升至2013年的10.4%,已经从少见病变成一个流行病[1],同时中国也是糖尿病人数增长最快的国家之一[2]。2型糖尿病患者中普遍存在高血糖、高胰岛素血症和肥胖,而这些因素可以通过各种机制促进细胞癌变[3]。研究显示,糖尿病与各种肿瘤的发病率增加明显相关,如结直肠癌、肝癌、胰腺癌、胃癌、肾癌、膀胱癌,乳腺癌、淋巴瘤等[4-8],而且糖尿病还与肿瘤死亡风险增加相关[9-10]。由于我国糖尿病患者人数众多,明确哪些糖尿病患者是肿瘤的高危人群十分必要。本研究通过病例对照研究明确哪些因素是与2型糖尿病患者肿瘤发生风险增加相关。
维生素D是一种脂溶性维生素和类固醇激素,25羟维生素D3[25(OH)D3]占维生素D总量的95%以上,是机体的主要储存形式,由于其不受血钙和甲状旁腺素水平的影响,且半衰期长达2~3周,因此被公认为是评价维生素D的最佳指标[11]。维生素D通过调节胰岛素抵抗和(或)胰岛β细胞功能参与2型糖尿病的发病机制[12]。研究表明,较低的维生素D水平与较高的2型糖尿病患病风险相关[13-14]。2型糖尿病与肿瘤发病风险增加相关,低维生素D水平可能与2型糖尿病患者肿瘤发生风险增加相关。
1 对象和方法
1.1 研究对象及分组 本研究为病例对照研究,收集2016年7月1日至2018年12月31日于天津市人民医院内分泌科住院的2型糖尿病合并肿瘤患者205例作为肿瘤组,肿瘤组为该期间住院有恶性肿瘤病史且符合入组条件的所有患者,如多次住院,选取首次住院期间化验检查,其中男性93例,女性112例,年龄43~87岁,平均(65.0±8.4)岁,肿瘤病程0~40年,中位数3年,其中肿瘤术后129例,未手术76例,手术时间为1个月前~40年前,手术中位时间为5年前,肿瘤组有42例为新诊断肿瘤病例,163例为有肿瘤病史。选择同期住院不合并肿瘤的2型糖尿病患者205例作为非肿瘤组,其中男性118例,女性87例,年龄39~84岁,平均(58.5±8.6)岁。
纳入标准:所有患者均符合2型糖尿病诊断标准,参考《中国2型糖尿病防治指南(2017年版)》;近半年未服用维生素D类相关药物以及激素、钙剂等。
排除标准:近2周有严重感染或发热;合并糖尿病急性并发症,如糖尿病酮症酸中毒、高糖高渗状态、糖尿病乳酸酸中毒等;合并严重肝肾疾病,具体标准为谷草转氨酶≥正常上限3倍,谷丙转氨酶≥正常上限3倍,总胆红素>正常上限2倍,血肌酐>正常值2倍以上。
1.2 研究方法 收集所有入选患者的一般情况,如性别、年龄、体重指数、吸烟、饮酒、糖尿病年限,同时收集患者化验检查结果,如血清25(OH)D3、尿微量白蛋白、尿蛋白定量、白蛋白、血清肌酐、尿酸、总胆红素、谷氨酰转肽酶、碱性磷酸酶、谷草转氨酶、谷丙转氨酶、甘油三酯、总胆固醇;所有化验检查结果均由天津市人民医院检验科检测;其中血清25(OH)D3的检测采用ELISA法,正常值范围 30~100 μg/L;所有血标本均为晨起空腹采集静脉血5 ml送检。

2 结果
2.1 2型糖尿病患者中恶性肿瘤的分布情况 肿瘤组各种肿瘤分布如下:乳腺癌44例(21.5%)、结直肠癌41例(20.0%)、肾癌39例(19.0%)、肺癌26例(12.7%)、妇科肿瘤13例(6.3%)、血液肿瘤9例(4.4%)、甲状腺癌9例(4.4%)、肝癌7例(3.4%)、胰腺癌5例(2.4%)、鼻咽癌4例(2.0%)、其他肿瘤8例(3.9%),其他肿瘤包括颅内肿瘤1例、纵隔肿瘤1例、皮肤肿瘤1例、胸腺瘤1例、畸胎瘤1例、骨肿瘤2例、口腔肿瘤1例;其中男性肿瘤患者93例,排名前4位的肿瘤是肾癌27例(29.0%)、结直肠癌23例(24.7%)、肺癌14例(15.1%)、血液肿瘤8例(8.6%);女性肿瘤112例,排名前4位的是乳腺癌44例(39.3%)、结直肠癌18例(16.1%)、妇科肿瘤13例(11.6%)、肺癌12例(10.7%)和肾癌12例(10.7%)。
2.2 肿瘤组和非肿瘤组基线资料比较 与非肿瘤组相比,肿瘤组年龄更大,男性比例较低,糖尿病病程较长,25羟维生素D3、血清白蛋白、总胆固醇、钙、磷较低(P均<0.05),两组体重指数、吸烟、饮酒、微量白蛋白、尿蛋白定量、血清肌酐、尿酸、总胆红素、谷氨酰转肽酶、碱性磷酸酶、谷草转氨酶、谷丙转氨酶、甘油三酯差异均无统计学意义(P均>0.05),见表1。
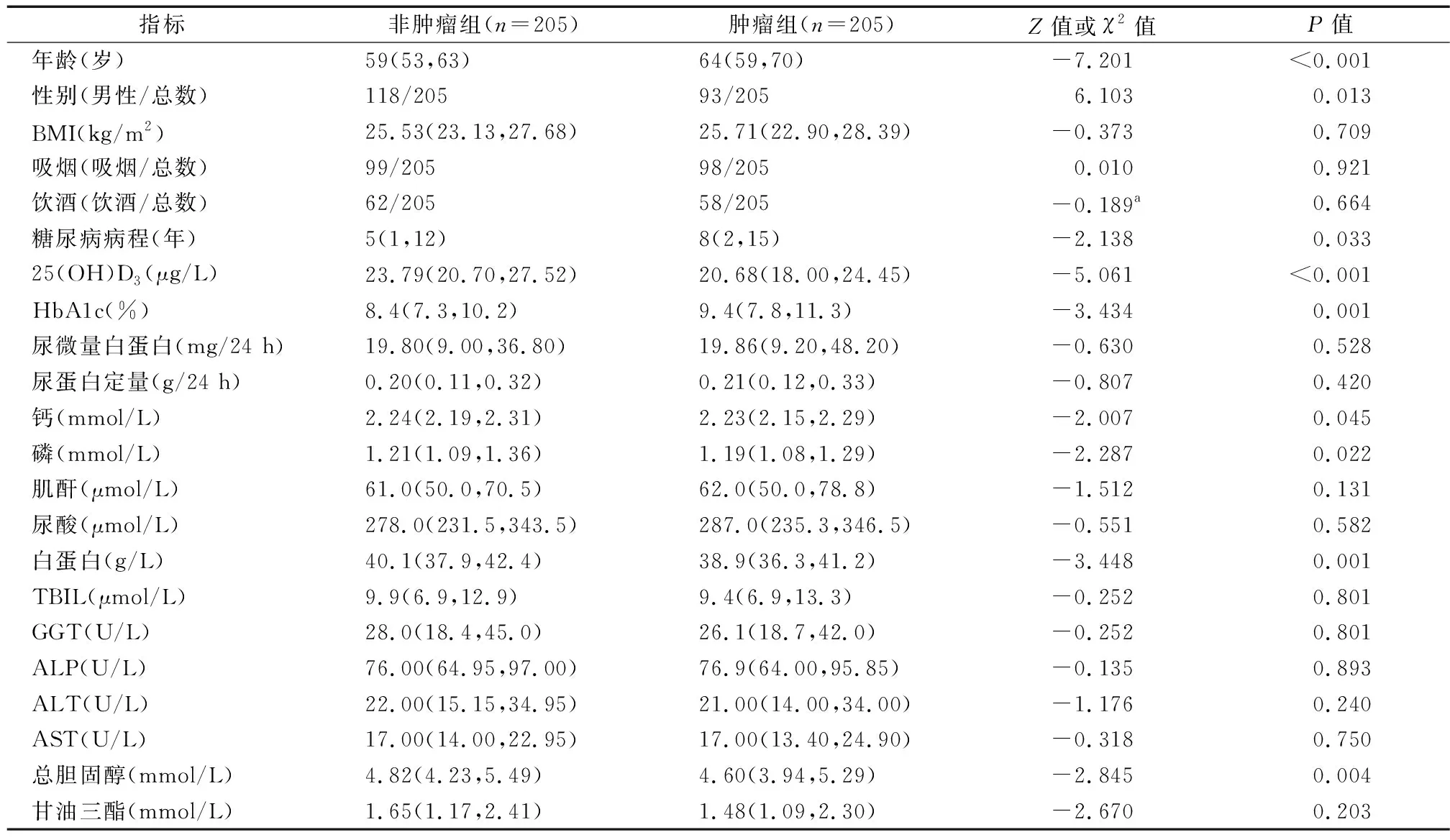
表1 2型糖尿病肿瘤组和非肿瘤组一般资料比较[M(P25,P75)]
2.3 2型糖尿病合并肿瘤患者危险因素的多因素分析 多因素logistic回归显示,低血清25(OH)D3、高龄、女性、高HbA1c是2型糖尿病患者肿瘤发生风险增加的独立危险因素,其OR值分别为0.931、1.087、1.766、1.178(表2);根据上述模型绘制ROC曲线(图1),曲线下面积为0.783,95%CI为0.734~0.832(P<0.001),为中等预测价值。

表2 2型糖尿病合并肿瘤患者危险因素的多因素logistic回归分析

2.4 25(OH)D3对2型糖尿病合并肿瘤的预测价值评价 以25(OH)D3正常值范围 30~100 μg/L为标准,2型糖尿病患者25(OH)D3降低所占比例为88.3%(362/410),其中非肿瘤组25(OH)D3降低所占比例为85.4%(175/205),肿瘤组25(OH)D3降低所占比例为91.2%(187/205),ROC曲线下面积为0.660,95%CI为0.601~0.718,P<0.001,截断值为21.19,根据该截断值,对2型糖尿病合并肿瘤诊断的敏感性为73.2%,特异性为54.7%,见图2。
3 讨论
我国是全球2型糖尿病人数增长最快的国家之一[2],而2型糖尿病患者各种肿瘤发生风险增加56%~59%,其中以肝脏(HR=1.80~2.48)、结直肠(HR=2.41~2.69)和胃癌(HR=2.02~2.51)风险最高[7]。因此明确哪些2型糖尿病患者易于合并肿瘤意义重大。本研究中乳腺癌、结直肠癌、肾癌和肺癌所占比例较高,其中男性组占比较高的肿瘤依次是肾癌、结直肠癌、肺癌;女性组占比较高的肿瘤依次是乳腺癌、结直肠癌、妇科肿瘤,对2型糖尿病合并肿瘤和不合并肿瘤患者进行比较,结果显示2型糖尿病合并肿瘤组年龄较大,男性比例较低,糖尿病病程较长,糖化血红蛋白水平较高,25(OH)D3、白蛋白、总胆固醇、钙、磷较低,进一步将上述指标纳入多因素logistic回归模型,结果显示:低血清25(OH)D3、高龄、女性、高HbA1c是2型糖尿病患者肿瘤发生风险增加的独立危险因素。
国家癌症中心发布了最新一期的全国癌症统计数据,按发病例数排位,肺癌位居全国发病首位,其后依次为胃癌、结直肠癌、肝癌和乳腺癌,肺癌和乳腺癌分别位居男女性发病的第1位[15]。这与本研究肿瘤组各种肿瘤构成比略有不同,考虑可能是糖尿病患者的肿瘤发病谱与一般人群不同,因为目前研究显示,糖尿病可增加多种肿瘤发病风险,但对各种肿瘤的影响大小不同[4-8]。也可能是由于选择偏倚所致,因为本研究所选肿瘤组都是内分泌科住院的2型糖尿病合并肿瘤患者,且样本量较小,这也会对肿瘤构成比造成影响。
研究显示,血清25(OH)D3水平较低与2型糖尿病患者肿瘤发生风险增加相关,即使在调整了其他已知的危险因素后,25(OH)D3水平高的患者结直肠癌风险也比低25(OH)D3的患者降低了30%~40%[16]。一个纳入5项病例对照研究(病例组1 306例,对照组1 490例)的荟萃分析显示,血清25(OH)D3缺乏与乳腺癌的发生风险有关(RR=1.91,95%CI:1.51~2.41,P<0.001)[17]。高血清25(OH)D3水平与肺癌风险呈负相关(OR=0.89,95%CI:0.83~0.97,P<0.001)[18]。低血清25(OH)D3水平与甲状腺癌的风险增加有关,综合优势比为1.3(95%CI:1.00~1.69,P=0.05)[19]。而本研究显示,在2型糖尿病人群中,25(OH)D3水平较低与各种肿瘤总体发生风险增加相关,这与先前发表的在普通人群中的研究结果大体一致。其机制可能是维生素D通过抑制肿瘤细胞增殖、侵袭及血管生成,诱导肿瘤细胞凋亡[20]。另外本研究显示,25(OH)D3对2型糖尿病患者是否合并肿瘤有一定的预测价值,其敏感性为73.2%,特异性为54.7%。
HbA1c水平升高与糖尿病患者肿瘤发生风险增加相关,HbA1c水平升高说明近2~3个月血糖控制不佳,而细胞长期暴露于高血糖会导致活性氧簇的形成,并导致晚期糖基化终末产物(AGEs)的堆积,AGEs与其受体(RAGE)的结合,可引起多种生物学效应,其中之一是通过激活核因子-κB,核因子-κB激活和细胞内活性氧簇形成共同增加炎性反应,从而引起核DNA的损伤,进而促进癌变发生[21]。Joshu等[22]研究显示,HbA1c水平升高的女性糖尿病患者,肿瘤发生风险增加(HR=1.30,95%CI:1.06~1.60),但是对于男性,HbA1c水平与肿瘤发病风险无明显相关性。另外韩国的一项前瞻性研究显示,在非糖尿病人群中,调整协变量后,高HbA1c组较低HbA1c组的人群肿瘤发生风险增加(HR=3.03,95%CI:1.54~5.96)[23]。一项波兰的病例对照研究显示,HbA1c≥ 8.0%的患者发生肿瘤的风险较高(OR=3.160,95%CI: 1.342~7.440,P=0.013)[21]。
本研究显示,低血清25(OH)D3、高龄、女性、高HbA1c是2型糖尿病患者发生肿瘤的独立危险因素,其中25(OH)D3较低对2型糖尿病发生肿瘤风险有一定的预测价值,对于这些患者应该加强筛查是否合并肿瘤;同时补充维生素D和严格控制血糖,可能有助于降低2型糖尿病患者肿瘤发生风险,但这需要更进一步前瞻性研究予以明确。虽然目前大型随机对照试验研究显示维生素D补充剂对肿瘤的发生风险无明显作用[3]。但对于2型糖尿病等存在维生素D缺乏高风险的人群,补充维生素D是否能降低肿瘤风险却是未知的。本研究肿瘤组205例,其中129例已行肿瘤切除,这些患者住院期间对肿瘤大多无特殊治疗;42例为在天津市人民医院内分泌科新诊断的肿瘤病例,尚未开始治疗,且本研究纳入标准为近半年未服用维生素D类相关药物以及激素、钙剂等,这使混杂因素对钙磷代谢影响降至最低,因此本研究关于25(OH)D3水平对2型糖尿病患者合并肿瘤的预测较为可靠。
本研究的局限性:为单中心的病例对照研究,样本量有限,由于研究设计的限制,发现的只是糖尿病合并肿瘤的危险因素,并不能解释糖尿病与肿瘤的因果关系,如本研究显示肿瘤组25(OH)D3、血清白蛋白、胆固醇、钙、磷较非肿瘤组低,这些现象也有可能是由于肿瘤消耗、营养不良、放化疗等所致,可能是肿瘤的一个继发现象,而并非2型糖尿病发生肿瘤的原因;由于样本量限制,本研究未能分析这些因素对不同肿瘤发生风险的影响。
