益胃消瘀颗粒对萎缩性胃炎大鼠胃黏膜肠化的影响❋
2020-09-24田锋亮杨小军陈万群李延萍
田锋亮,杨小军,陈万群,刘 宇,李延萍
(重庆市中医院,重庆 400021)
胃黏膜肠上皮化生(intestinal metaplasia,IM)是指病变部位的胃黏膜上皮被肠型上皮取代的现象,一般由胃固有腺体颈部未分化细胞转化而来,光镜下胃黏膜上皮中出现肠上皮的杯状细胞、吸收细胞、潘氏细胞和糖原染色阳性的具有刷状缘的细胞。它是一种癌前病变,可增加胃癌发病的风险。胃癌经历了浅表性胃炎-萎缩性胃炎-肠上皮化生-异型增生-胃癌的多步骤复杂的发展过程[1-2],对胃黏膜肠化生的治疗可能成为胃癌早期干预的突破点。目前肠化的发生机制尚不清楚,研究认为NK6同源框蛋白3(NK6 Homeobox Protein 3,NKX6.3)为胃黏膜上皮分化的重要调节器,可通过对尾型同源盒转录因子2(Caudal-related homeobox transcription factor2,CDX2)、干细胞转录调控因子性别决定相关基因簇2(Sex de-termining region Y-box 2,SOX2)、骨形成蛋白4(bone morphogenic protein 4, BMP4)调控干预肠化的过程[3]。目前尚无有效的西药治疗萎缩性胃炎及肠化,某些中药及相关制剂对萎缩性胃炎肠化的研究报道较多,部分提示能够逆转萎缩肠化的发生。既往临床观察提示,益胃消瘀颗粒治疗萎缩性胃炎及癌前病变有效[4]。本实验采用N-甲基-N’-硝基-N-亚硝基胍(N-methyl-N’-Nitro-N-nitrosoguanidine,MNNG)造模[5-6]的萎缩性胃炎肠化大鼠,给予益胃消瘀颗粒治疗后观察其对大鼠胃黏膜组织的病理形态及NKX6.3、CDX2、SOX2、BMP4表达的影响,探讨益胃消瘀颗粒对萎缩性胃炎胃黏膜肠化大鼠的治疗作用、潜在机制及靶点。
1 材料与方法
1.1 动物
清洁级雄性SD 大鼠 60只,8周龄,体质量180 g~200 g,由第三军医大学实验动物中心提供,动物生产许可证号为SCXK-PLA-20120031。并经试验动物伦理审查委员会审查通过,全程SPF级环境喂养。
1.2 药物及配制
益胃消瘀颗粒由红参、三七、白术、薏苡仁、法落海、娑罗子、浙贝母等药物组成,由重庆市中医院制剂室制作,1 g颗粒相当于原药剂量的5.5 g。MNNG试剂购于TCL公司。MNNG先用去离子水配成1 g/L的储备液(每周配制1次),4 ℃冰箱避光保存,用前以自来水稀释为50 mg/L浓度的溶液,装入涂有黑漆的避光饮水瓶内供大鼠自由饮用。法莫替丁购于阿拉丁公司,配制成含0.004%法莫替丁的粉末状饲料。
1.3 主要试剂与仪器
NKX6.3抗体(货号AF0302,分子量34 kDa);BMP4(货号DF6461,分子量47 kDa,Affinity公司)。CFX96定量PCR仪(美国Bio-Rad公司);WB成像系统(英国SYNGENE公司);蛋白电泳仪和转膜仪(美国Bio-Rad 公司)。
1.4 方法
1.4.1 造模与分组 60只雄性大鼠按随机数字表法分为空白组、模型组、益胃消瘀颗粒高、中、低剂量组、胃复春组各10只,空白组常规喂养,其余50只采用MNNG联合法莫替丁诱导造模。MNNG给予大鼠自由饮用,每24 h更换1次药液,造模期间不再提供其他饮水,并给予含0.004%法莫替丁饲料喂养。造模6个月抽检空白组、模型组、益胃消瘀颗粒高剂量组各1只,空白组提示胃黏膜组织正常,模型组、益胃消瘀颗粒高剂量组病理提示仅存在萎缩未见肠化,7个月再次抽检空白组、益胃消瘀颗粒高、低剂量组各1只,益胃消瘀颗粒高、低剂量组病理改变均提示萎缩伴肠化,存活54只大鼠即为有效动物。
1.4.2 用药 7个月造模成功后各组均不再给予造模药物,空白组及模型组大鼠给予正常食水;益胃消瘀颗粒3剂量组大鼠给予正常饮水,益胃消瘀颗粒低剂量组按0.75 g/(kg·d)给予益胃消瘀颗粒饲料喂养给药,中剂量组按1.5 g/(kg·d)给药,高剂量组按2.25 g/(kg·d)给药,每日2次;胃复春组给予正常饮水,按0.45 g/(kg·d)胃复春颗粒饲料给药。因造模时间长,造模后大鼠一般情况差,部分死亡,故给予益胃消瘀颗粒及胃复春饲料给药避免长期灌胃加重损害,给药过程中每日再称量无效消耗量进行补充,以保证药物的用量。给药过程中,模型组、胃复春组大鼠各死亡1只,给药3个月结束后剩余52只大鼠,处死动物留取标本。
1.4.3 胃黏膜组织形态学观察 胃黏膜标本固定于10%的中性福尔马林溶液中,固定48 h后剪成约2 cm的条状物,石蜡包埋,常规切片,HE染色,观察病理组织学改变。
1.4.4 RT-qPCR检测胃黏膜标本中Cdx2、Sox2 mRNA的表达 引物由上海百力格生物技术有限公司合成,提取大鼠胃黏膜组织总RNA,反转录后进行实时定量PCR(RT-qPCR)扩增,β-actin引物F -CCCATCTATGAGGGTTACGC,R- TTTAATGTCACGCACGATTTC,Sox2正义链:5′-CCATGGGCTCTGTGGTCAAG-3′,反义链:5′-CTG- GGCCATGTGCAGTCTAC-3′,产物长度173 bp;Cdx2正义链:5′-GCGGCGAAA- CCTTTGTGAAT-3′,反义链:5′-GCCAACTCAGCTTTCCTCCT-3′,产物长度177 bp。PCR反应条件如下:95 ℃预变性2 min,40个扩增循环,每循环95 ℃变性15 s,60 ℃退火45 s,熔解曲线: 60~95 ℃。反应结束后,将原始数据、扩增曲线和熔解曲线等信息从定量软件中导出进行分析,得出各个样本目的基因的Ct值,用相对定量2-△△Ct法分析结果。
1.4.5 Western blot检测胃黏膜标本中NKX6.3、BMP4蛋白表达 从胃组织中抽提蛋白质,BAC法测定总蛋白浓度。取50 mg总蛋白与上样液混合,上样前100 ℃煮沸5 min。将蛋白加入点样孔,电泳初始电压80 V,溴酚蓝染料的前缘进入分离胶上缘后提高电压至100 V,当溴酚蓝染料到达分离胶底部时停止电泳。恒流30 mA,电转120 min。转移结束后,取出PVDF膜并标记膜的方向。用含5%脱脂奶粉的TBST封闭,室温振荡60 min。TBST漂洗液洗膜 8 min共3次,将膜移入杂交器皿中,加入用一抗稀释液按1∶1 000进行稀释的抗体(NKX6.3和BMP4),封口后4 ℃孵育过夜;用TBST漂洗液摇荡洗膜10 min共3次,将PVDF膜移入另一新的杂交器皿中,加入二抗稀释液稀释的辣根过氧化物酶标记的二抗(1∶2 000),37 ℃振荡60 min。加入ECL显色液进行显色并拍照,用IPP软件分析目的条带灰度值,经内参β-actin校正后进行统计学分析。
1.5 统计学方法
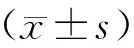
2 结果
2.1 各组大鼠一般情况
空白组大鼠毛发光泽,神态安逸,活动敏捷,食量较大,形体较大,大便颗粒状。模型组大鼠毛发色泽枯、疏松,精神萎靡、懒于活动且迟钝,食量减少,形体偏消瘦,体质量增加缓慢,大便时稀。用药期间各治疗组大鼠经治疗后,其毛色、精神状态、食欲、活动情况等均有不同程度改善,而以益胃消瘀颗粒高、中剂量组一般情况改善最明显,低剂量组和胃复春组次之,模型组最差。
2.2 胃黏膜组织结构改变结果
图1示,光镜观察结果,空白组黏膜上皮完整,固有层见密集排列的腺体,腺体大小、形态规则,散在少量淋巴细胞,未见胃黏膜萎缩(图1 A)。模型组黏膜显示慢性炎症,黏膜腺体减少,排列紊乱,可见囊性扩张的腺体,腺上皮可见不同程度的肠化,固有层淋巴细胞灶性浸润,黏膜肌层增厚(图1B)。益胃消瘀颗粒高剂量组可见黏膜萎缩程度减轻,腺体增多,排列规则,散在淋巴细胞、浆细胞浸润(图1C)。益胃消瘀颗粒中剂量组黏膜萎缩程度减轻,腺体排列规则,肠化明显减少,可见淋巴细胞、浆细胞散在浸润,小血管扩张充血,纤维组织增生(图1D)。益胃消瘀颗粒低剂量组黏膜仍见萎缩,但较模型组稍减轻,黏膜腺体稍增加,囊性扩张腺体减少,排列稍规则,肠化减少,可见固有层淋巴细胞灶性浸润,小血管扩张充血(图1E)。胃复春组黏膜萎缩程度减轻,黏膜腺体增多,排列稍规则,散在淋巴细胞浸润 (图1F)。

注:A.空白组;B.模型组;C.益胃消瘀颗粒高剂量组;D.益胃消瘀颗粒中剂量组;E.益胃消瘀颗粒低剂量组;F.胃复春组图1 光镜下各组大鼠胃黏膜组织结构改变(HE,×100)
2.3 RT-qPCR检测各组大鼠胃黏膜组织Cdx2、Sox2 mRNA表达
表1示,与空白组比较,模型组大鼠胃黏膜组织Cdx2 mRNA表达明显升高(P<0.01);与模型组比较,益胃消瘀颗粒高、中、低剂量组及胃复春组大鼠胃黏膜Cdx2mRNA表达明显下降(P<0.05)。与空白组比较,模型组Sox2mRNA表达明显下降(P<0.01);与模型组比较,益胃消瘀颗粒高、中、低剂量组及胃复春组Sox2mRNA表达明显升高(P<0.01),以益胃消瘀颗粒高剂量组升高最明显(P<0.05)。
2.4 Western blot检测各组大鼠胃黏膜组织NKX6.3和BMP4的蛋白表达
图2表2示,与空白组比较,模型组大鼠胃黏膜组织中NKX6.3表达明显下降(P<0.01);与模型组比较,益胃消瘀颗粒高剂量组及中剂量组大鼠胃黏膜组织NKX6.3含量明显升高(P<0.01),胃复春组表达也有明显上升(P<0.05)。与空白组比较,模型组大鼠胃黏膜组织BMP4含量明显增加(P<0.01);与模型组比较,益胃消瘀颗低、中及高剂量组BMP4含量均明显下降(P<0.01)。
3 讨论
中医典籍中未见“慢性萎缩性胃炎肠化”(CAG)病名,多根据临床所见胃脘痞满、胃中嘈杂、痞或不痛、纳差等表现,将其归属于“胃痞”“胃脘痛”等范畴。认为本病为本虚标实证,以脾阳气虚、胃阴虚为本,以气郁、湿热、痰浊、瘀血为标,病位在脾胃,与肝的关系密切,辨证多采用理气、化湿、清热、活血、补虚、通阳等法治疗[7-9]。根据本病特点自拟益胃消瘀颗粒组方,由红参、三七、白术、薏苡仁、法落海、娑罗子、浙贝母等药物组成,具有益气温阳、行气化湿、活血化瘀之效,经多年临床验证疗效确切。本研究结果显示,模型大鼠胃黏膜萎缩及肠化,而益胃消瘀颗粒高、中剂量组大鼠胃黏膜肠化情况均较模型明显改善,胃复春组及益胃消瘀颗粒低剂量组大鼠胃黏膜萎缩及肠化有所减轻,提示益胃消瘀颗粒对萎缩性胃炎大鼠胃黏膜萎缩及肠化有明确的治疗作用,且效果优于胃复春组。

表1 RT-qPCR检测各组大鼠胃黏膜组织Cdx2、Sox2mRNA表达比较
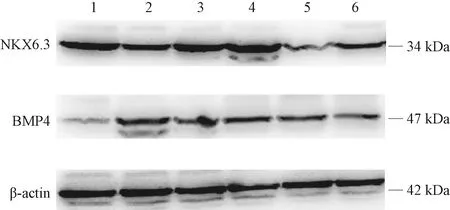
注:1.空白组;2.模型组;3.益胃消瘀颗粒高剂量组;4.益胃消瘀颗粒中剂量组;5.益胃消瘀颗粒低剂量组;6.胃复春组图2 Western blot检测条带结果比较

表2 Western blot检测结果灰度分析
Cdx2是尾型相关同源盒基因家族中的一员,以转录因子的形式调节DNA表达,参与肠细胞的增殖、分化、黏附、迁移以及癌变。有报道认为[10],Cdx2在正常的胃黏膜上皮细胞中不表达,但在发生肠化生的胃黏膜细胞中高表达,过表达Cdx2对隐窝细胞的增殖作用明显增强。王柏桦等[11]研究认为,Cdx2蛋白在胃黏膜细胞中的异位表达是发生胃黏膜肠化生的重要起始事件,Cdx2表达异常与肠化生的发生和进展与胃癌密切相关。陈柏君等[12]研究发现,通过增强Cdx2转录能使胃黏膜干细胞向肠上皮细胞分化,杯状细胞形成增多,促进胃黏膜肠上皮化生的形成。本研究结果显示,与空白组比较,模型组大鼠胃黏膜CDx2表达明显升高,与模型组比较益胃消瘀颗粒高、中、低剂量组及胃复春组CDx2均有下降,提示益胃消瘀颗粒对CDx2的表达有明显的抑制作用,其改善萎缩及肠化的作用可能与抑制CDx2表达有关。
Sox2是一类Y染色体性别决定区(SRY) 相关基因家族成员之一[13],通过 HMG结构域识别靶基因,在调控组织的增殖发育、决定细胞分化方向和维持干细胞的全能性、保持不分化状态方面具有重要作用[14]。牛海静等[15]认为,Sox2基因特异性表达于正常胃上皮细胞中,可调节肠上皮特异性基因Cdx2和 Muc2 的表达,在胃上皮化生为肠上皮过程中起重要作用。本研究结果显示,与空白组比较,模型组大鼠胃黏膜Sox2表达明显下降;与模型组比较,高剂量组与中低剂量组及胃复春组Sox2表达明显升高,提示益胃消瘀颗粒对Sox2的表达有明显促进作用,其改善萎缩及肠化可能与上调CDx2表达有关。
BMP4属于转化生长因子β(TGF-β)超家族成员之一,在肿瘤形成过程中发挥着重要作用[16]。马松林等[17]研究认为,BMP4 能促进胃癌细胞的迁移及侵袭,其机制可能与上调Snail 表达有关,BMP4通过经典的信号传导子SMAD4在胃细胞系中上调Cdx2的表达[18]。本研究结果显示,与空白组比较,模型组大鼠胃黏膜BMP4含量明显上升,益胃消瘀颗低、中、高剂量组及胃复春组BMP4下降明显,提示益胃消瘀颗粒能够抑制BMP4的表达,其改善萎缩及肠化可能与抑制CDx2表达有关。
NKX6.3是一种同源框转录因子,研究认为NKX6.3为胃黏膜上皮分化的重要调节器。NKX6.3在肠化的胃黏膜中表达显著减少,NKX6.3表达水平与Sox2呈正相关,而与Cdx2表达呈负相关,在AGS及MKN细胞中,NKX6.3通过直接作用于Cdx2及Sox2两个基因的启动子部分来调节二者的表达。NKX6.3细胞核的表达仅在非肠化的胃上皮中可检测到,NKX6.3可抑制胃癌分化和肿瘤发生[19]。本研究结果提示,与空白组比较,模型组NKX6.3下降明显,与模型组比较,益胃消瘀颗粒高、中剂量组及胃复春组升高明显,提示益胃消瘀颗粒对NKX6.3的表达有激活促进作用,其改善萎缩及肠化作用可能与干预NKX6.3有关。
Cdx2异位表达及Sox2的下调可以诱导未分化的胃干细胞向肠上皮细胞分化,Sox2可能在胃上皮及细胞中Cdx2基因甲基化的构成及保持方面发挥重要作用[3]。NKX6.3表达水平与Sox2呈正相关,而与Cdx2表达呈负相关,NKX6.3诱导TWSG1连接到BMP4,从而抑制BMP4连接到BMPR-II[20]。结合本研究的结果认为,益胃消瘀颗粒可能通过激活NKX6.3表达、下调CDx2、上调Sox2,抑制BMP4而达到改善萎缩及肠化的效果。但本研究尚不能明确NKX6.3与Cdx2、Sox2、BMP4之间的内在通路与靶向关系,需要进一步研究加以确定。
