牛蒡根氯仿提取物有效组分分离及其抗肿瘤活性的研究
2020-09-24沈洪昇何景华赵秀梅顾娜史鹏程胡人杰
沈洪昇,何景华,赵秀梅,顾娜,史鹏程,胡人杰
(1.天津医科大学基础医学院药理学教研室,天津300070;2.天津市医药科学研究所,天津300020)
恶性肿瘤是危害人类健康的主要疾病之一。肿瘤的三大疗法中,药物治疗占有重要的地位。很多来源于天然产物的单体或有效组分的抗肿瘤作用及其机制已经得到公认,不仅为癌症治疗提供了新的理论及依据,也为抗肿瘤药物的筛选提供了广阔的空间。牛蒡(Arctiumlappa L.)是菊科牛蒡属草本植物,其根、茎、叶、果实均可作为草药使用[1]。目前研究主要集中于法定的药用部位牛蒡子,其有效成分牛蒡子苷具有明确的抗肿瘤活性[2]。牛蒡根尚未列为药用部位,但所含的营养成分较丰富,已作为蔬菜及保健食品广为食用[3]。牛蒡根具有抗细菌和真菌作用,也可降血脂、保护肝脏[4-6]。笔者的前期研究发现,牛蒡根提取物对某些肿瘤细胞存在一定的抑制作用,并对化疗药物有减毒增效的作用[7]。进一步的成分分析发现,牛蒡根中仅含有极少量的牛蒡子苷,表明还有其他有效成分发挥了抗肿瘤作用。为此,笔者对牛蒡根中抗肿瘤活性较强的氯仿提取物进行分离提取,采用体外筛选的方法明确其活性组分,进一步从细胞周期、凋亡、免疫功能和逆转耐药等方面探讨其可能的抗肿瘤机制。
1 材料与方法
1.1 实验材料
1.1.1 主要仪器 CO2孵育箱(美国Revco公司);Infinite M200 PRO型全波长多功能酶标仪 (奥地利Tecan公司);CKX41型倒置显微镜(日本Olympus公司);96孔板(德国Greinerbio公司);流式细胞分选仪 S3e(Bio-Rad Laboratories公司);流式细胞仪(FACSCantoⅡ)。
1.1.2 试剂 牛蒡根为市售品;RPMI1640培养液(GIBCO公司);小牛血清(CORNING 公司);MTT、刀豆蛋白(北京欣经科生物技术有限公司);石油醚、乙醚(天津市化学试剂三厂);碘化丙啶PI(索莱宝科技有限公司);RNase A(索莱宝科技有限公司)。
1.1.3 细胞株 小鼠骨肉瘤细胞S180、人白血病细胞K562、耐阿霉素人白血病细胞K562/O2均由天津市医药科学研究所肿瘤药理室传代保存。
1.2 实验方法
1.2.1 样品的制备
1.2.1.1 溶剂提取法制备氯仿提取物:取市购新鲜牛蒡根(Arctiumlappa L.)(经天津中医药大学马琳教授鉴定为真品),切制成片,干燥后粉碎。用8倍量的乙醇渗漉法提取,过滤。滤液减压浓缩后的醇浸膏,加水使混悬。用氯仿萃取后,减压回收溶剂,得氯仿层提取物。
1.2.1.2 硅胶柱层析法分离不同组分:取100~200目硅胶,玻璃管柱干法装柱,敲打均匀,静置过夜。氯仿层提取物浸膏3 g用氯仿溶解后加入硅胶搅拌均匀,放置过夜,氯仿自然挥干。次日装柱,将搅拌均匀的样品铺于玻璃柱硅胶表面上端平面。加注洗脱液,依次为石油醚-乙醚(40∶1)、(25∶1)、(8∶1)和(3∶1),每种比例洗脱液500 mL。洗脱液沿柱内壁缓慢加入,经柱分离后的洗脱液依次用10 mL试管盛装。取各试管样品10 μL,点样于活化后的硅胶薄层板底边8 mm处,以氯仿-甲醇(9:1)展开。待展开8 cm后取出,挥干溶剂,喷以磷钼酸显色剂,105℃加热至显色清晰。选取斑点集中的合并,减压回收溶剂,将浓缩物再低温真空干燥后,称重计算收率。
1.2.2 各组分成分初步鉴定
1.2.2.1 化学法鉴定组分成分:取4个组分样品,用适量醋酐溶解,沿试管壁加入浓硫酸数滴,观察在两液交界处显色反应(Liebermann-Burchard实验)或滴入碘化铋钾沉淀试剂,观察试管内是否有橘红色沉淀产生(碘化铋钾沉淀实验)。
1.2.2.2 TLC法鉴定组分成分:取活化后的硅胶薄层板,将待鉴定的L-1、L-2、β-谷甾醇和齐墩果酸标准品分别用氯仿溶解,各取10 μL,点样于距薄层板底边8 mm处。以石油醚-乙酸乙酯(1∶1)展开。待展开8 cm后取出,挥干溶剂,喷以磷钼酸显色剂,105℃加热至显色清晰。
1.2.3 样品对体外培养肿瘤细胞生长的影响 取接种肿瘤细胞6~8 d生长良好的S180荷瘤小鼠,无菌条件下抽取腹水,PBS洗涤2次。用含10%小牛血清的RPMI1640液调整细胞浓度至1×106/mL单细胞悬液。另取对数生长期K562细胞,用10%小牛血清的RPMI1640液调整细胞浓度1×105/mL。两种细胞分别以每孔100 μL分别接种于96孔板中。空白对照组加常规培养液,待测样品组加入含相应浓度的有效组分溶液,使反应体系为200 μL。每组平行4孔。37℃、5%CO2培养箱中培养72 h后,离心,小心弃去上清,每孔加入 MTT(0.5 g/L)100 μL,继续培养4h弃去上清,每孔再加入二甲基亚砜(DMSO)150μL,用微量振荡器振荡10 min使结晶物充分溶解。以酶标仪于570 nm波长下检测每孔的光密度(OD)值,按下式计算细胞生长抑制率。生长抑制率(IR,%)=(1-实验组 OD/空白对照组 OD)×100%。细胞抑制率对剂量对数做线性回归方程计算IC50值。
1.2.4 流式细胞术测定有效组分对K562细胞周期及凋亡的影响 取对数生长期K562细胞,用含10%小牛血清的RPMI1640液调整细胞接种于25 cm2培养瓶中。空白对照组加常规培养液,待测样品组加含有一定浓度有效组分溶液,于37℃、5%CO2培养箱中培养72 h。取各组细胞用冷PBS洗涤2次,离心,用70%的乙醇溶液,4℃固定24 h,PBS洗涤 2 次后,加 RNaseA,终浓度为 50 μg/mL,37℃孵育30 min,加入 PI,终浓度为 20 μg/mL,避光,37℃孵育30 min,流式细胞仪分析细胞周期。另取对照组和待测样品组细胞,分别加PBS缓冲液将细胞吹悬,加入试剂盒配套的1×binding buffer缓冲液中,用膜联蛋白V(Annexin V)与PI染料避光孵育15 min,上流式细胞仪检测细胞凋亡情况。
1.2.5 样品对淋巴细胞增殖的影响 昆明种小鼠颈椎脱臼处死,无菌条件下取出脾脏。用1 mL注射器吸取冷RPMI1640液,将小鼠脾淋巴细胞透过脾脏包膜冲出。收集脾淋巴细胞,调整细胞浓度至4×106/mL。以每孔75 μL加于96孔板中,再加入20 μg/mL的ConA溶液25 μL。设置空白对照组、ConA对照组和待测样品组,每组平行4孔。空白对照组和ConA对照组加常规培养液,待测样品组加入含相应浓度的有效组分溶液,使反应体系为200 μL。于 37℃、5%CO2培养箱中培养 72 h。用 MTT法(1.2.3项下步骤)在570 nm检测OD值。
1.2.6 MTT法检测样品对K562/O2细胞耐药性的影响
1.2.6.1 样品对K562/O2细胞增殖能力的影响:取对数生长期K562/O2细胞,用10%小牛血清的RPMI1640液调整细胞浓度1×105/mL,以每孔100 μL接种于96孔板中。空白对照组加常规培养液,待测样品组加入含相应浓度的有效组分溶液100 μL,每组平行4孔。37℃、5%CO2培养箱中培养72 h后,用MTT法(1.2.3项下步骤)在570 nm检测OD值。
1.2.6.2 样品对K562/O2细胞耐药性的影响:取对数生长期K562/O2细胞,以1×105/mL接种于96孔板中,每孔100 μL,再加入不同浓度的阿霉素溶液及一定浓度的样品溶液各50 μL。平行设4个复孔,培养板37℃、5%CO2培养箱中培养72 h。用MTT法(1.2.3项下步骤)在570 nm检测OD值,计算细胞抑制率及IC50。同时,测定阿霉素对K562细胞的IC50,用于计算耐药倍数(耐药指数=耐药细胞IC50/敏感细胞 IC50)。
2 结果
2.1 样品的制备 800 g牛蒡根粉末,经乙醇渗漉提取的浸膏,用氯仿萃取得提取物17.6 g。取3 g浸膏经硅胶柱洗脱分离后得到L-1、L-2、L-3和L-4,分别为 75.624、64.134、97.064 和 310.661 mg。各部分收率分别为0.055%、0.047%、0.007%和0.228%。其中组分L-1为淡黄色黏稠液体、组分L-2为白色固体、组分L-3和L-4均为褐色固体。
2.2 各组分成分初步鉴定
2.2.1 化学法鉴定组分成分 Liebermann-Burchard反应中,在两液交界处,L-1最终显暗绿色,L-2显紫红色环,组分L-3和L-4显色不明显。表明L-1主要成分可能含有甾体类成分,而L-2显紫红色环则可能含有三萜类成分。各组分的碘化铋钾沉淀反应实验未见明显的橘红色沉淀,初步判定各组分中不含生物碱成分。
2.2.2 TLC法鉴定组分成分 在L-1和L-2色谱中,分别与β-谷甾醇和齐墩果酸对照品色谱相应位置上显示相同的斑点,表明L-1组分中可能含有β-谷甾醇成分,而L-2组分中可能有齐墩果酸成分,见图1。

图1 牛蒡根氯仿提取物组分TLC及成分鉴定结果Fig 1 TLC chromatogram and identification results of chloroform extract from the roots of Arctiumlappa
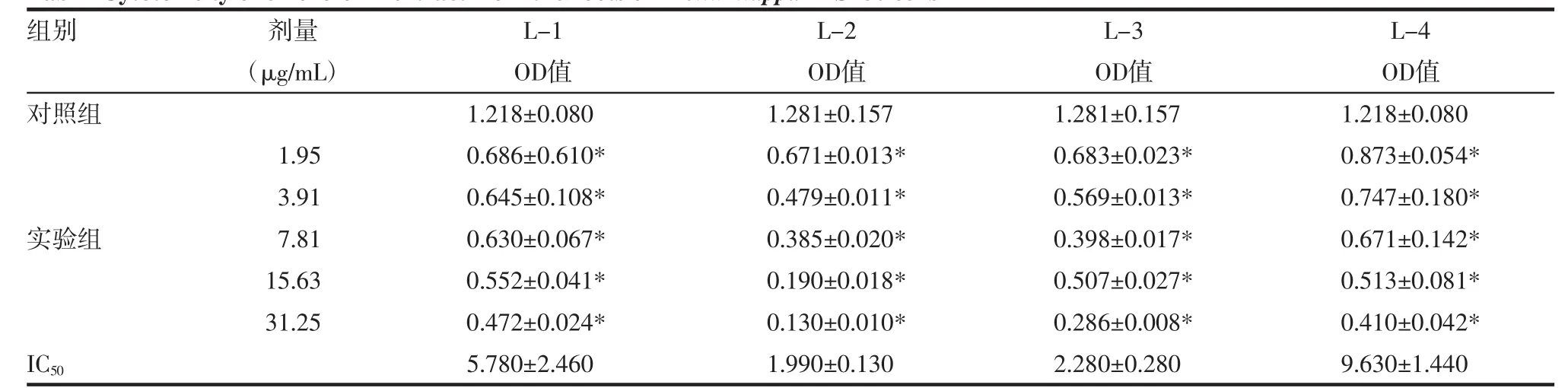
表1 牛蒡根分离物对S180细胞毒作用结果Tab 1 Cytotoxicity of chloroform extract from the roots of Arctiumlappa in S180 cells
2.3 样品对体外培养肿瘤细胞生长的影响 与细胞对照组相比,牛蒡根提取物甾体类组分(L-1)、三萜类组分(L-2)、L-3和L-4对小鼠S180细胞抑制活性都较强,在一定浓度范围内基本上保持明确的量效关系,见表1。表2结果显示,在19.53~625.00 μg/mL浓度范围内4个组分对K562细胞增殖的抑制率有明显不同,其中三萜类组分IC50最低,在此浓度范围内存在明确的量效关系,较其他样品效果最好。

表2 牛蒡根分离物对K562细胞毒作用的结果Tab 2 Cytotoxicity of chloroform extract from the root of Arctiumlappa in K562 cells
2.4 流式细胞术测定有效组分对K562细胞周期及凋亡的影响 与正常对照组相比,牛蒡根甾体类组分(250 μg/mL)并没有对K562细胞周期产生明显影响。而三萜类组分(100 μg/mL)可使K562细胞 G0/G1期细胞比例显著增加,S期细胞比例显著减少(P<0.05)。对照组、甾体类组分及三萜类组分凋亡率分别为:(5.1±0.3)%、(21.8±2.4)%和 (38.0±2.8)%。与对照组相比,两组分均明显诱导K562细胞凋亡(均P<0.05),见图 2和表 3。

图2 牛蒡根甾体类组分及三萜类组分对K562细胞周期和凋亡的影响Fig 2 The effect of Steroidal components and Triperpenoids components on cells cycle and apoptosis of K562 cells

表3 牛蒡根提取物有效组分对K562细胞周期及凋亡的影响Tab 3 The effect of Steroidal components and Triperpenoids components on cells cycle and apoptosis of K562 cells
2.5 样品对淋巴细胞增殖的影响 从表4来看,ConA在体外能明显促进小鼠脾淋巴细胞的增殖。牛蒡根三萜类组分在6.25~200 μg/mL时有促进细胞增殖的趋势,但总体均没有剂量依赖关系。甾体类组分在所测试的浓度范围内对小鼠脾淋巴细胞大多表现出抑制增殖的作用。
2.6 MTT法检测样品对K562/O2细胞耐药性的影响
2.6.1 样品对K562/O2细胞增殖能力的影响 由表5结果看出,测试的最高浓度基本上未达到50%抑制率,说明有效组分对耐阿霉素细胞株K562/O2的细胞毒作用较弱。
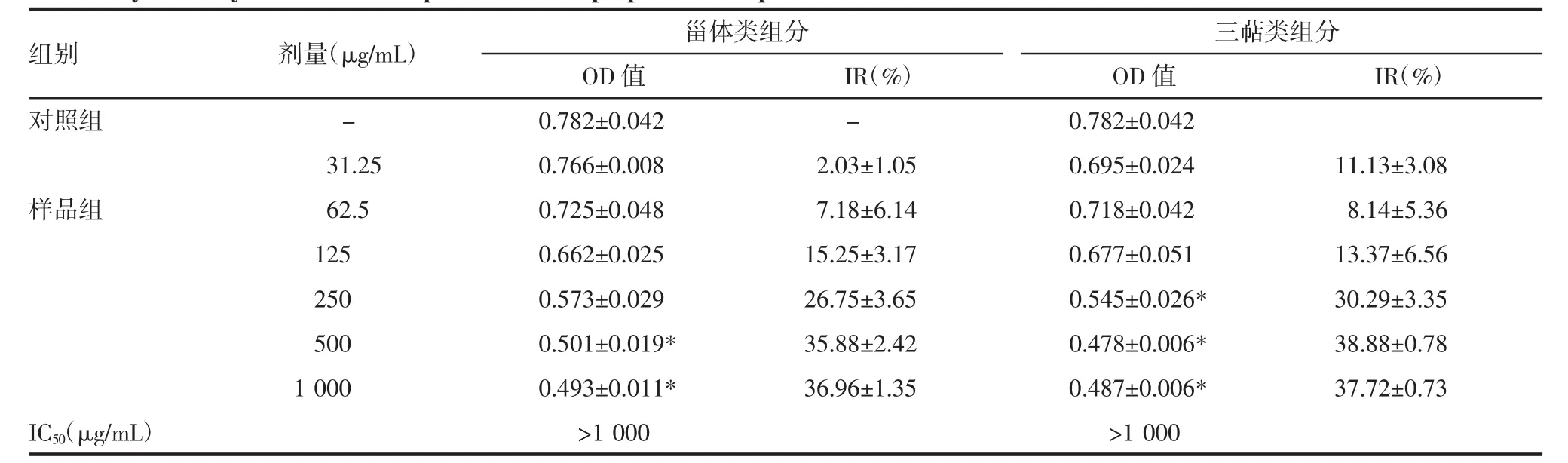
表5 牛蒡根有效组分对K562/O2细胞毒作用结果Tab 5 Cytotoxicity of Steroidal components and Triperpenoids components in K562/O2 cells
2.6.2 样品对K562/O2细胞耐药性的影响 表6结果显示,阿霉素对K562细胞的IC50值为0.052μg/mL,而阿霉素单独作用于K562/O2细胞的IC50值为60.60 μg/mL,其耐药指数超过 1 000。500μg/mL 或1 000 μg/mL的三萜类组分与阿霉素合用后,其IC50值仍高于阿霉素单独使用时的IC50值。而甾体类组分与阿霉素合用后,在500 μg/mL时IC50值为48.79 μg/mL,在 1 000μg/mL 时 IC50值为 24.35 μg/mL,均比阿霉素单独使用的IC50值低,耐药指数均有降低,证明甾体组分有一定的逆转细胞耐药的趋势。

表6 牛蒡根有效组分对K562/O2细胞逆转耐药作用结果Tab 6 The effect of Steroidal components and Triperpenoids components on reversing tumor multidrug resistance
3 讨论
以往的实验中,通过薄层色谱法对牛蒡根及牛蒡子化学成分进行了一些初步的比较,结果显示,牛蒡根中几乎不含有牛蒡子特有的抗肿瘤活性成分——牛蒡子苷。说明牛蒡根存在不同于牛蒡子苷的抗肿瘤活性成分,对其粗提物进一步分离提取,为研究其确切的抗肿瘤活性成分提供了依据。牛蒡作为菊科植物,从宏观上来讲,应该含有本科植物中普遍含有的聚炔类化合物、倍半萜内酯、三萜、黄酮、甾体、菊淀粉等成分[8-9]。本研究通过化学鉴定及活性测试,发现牛蒡根中活性物质可能是甾体类和三萜类成分。
选用S180细胞和K562细胞观察牛蒡根氯仿层提取物进一步分离得到的甾体类组分、三萜类组分、L-3和L-4 4个组分的细胞毒活性。发现甾体类组分和三萜类组分活性较强且存在一定的量效关系。进一步研究发现,三萜类组分能够使K562细胞阻滞在G0/G1期而不能进入DNA合成期(S期),抑制了肿瘤细胞DNA的合成。甾体类组分和三萜类组分都能明显的引起K562细胞的凋亡。而引起细胞凋亡的机制很多,包括死亡受体途径、线粒体途径及交织旁路途径等[10]。磷脂酰肌醇3激酶-蛋白激酶B(PI3K-Akt)信号通路是人类癌症中一条重要的信号转导通路,在大多数癌症中都处于激活状态,研究表明三萜类成分会下调PI3K-Akt信号通路,诱导细胞凋亡[11]。这也可能是牛蒡根三萜类组分诱导凋亡的途径之一。另有研究发现,β-谷甾醇和肿瘤坏死因子相关凋亡诱导配体结合发挥诱导凋亡作用[12]。由此推断牛蒡根有效组分的诱导凋亡机制与这两个途径相关。
肿瘤与免疫有着密不可分的关系,现代免疫学理论认为,肿瘤免疫以细胞免疫为主,机体抗肿瘤免疫反应中的细胞免疫主要依赖 T淋巴细胞介导[13]。脾脏属于外周免疫器官,其中存在大量T淋巴细胞[14]。小鼠淋转实验显示,三萜类组分在一些剂量下表现出一定的促进淋巴细胞增长的趋势,能增强机体免疫功能,对抗肿瘤起到积极作用。肿瘤细胞的耐药性是肿瘤化疗失败的主要原因,也是困扰肿瘤治疗的一大难题[15]。化疗耐药涉及了药物转运蛋白、细胞凋亡抑制、DNA损伤修复和上皮-间充质转化在内的多种因素[16]。MDR1基因过度表达产生的P-gp增加药物转运和外排是耐药现象产生的最重要原因[17]。阿霉素可诱导某些细胞过表达P-gp,同时激活Wnt/β-catenin通路也可过表达P-gp,从而促进细胞对阿霉素耐药[18]。甾体类组分表现出一定的逆转K562/O2细胞的耐药作用,其机制可能与降低P-gp表达相关,这个结果也将成为今后研究的重点。
牛蒡根是一个具有开发前景和研究价值的保健食品,本研究对牛蒡资源的再利用及天然来源新型抗肿瘤物质的发现具有十分重要的意义。本研究项目的完成将为科学地综合利用牛蒡资源及天然来源新型抗肿瘤物质的发现打下良好的基础。
