阿胶低聚肽的成分分析及其抗氧化活性
2020-09-23樊雨梅汝文文史传超钤莉妍
樊雨梅,汝文文,史传超,钤莉妍,廖 峰
(国家胶类中药工程技术研究中心,东阿阿胶股份有限公司,山东聊城 252201)
阿胶(CollaCoriiAsini,CCA)为马科动物驴(EquusasinusL.)的干燥皮或鲜皮经煎煮、浓缩制成的固体胶[1],已有2000多年的使用历史,始载于《神农本草经》。阿胶的主要成分是胶原蛋白、多肽类物质、氨基酸、微量元素和硫酸皮肤素。现在药理研究表明,阿胶具有治疗贫血[2]、辅助治疗肿瘤[3]、提高免疫力[4-5]、抗炎[6]和抗衰老[7]等功效。通常认为在阿胶中起主要功效的化学成分是多肽和蛋白质的混合物。目前,阿胶主要的食用方式是经烊化后口服,不仅服用不便,且存在生物利用度较低易产生“滋腻碍胃”的问题。因此,阿胶的二次开发迫在眉睫。
基于阿胶分子量大、生物利用度较低的问题,采用生物酶解技术制备阿胶低聚肽,不仅解决阿胶服用前需烊化的问题,而且能够提高阿胶的生物利用度,减轻胃肠负担。已有研究证实,阿胶经酶解产生的生物活性肽,可提升阿胶的药理作用。刘元涛等[8]研究证实,阿胶经酶解后,增强了提高小鼠免疫力的作用。Wu等[9]研究发现,模拟人体消化过程酶解阿胶得到组分A(<5000 Da)和组分B(5000~8000 Da),2种组分均可刺激贫血小鼠造血,且组分A效果优于组分B。虽然关于小分子阿胶提高免疫力、抗氧化、抗疲劳、止血、补血的作用已有报道,文献[10-14]研究了阿胶酶解产物治疗贫血、抗疲劳、抗氧化、止血、提高免疫力等作用,但是这些研究采用的阿胶酶解产物或是来自实验室小规模制备,仅显示分子量大小,或是企业提供,无任何产品相关信息。因此,本文基于前期大量生物酶解工艺及生产工艺优化的基础,以阿胶为原料制备阿胶低聚肽,表征阿胶低聚肽的氨基酸组成、分子量分布,并比较阿胶低聚肽与阿胶对成纤维细胞氧化损伤的保护作用。
1 材料与方法
1.1 材料与仪器
阿胶 批号:1707038,东阿阿胶股份有限;人成纤维细胞(NHDFs) ATCC PCS-201-010,美国生物标准资源中心;木瓜蛋白酶(1.201×106U/g)、胃蛋白酶(3000 U/g)、菠萝蛋白酶(5.02×105U/g) 南宁庞博生物工程有限公司;维生素C、1,2-二苦基-2-三硝基苯亚肼(DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS) 阿拉丁试剂有限公司;PBS、DEME培养基、胎牛血清、0.25%胰蛋白酶 Gibco公司;SOD试剂盒 南京建成生物工程研究所;活性氧检测试剂盒 上海碧云天生物技术公司;低聚肽标准品 上海寰玉分析仪器科技有限公司;乙腈、邻苯二甲醛(OPA)、氯甲酸芴甲酯(FMOC-Cl)、甲醇、乙腈、氨基酸标准品 色谱纯,国药集团化学试剂有限公司。
e2695高效液相色谱仪 美国Waters公司;Hypersil AA-ODS色谱柱(5 μm,200 mm×2.1 mm) 美国Agilent公司;TSKgel G2000 SWXL(300 mm×7.8 mm)色谱柱 上海甄准生物科技有限公司;2015SW0006酶标仪 美国Bio-Rad公司;Observer.D1倒置荧光显微镜 德国ZEISS公司。
1.2 实验方法
1.2.1 阿胶低聚肽化学物质基础
1.2.1.1 阿胶低聚肽的制备工艺 阿胶低聚肽的酶解制备工艺[15]:阿胶→粉碎→溶解→在设定温度中保温(50~55 ℃)→按照比例加入一定量的木瓜蛋白酶、胃蛋白酶、菠萝蛋白酶开始酶解→搅拌酶解→酶解结束后沸水灭酶10 min→过120目筛→浓缩→真空干燥→室温保存备用。
1.2.1.2 常见指标检测 阿胶低聚肽中水分含量依据GB 5009.3-2016中直接干燥法进行水分测定[16],蛋白质含量利用GB 5009.5-2016中凯氏定氮法进行测定[17],游离氨基酸的测定采用GB/T 5009.124-2016的方法测定[18]。
1.2.1.3 分子量分布的测定 参照GB/T 22729-2008规定的方法进行测定[19]。
1.2.2 清除自由基实验
1.2.2.1 DPPH自由基清除率测定 取 0.5 mL待测溶液,加入 0.5 mL 的DPPH乙醇溶液,充分混匀后,将反应体系置于室温,避光反应20 min。反应结束后,依次取反应液200 μL加入96孔板,于517 nm下读取吸光度OD值,按照下式计算样品对DPPH自由基的清除率。每个样品重复三次。
DPPH自由基清除率(%)=[(C1-C2)-(T1-T2)]/(C1-C2)×100
式中:C1:空白有DPPH体系吸光度值;C2:空白无DPPH体系吸光度值;T1:样品组有DPPH体系吸光度值;T2:样品组无DPPH体系吸光度值。
1.2.2.2 ABTS自由基清除率测定 取 10 μL 待测溶液,加入0.2 mL ABTS 溶液,摇匀后,室温孵育2~6 min后,于734 nm下读取吸光度OD值,按照下式计算样品对ABTS自由基的清除率。每个样品重复三次。
ABTS自由基清除率(%)=[(C1-C2)-(T1-T2)]/(C1-C2)×100
式中:C1:空白有ABTS体系吸光度值;C2:空白无ABTS体系吸光度值;T1:样品组有ABTS体系吸光度值;T2:样品组无ABTS体系吸光度值。
1.2.3 阿胶低聚肽对氧化损伤成纤维细胞的抑制作用
1.2.3.1 细胞存活率的影响 在96孔板的每个孔中加入0.1 mL密度为1×105cell/mL的成纤维细胞悬液,即1×104cell/well。于37 ℃、5% CO2、湿润条件下培养24 h,直至细胞生长至60%。去除培养液,用预温的PBS轻洗两次。去除清洗液,加入0.1 mL含适当浓度阿胶、阿胶低聚肽、溶剂(空白对照)的培养基,实验设置阿胶组、阿胶低聚肽组、空白对照组、模型对照组。37 ℃、5% CO2、湿润条件下继续培养24 h。将各孔细胞培养上清液吸出,加入100 μL 150 μmol/L H2O2作用100 min,然后用CCK-8测定细胞活性。
1.2.3.2 细胞内ROS水平检测 按照4×105cell/well接种至6孔细胞培养板中,同1.2.3.1分组及预处理细胞后,采用活性氧检测试剂盒检测各组细胞二氯二氢荧光素(DCF)荧光强度,用荧光显微镜拍照观察,激发光波长为488 nm,发射波长为525 nm。
1.2.3.3 SOD水平的测定 同1.2.3.1分组及预处理后,分别采用SOD试剂盒和BCA试剂盒检测各组细胞SOD活性和细胞蛋白浓度,按照各说明书的公式计算各组SOD活性和细胞蛋白浓度。
1.3 数据处理
应用GraphPad Prism 7软件进行数据分析与绘图,实验重复3次,结果以“均数±标准差”表示。多重数据差异比较采用方差分析,两组间差异比较采用t检验,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 阿胶低聚肽的成分分析
2.1.1 阿胶低聚肽的常见指标 采用复合蛋白酶酶解制得的阿胶低聚肽呈浅棕色至棕色粉状,具有胶香味、味微苦、无异味,无肉眼可见杂质。采用国标方法测定阿胶低聚肽水分和蛋白的含量,分别为6.72和94.00 g/100 g。阿胶低聚肽的蛋白含量显著高于阿胶蛋白含量74.56~84.94 g/100 g[20]。
阿胶低聚肽中游离氨基酸组成和含量见表1。阿胶低聚肽中游离氨基酸的总量为79.06 g/100 g,介于阿胶中氨基酸的含量30.14~87.07 g/100 g[21-25]。阿胶低聚肽富含人体必需的8种氨基酸和2种半必需氨基酸(组氨酸和精氨酸),占氨基酸总量的28.62%。阿胶低聚肽的氨基酸组成中具有给质子能力的氨基酸占59.95%,具有很强稳定自由基的能力。疏水性氨基酸是影响多肽抗氧化能力的关键因素,疏水性氨基酸含量越高,抗氧化能力越强[26]。阿胶低聚肽疏水性氨基酸占氨基酸总量的46.23%,可为阿胶低聚肽提供疏水环境,促进清除脂相产生的自由基。氨基酸组成是小肽转运的决定因素之一,疏水性比较大的氨基酸构成的肽,与载体具有较高的亲和力,较易吸收[27]。阿胶低聚肽疏水性氨基酸含量较高,有助于阿胶低聚肽被机体吸收利用,可提高阿胶体内的抗氧化活性。

表1 阿胶低聚肽的氨基酸组成及含量Table 1 Amino acid composition and contents of Colla Corii Asini oligopeptides
2.1.2 阿胶低聚肽的分子量分布 采用高效液相色谱法测定阿胶低聚肽的分子量分布,分子量分布计算结果如表2所示。阿胶低聚肽属于小分子混合物,分子量900 Da以上的仅占16.12%,分子量900 Da以下的高达83.87%,其中主要集中在500 Da以下。大量研究报道,分子量越小,抗氧化能力越强[28-29]。阿胶低聚肽的分子量主要集中在900 Da以下,推测阿胶低聚肽的抗氧化能力较强。

表2 阿胶低聚肽的分子量分布Table 2 Molecular weight distribution of Colla Corii Asini oligopeptides
食物中蛋白质在胃肠道消化酶的作用下,最后大多以游离氨基酸和小肽的形式被完整的吸收[30]。且在临床营养支持中,小肽的吸收形式优于相应的氨基酸[27]。分子量900 Da以下多为2~4个氨基酸组成的小分子肽,因此,推测阿胶低聚肽具有良好的吸收效率。
2.2 阿胶低聚肽体外抗氧化活性的测定
2.2.1 阿胶低聚肽清除自由基的能力
2.2.1.1 DPPH自由基清除能力 阿胶和阿胶低聚肽的DPPH自由基清除率见图1。阿胶和阿胶低聚肽清除DPPH自由基的趋势相同:在浓度0~5 mg/mL之间具有量效关系,且具有统计学显著性差异;在5~20 mg/mL范围内无明显量效关系,且无统计学差异性。在浓度为10 mg/mL时,阿胶和阿胶低聚肽清除DPPH自由基的能力最高,分别为90.13%±0.17%和93.45%±0.27%。所有同等剂量下阿胶低聚肽溶液的DPPH自由基清除率均高于阿胶溶液,这与Wu[10]等的结果一致。郑淋[31]总结具有活性的262个抗氧化肽的肽段序列、活性评价方法等信息,发现抗氧化肽的抗氧化活性可能与其序列中含有的能供电子或氢能力的氨基酸残基(组氨酸、酪氨酸、色氨酸和蛋氨酸等)、具有螯合金属离子的酸性氨基酸(天冬氨酸、谷氨酸)和疏水性氨基酸残基有关。也有研究发现,疏水性氨基酸在对抗脂质过氧化反应有重要的作用,脯氨酸、丙氨酸、缬氨酸和亮氨酸与自由基的清除能力有关[32]。经过计算,阿胶低聚肽的供电子或氢能力的氨基酸和螯合金属离子的酸性氨基酸占总氨基酸的比例分别为2.46%和19.06%,高于阿胶的比例(分别是2%、17.32%[21-25])。另外,阿胶和阿胶低聚肽的半抑制浓度(IC50)分别为1.89和1.39 mg/mL,显著低于李笑尘等[33]报道的3.0 g/L。

图1 阿胶和阿胶低聚肽的DPPH自由基清除能力Fig.1 DPPH radical scavenging activity of Colla Corii Asini and Colla Corii Asini oligopeptides
2.2.1.2 ABTS自由基清除能力 阿胶和阿胶低聚肽的ABTS自由基清除率见图2。阿胶和阿胶低聚肽具有清除ABTS自由基的功效,在浓度0~2.0 mg/mL范围内具有量效关系,且具有统计学显著性差异。经过计算,阿胶的IC50为3.33 mg/mL,与Zhang等[34]报道的阿胶IC50为2.859 g/L一致,表明实验结果准确可靠。由图2可知,所有同等剂量下阿胶低聚肽溶液的ABTS自由基清除率均高于阿胶溶液。已有研究表明,蛋白原料的酶解产物在ABTS法中的抗氧化活性与其蛋白原料中的酪氨酸、色氨酸、半胱氨酸和蛋氨酸等抗氧化氨基酸的含量高度相关[31]。阿胶低聚肽酪氨酸、色氨酸、蛋氨酸等抗氧化氨基酸的含量为1.79 g/100 g,介于阿胶抗氧化氨基酸的含量1.70~3.80 g/100 g。Rajapakse等[35]报道,天冬氨酸在一些抗氧化肽中发挥着重要的作用,且与其在肽段中的位置无关。阿胶低聚肽中天冬氨酸含量为5.15 g/100 g,阿胶中天冬氨酸含量为1.83~5.20 g/100 g。可见,氨基酸的组成仅能部分解释阿胶低聚肽抗氧化活性优于阿胶,需进一步研究氨基酸的序列以解释阿胶与阿胶低聚肽抗氧化的活性。经过计算,阿胶低聚肽的IC50为2.06 mg/mL,高于李笑尘等[33]报道的0.7 g/L。
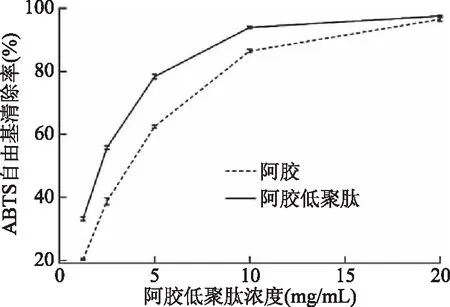
图2 阿胶和阿胶低聚肽的ABTS自由基清除能力Fig.2 ABTS+ radical scavenging activity of Colla Corii Asini and Colla Corii Asini oligopeptides
2.2.2 阿胶低聚肽对氧化损伤成纤维细胞的抑制作用
2.2.2.1 细胞存活率的影响 用H2O2处理成纤维细胞后,细胞的增殖活性明显降低,细胞存活率降低至47.18%,与凌玉芳等[36]的报道一致。阿胶和阿胶低聚肽防护H2O2造成的细胞氧化损伤结果见图3。阿胶和阿胶低聚肽防护H2O2诱导成纤维细胞氧化损伤趋势相同,但各浓度阿胶低聚肽的效果显著优于阿胶(P<0.01),与刘元涛等[8]、Wu等[9-10]报道的阿胶经酶解后,可提高阿胶的药理活性结论一致。与模型组相比,1%阿胶、0.5%与1.0%阿胶低聚肽预处理均可显著提高成纤维细胞的增殖活性。

图3 阿胶和阿胶低聚肽对H2O2诱导NHDFs细胞存活率的影响Fig.3 Effects of Colla Corii Asini and Colla Corii Asini oligopeptides on the survival rate of NHDFs cells induced by H2O2注:与阿胶组相比,*表示差异显著,P<0.05;**表示差异极显著,P<0.01;“+”表示加入药物,“-”表示不加入药物。
2.2.2.2 细胞内ROS水平检测 利用DCFH-DA法检测阿胶和阿胶低聚肽对成纤维细胞内ROS清除能力的影响,结果见图4。与空白对照组(图4a)相比,H2O2模型组(图4b)荧光强度高,损伤明显。接受阿胶处理的H2O2损伤后成纤维细胞在荧光显微镜下观察到少部分细胞表达出较高的荧光(图4c),与H2O2模型组相比,表达高荧光的细胞数量及荧光轻度明显减少,且阿胶低聚肽的效果优于阿胶。
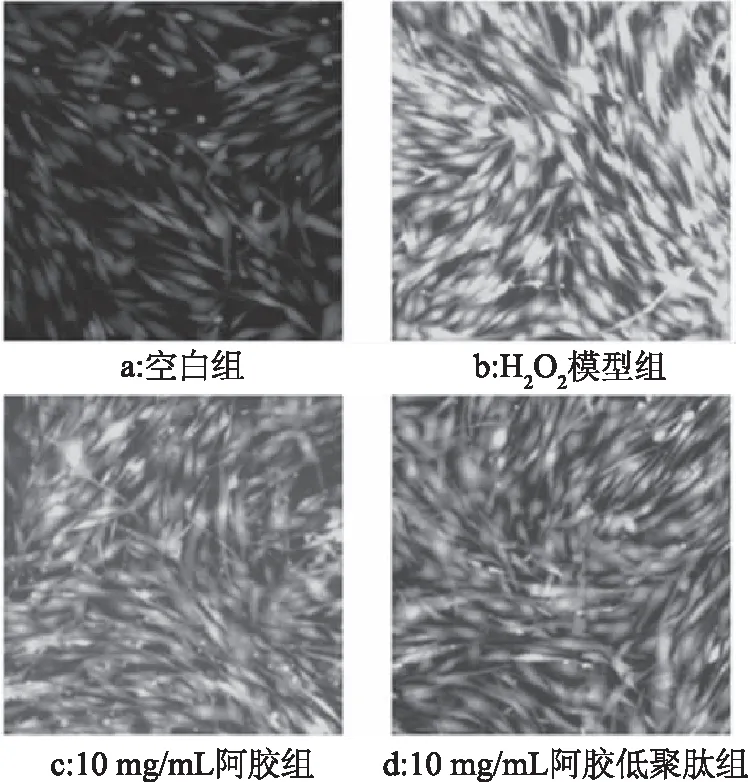
图4 ROS含量的变化Fig.4 Changes of ROS content in NHDFs cells
2.2.2.3 SOD水平的测定 SOD作为一种主要的抗氧化酶,可有效清除超氧阴离子,SOD水平高低可间接反映组织自由基的含量和细胞受损程度。本研究测定成纤维细胞中SOD的活力水平,以考察阿胶和阿胶低聚肽对H2O2造成成纤维细胞氧化损伤的防护效果。由表3可知,与模型组相比,10 mg/mL的阿胶和阿胶低聚肽组的SOD活力分别升高148.72和415.88 U/mg prot,差异均具有统计学意义(P<0.01)。阿胶低聚肽升高SOD水平是阿胶的115.03%,可见虽然阿胶能够提高氧化损伤细胞的SOD活性,但阿胶低聚肽的效果更佳。

表3 阿胶和阿胶低聚肽对H2O2诱导NHDFs细胞SOD活性的影响Table 3 Effects of Colla Corii Asini and Colla Corii Asini oligopeptides on SOD in NHDFs induced by H2O2
3 结论
本研究首次对阿胶低聚肽进行较为全面的成分分析及体外防护H2O2造成氧化损伤效果的测定,并将阿胶低聚肽与阿胶体外抗氧化活性进行对比分析。以阿胶为原料,通过复合酶解法获得阿胶低聚肽。阿胶低聚肽氨基酸种类齐全,含有人体必需的8种氨基酸和2种半必需氨基酸(组氨酸和精氨酸),且富含疏水性氨基酸,占氨基酸总量的46.23%,使得阿胶低聚肽抗氧化性增高。阿胶低聚肽主要成分为900 Da以下的小分子肽,易于被人体吸收。从清除DPPH、ABTS自由基和防护H2O2造成成纤维细胞氧化损伤等方面,分析阿胶与阿胶低聚肽体外抗氧化活性的差异。结果表明,阿胶和阿胶低聚肽可能通过增加细胞增殖活性、清除自由基、提高抗氧化酶活性等方面发挥对H2O2诱导成纤维细胞氧化损伤的防护作用,但阿胶低聚肽的效果优于阿胶。实验结果不仅为下一阶段筛选阿胶相关功能特征肽段,明确阿胶抗氧化分子机制奠定了良好的基础,也为阿胶方便服用和相关抗氧化保健食品的开发利用提供了一定的理论支持。
