大蒜素对脂多糖诱导腹腔巨噬细胞炎症反应的抑制作用及机制
2020-09-23李鸿洋李敬双高泉颀
李鸿洋,李敬双,高泉颀,于 洋,*
(1.锦州医科大学食品科学与工程学院,辽宁锦州 121000;2.锦州医科大学畜牧兽医学院,辽宁锦州 121000)
炎症是机体对各种致炎因子所产生的防御反应。炎症表现为对机体的保护作用,但过度和持续的炎症反应会对机体造成伤害。随着近年来对天然抗炎药物的深入研究,越来越多天然药物的抗炎作用获得认可。探索具有抗炎活性的天然产物以改善或治愈炎症已成为当前研究的热点之一。
大蒜(AlliumsativumL.)为百合科(Liliaceae)葱属(Allium),二年生草本植物。大蒜营养丰富,嫩苗、花茎和鳞茎均可食用,用途广泛,加工产品种类多样,在国际贸易市场上占有重要地位,也是我国重要的出口创汇蔬菜[1]。大蒜素是大蒜中含硫有机化合物的主要有效成分,化学名为二烯丙基三硫化物,其分子式为C6H9S3[2]。研究表明,大蒜素具有多种药理学作用,例如抗癌[3]、抗炎[4]、抗菌[5]、抗氧化作用等[6]。
Wang等[7]研究结果表明,大蒜素通过PI3K/AKT途径改善氧化应激、炎症和凋亡,从而减轻LPS诱导的新生大鼠急性肺损伤(ALI)。大蒜素可用于开发治疗ALI的新药。Zhang等[8]通过大蒜素对脂多糖(LPS)诱导的人脐静脉内皮细胞(HUVECs)血管氧化应激和炎症的影响及作用机制,发现大蒜素能够减弱LPS诱导的血管炎症反应。任亮等[9]通过大蒜素对模型小鼠抗炎作用的研究,发现大蒜素具有一定的抗炎作用。姜云传[10]通过大蒜素抑制小胶质细胞抗炎作用的研究,发现大蒜素可能通过抑制小胶质细胞活化和释放细胞因子白介素1β(IL-1β)等来发挥抗炎作用。已有研究表明,大蒜素具有抗炎作用,但有关大蒜素抗炎作用机制尚不明确,需要进一步探讨研究。
为进一步明确大蒜素的抗炎作用及其机制,本研究以LPS刺激小鼠原代腹腔巨噬细胞为体外炎症模型,在基因和蛋白水平上观察大蒜素对腹腔巨噬细胞吞噬炎症因子COX-2、NO、IL-6的影响,并以地塞米松作为阳性对照,探讨其抗炎的活性及作用机制,以期为大蒜素在临床抗炎药效的开发和利用提供实验依据。
1 材料与方法
1.1 材料与仪器
健康SPF级雄性Balb/c小鼠 体重(25±3) g,6~8周龄,购于锦州医科大学生命科学研究院,生产许可证号SCXK(辽)2014-0004;大蒜素 批号:J25J9S64201,纯度:UV≥98%,上海源叶生物科技有限公司;新生牛血清 浙江天杭生物科技有限公司;脂多糖(LPS)、甲基咪唑蓝(MTT)、台盼蓝、中性红、RPMI-1640培养基、二甲基亚砜(DMSO)、COX-2、IL-6、NO检测试剂盒 北京索莱宝科技有限公司;地塞米松 上海联硕生物科技有限公司;PrimeScriptTMRT reagent Kit、TB GreenTMPremix Ex TaqTMⅡ、引物 大连宝生物科技有限公司;Trizol(R0016)、BCA蛋白定量试剂盒 碧云天生物技术有限公司;COX-2、IL-6、iNOS抗体 万类生物科技有限公司;NF-κB p65、Phospho-NF-κB p65 Cell Signaling Technology(CST)公司;β-actin抗体 武汉博士德生物工程有限公司。
CKX41S型倒置显微镜 日本 Olympus公司;HBS-1096A型酶标仪 南京德铁实验设备有限公司;Mastercyler ep realplex4型实时荧光定量PCR仪、AG 22331 Hamburg型PCR扩增仪 德国Eppendorf公司;Amersham Imager 600全自动成像分析系统 GE。
1.2 实验方法
1.2.1 小鼠腹腔巨噬细胞的分离与培养 小鼠饲养于环境温度(20±2) ℃,湿度50%±10%,按照12 h光照/12 h黑暗,自由摄食、饮水的饲养条件喂养,实验前适应性饲养1周。颈椎脱臼法处死小鼠,75%乙醇浸泡3 min,将5 mL预冷的PBS注入腹腔,轻按摩腹部约2 min,静置5 min,抽取腹腔液,于2000 r/min、4 ℃离心5 min,弃上清。将细胞沉淀在红细胞裂解液中稀释(4 mL/小鼠),在室温下孵育5 min,然后于2000 r/min、4 ℃离心5 min,弃上清。将细胞沉淀悬浮于RPMI-1640完全培养基,计数,调整细胞至所需浓度。于37 ℃ 5% CO2培养箱孵育18 h至完全贴壁,吸弃上清,去掉未贴壁细胞,加入新鲜的RPMI 1640完全培养基,即得到纯化的腹腔巨噬细胞[11]。
1.2.2 实验分组及处理 实验分为正常对照组、LPS组、LPS+地塞米松组、LPS+不同浓度的大蒜素处理组,每组均设5复孔。正常对照组:不做任何处理,正常培养24 h;LPS组:每孔加入终浓度为1 μg/mL的LPS;LPS+地塞米松组:每孔先加入终浓度为100 μg/mL的地塞米松对细胞预处理2.5 h,再加入终浓度为1 μg/mL的LPS刺激细胞;LPS+不同浓度的大蒜素处理组:每孔先加入不同浓度(40、80、160 μg/mL)的大蒜素对细胞预处理2.5 h,再加入终浓度为1 μg/mL的LPS刺激细胞。
1.2.3 细胞活力测定 参考Liu等[12]实验方法,采用MTT比色法测定细胞活力。细胞按5×103cell/mL接种于96孔板,按照1.2.2实验分组及处理,37 ℃ 5% CO2培养24 h。除去培养基后,每孔加入5 mg/mL的MTT 20 μL,避光孵育4 h,吸弃培养基,每孔加入150 μL DMSO,振荡10 min使紫色沉淀充分溶解,酶标仪于570 nm波长处测定吸光度值。
细胞活力(%)=(实验组吸光度值/对照组吸光度值)×100
1.2.4 中性红吞噬实验法检测小鼠腹腔巨噬细胞吞噬功能 参考甄庆洁等[13]实验方法,细胞按1×105cell/mL接种于96孔板,37 ℃ 5% CO2培养18 h,按照1.2.2实验分组及处理,培养24 h,弃上清,加100 μL的中性红溶液(生理盐水溶解,1 g/L),孵育30 min后,用预冷的PBS清洗3次,每孔加入细胞裂解液100 μL,4 ℃裂解12 h,酶标仪于570 nm波长处测定吸光度值。
1.2.5 Griess法检测NO的含量 参考杭宜岭等[14]实验方法,细胞按2×106cell/mL接种于24孔板,37 ℃ 5% CO2培养18 h,按照1.2.2实验分组及处理,培养24 h,于4 ℃ 3000 r/min离心20 min,收集细胞上清液,每组均设5个复孔,按照NO检测试剂盒,酶标仪于450 nm处测定细胞上清液中NO的含量。
1.2.6 ELISA法检测炎症因子COX-2酶活性和IL-6的含量 参考Lee等[15]实验方法,细胞按2×106cell/mL接种于24孔板,37 ℃ 5% CO2培养18 h,按照1.2.2实验分组及处理,培养24 h,于4 ℃ 3000 r/min离心10 min,收集细胞上清液,每组均设5复孔,按照ELISA检测试剂盒操作,酶标仪于450 nm处测定OD值并计算炎症因子COX-2酶活性和IL-6的含量。
1.2.7 Real-time PCR法检测基因COX-2、iNOS和IL-6 mRNA表达 参考Pan等[16]实验方法,细胞按1×106cell/mL接种于12孔板,37 ℃ 5% CO2培养18 h;按照1.2.2实验分组及处理,培养24 h,弃上清,用预冷的PBS清洗2次,采用Trizol法提取细胞总RNA。按照PrimeScriptTMRT reagent Kit 试剂盒进行操作,将1 μg的总RNA反转录成CDNA。根据 NCBI数据库查询得到相关基因序列,采用Primer 6引物设计软件设计引物如表1。

表1 小鼠COX-2、iNOS、IL-6和内参ACTB引物序列Table 1 COX-2,iNOS,and IL-6 of mouse and internal reference ACTB primer sequences in the experiment
按照TB GreenTMPremix Ex TaqTMII(Tli RNaseH Plus)试剂盒的说明配制反应体系:2×TB Green Premix Ex Taq II 12.5 μL,特异性引物F和R(终浓度为0.4 μmol/L)各1 μL,cDNA 2 μL,灭菌水8.5 μL,共25 μL,混合均匀,进行Real time PCR反应,按照扩增试剂盒的程序设置为预变性95 ℃ 30 s,变性95 ℃ 5 s,60 ℃ 30 s退火,40个循环。以β-肌动蛋白(ACTB)作为内参,采用 2-ΔΔCt方法进行数据分析。
1.2.8 Western Blot法检测COX-2、iNOS和IL-6及P65的总体及磷酸化水平 参考Oh等[17]实验方法,细胞按2×108cell/mL接种于6孔板,37 ℃ 5% CO2培养18 h;按照1.2.2实验分组及处理,培养24 h,弃上清。用预冷的PBS洗涤细胞,然后在冰上用RIPA强裂解缓冲液提取总蛋白,并用BCA法进行蛋白定量,煮沸备用。用10%的SDS-PAGE凝胶电泳分离蛋白,并在300 mA 60 min条件下转至PVDF膜上,用含5%脱脂奶粉的TBST缓冲液室温封闭2 h,并用TBST洗涤5 min,4 ℃条件下一抗(COX-2、iNOS、IL-6、p-p65、p65和β-actin)孵育过夜,并用TBST洗涤3次后室温下辣根过氧化物酶标记过的羊抗兔孵育1 h。TBST洗膜3次,ECL发光显影液曝光胶片,曝光成像后,运用Image J软件进行灰度分析。
1.3 数据处理
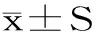
2 结果与分析
2.1 大蒜素对小鼠腹腔巨噬细胞活力的影响
由图1可知,MTT法检测结果显示,大蒜素在40、80、160 μg/mL三个浓度剂量下,单独作用或与1 μg/mL LPS共同处理24 h后均未对小鼠腹腔巨噬细胞生长造成显著影响(P>0.05)。因此,在后续实验中采用1 μg/mL LPS作为刺激浓度,并选取40~160 μg/mL浓度范围作为大蒜素的处理浓度。
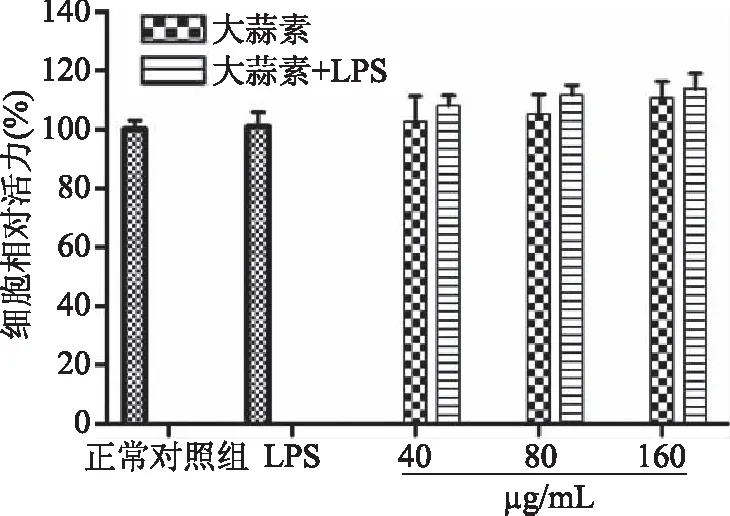
图1 大蒜素对小鼠腹腔巨噬细胞活力的影响Fig.1 Effect of allicin on the cell viability of mouse peritoneal macrophages
2.2 大蒜素对小鼠腹腔巨噬细胞吞噬中性红的影响
由图2可知,通过中性红吞噬实验法,检测大蒜素对LPS诱导的小鼠腹腔巨噬细胞吞噬功能的影响,当1 μg/mL LPS刺激小鼠腹腔巨噬细胞时,与正常对照组比较,LPS组巨噬细胞吞噬中性红的能力极显著增加(P<0.01),表明LPS能增加巨噬细胞吞噬功能。与LPS组比较,大蒜素处理组和地塞米松组小鼠腹腔巨噬细胞吞噬中性红的能力增加,其中大蒜素(40 μg/mL)处理组与LPS组之间比较差异不显著(P>0.05),其他各处理组均极显著高于LPS组(P<0.01),且呈良好的剂量-效应关系,表明大蒜素能有效的激活小鼠腹腔巨噬细胞,从而增强小鼠腹腔巨噬细胞吞噬能力。
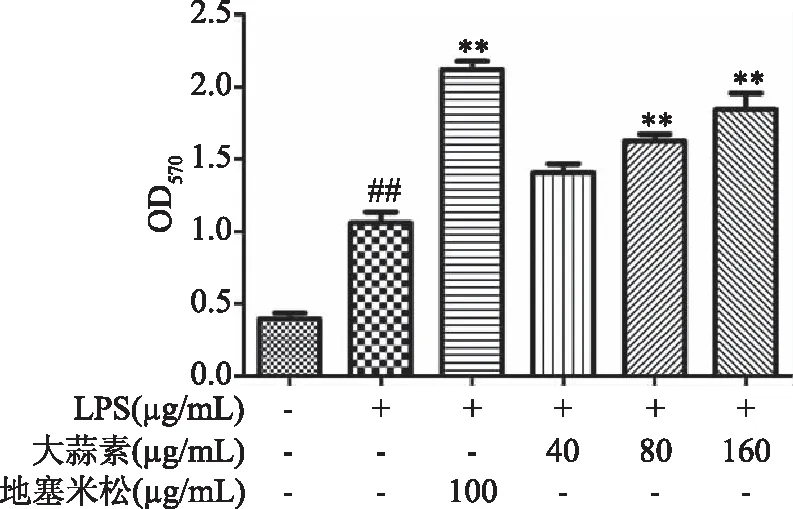
图2 大蒜素对小鼠腹腔巨噬细胞中性红吞噬能力的影响Fig.2 The effect of allicin on neutral red phagocytic capacity of mouse peritoneal macrophages注:与正常对照组比较,##表示差异极显著P<0.01;与LPS组比较,*表示差异显著P<0.05,**表示差异极显著P<0.01;图2~图8、图10~图12同。
2.3 大蒜素对LPS诱导的小鼠腹腔巨噬细胞产生COX-2酶活性、NO和IL-6分泌的影响
在体外细胞炎症模型制作中,LPS是最主要、作用最强的促炎手段[18]。在炎性因素影响下COX-2及其产物前列腺素E2(PGE2)可被迅速诱导合成,促进炎症反应的发生和发展[18]。一氧化氮(NO)是介导炎症反应的关键因子,在炎症的各个阶段均有产生[19]。小鼠腹腔巨噬细胞在LPS的诱导下释放大量的促炎因子,如IL-6的累积会加剧炎症反应进程。
由图3~图5可知,当用1 μg/mL的LPS刺激细胞时,与正常对照组比较,LPS组的COX-2酶活性、NO和IL-6分泌极显著增加(P<0.01),说明LPS刺激腹腔巨噬细胞造模成功。与LPS组比较,地塞米松处理组小鼠腹腔巨噬细胞COX-2酶活性与NO和IL-6的分泌极显著降低(P<0.01);大蒜素40 μg/mL浓度组与LPS组比较COX-2酶活性、NO和IL-6分泌显著降低(P<0.05),其他各处理组与LPS组比较均极显著降低(P<0.01),且在大蒜素浓度为160 μg/mL时,NO和COX-2的抑制活性高于地塞米松组,但差异不显著(P>0.05)。
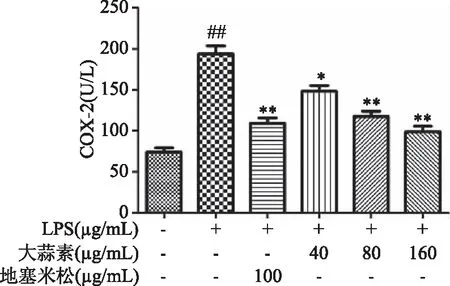
图3 大蒜素对LPS诱导的小鼠腹腔巨噬细胞中COX-2酶活性的影响Fig.3 Effect of allicin on COX-2 enzyme activity of LPS-induced mouse peritoneal macrophages
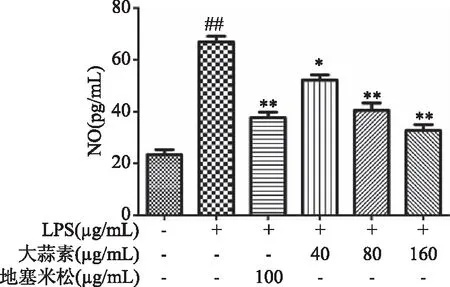
图4 大蒜素对LPS诱导的小鼠腹腔巨噬细胞中NO分泌的影响Fig.4 Effect of allicin on NO secretion of LPS-induced mouse peritoneal macrophages
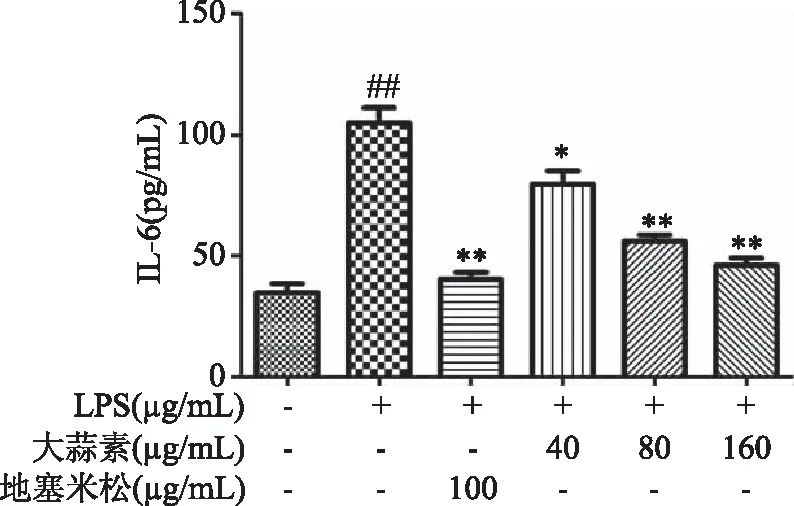
图5 大蒜素对LPS诱导的小鼠腹腔巨噬细胞中IL-6分泌的影响Fig.5 The effect of allicin on IL-6 secretion of LPS-induced mouse peritoneal macrophages
2.4 大蒜素对LPS诱导的小鼠腹腔巨噬细胞COX-2、iNOS和IL-6 mRNA表达的影响
在病理状态下,NO可以通过NO/cGMP路径上调COX-2的表达,NO由诱导型一氧化氮合酶(iNOS)经一系列氧化还原反应生成,在由LPS诱导的巨噬细胞炎症中,诱导型iNOS表达增高由iNOS衍生的过量NO诱导的硝化应激会引起过度炎症反应,加重炎症的发生[20]。同时,COX-2也促进iNOS的表达,共同参与炎症的发生、发展[21]。IL-6原被确定为B细胞生长因子[22],IL-6在急性炎症反应中的作用主要表现为对多种细胞的促炎作用和诱导肝组织产生急性反应蛋白。
由图6、图8可知,小鼠腹腔巨噬细胞经LPS刺激后,与正常对照组比较,LPS能极显著提高小鼠腹腔巨噬细胞COX-2和IL-6 mRNA的表达(P<0.01)。与LPS组比较,大蒜素(40 μg/mL)处理组小鼠腹腔巨噬细胞COX-2和IL-6 mRNA表达水平显著降低(P<0.05),其他各处理组COX-2和IL-6 mRNA表达水平均极显著降低(P<0.01),且大蒜素浓度为160 μg/mL组对IL-6 mRNA转录抑制作用高于地塞米松组,但差异不显著(P>0.05)。由图7可知,LPS能极显著提高iNOS mRNA表达(P<0.01),大蒜素和地塞米松处理后均能极显著降低LPS诱导的iNOS mRNA 表达(P<0.01)。结果表明,大蒜素在LPS刺激的小鼠腹腔巨噬细胞中可以发挥保护和抑制作用。
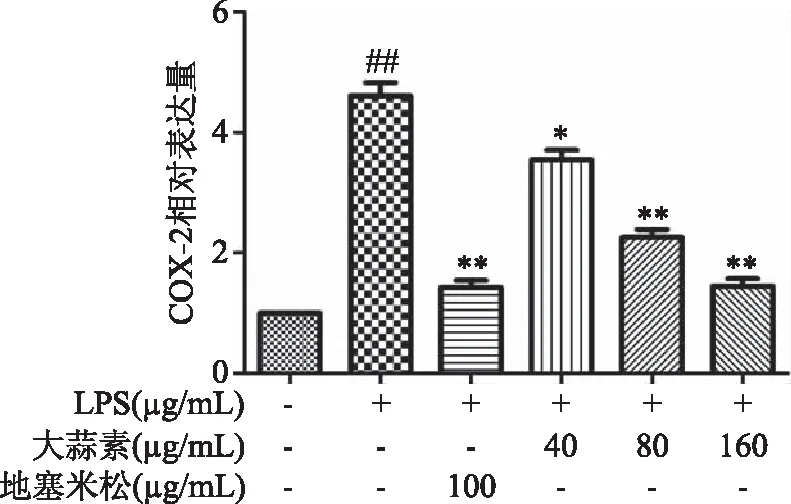
图6 大蒜素对LPS诱导的小鼠腹腔巨噬细胞中COX-2 mRNA表达水平的影响Fig.6 Effect of allicin on the mRNA expression level of COX-2 in LPS-induced mouse peritoneal macrophages
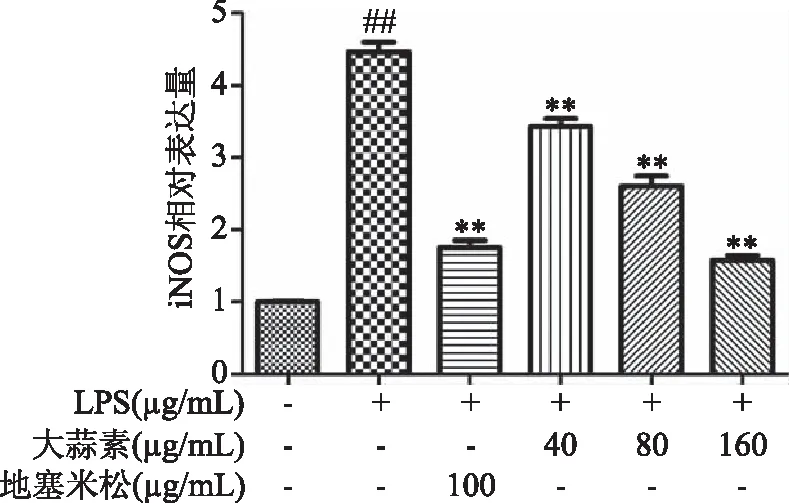
图7 大蒜素对LPS诱导的小鼠腹腔巨噬细胞中iNOS mRNA表达水平的影响Fig.7 Effect of allicin on the mRNA expression level of iNOS in LPS-induced mouse peritoneal macrophages
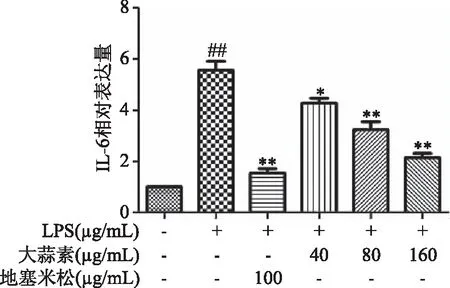
图8 大蒜素对LPS诱导的小鼠腹腔巨噬细胞中IL-6 mRNA表达水平的影响Fig.8 Effect of allicin on the mRNA expression level of IL-6 in LPS-induced mouse peritoneal macrophages
2.5 大蒜素对LPS诱导的小鼠腹腔巨噬细胞COX-2、iNOS和IL-6蛋白表达以及NF-κB p65磷酸化的影响
NF-κB是LPS刺激的反应中至关重要的下游信号途径,与肿瘤的生长和炎症有关[23]。NF-κB是真核细胞中的典型转录因子,参与炎症、免疫反应和抗凋亡机制,炎症细胞因子的产生受NF-κB信号通路的调节,LPS能诱导NF-κB信号通路的激活[24]。当NF-κB被激活时,活性的P65被转运到细胞核中以结合到促炎基因,这可以触发在LPS诱导的巨噬细胞的炎症反应,如促炎性酶如COX-2、iNOS及促炎细胞因子IL-6。
由图10可知,与正常对照组比较,LPS组小鼠腹腔巨噬细胞COX-2蛋白表达极显著增加(P<0.01),表明LPS刺激巨噬细胞造模成功。与LPS组比较,大蒜素处理组和地塞米松组小鼠腹腔巨噬细胞COX-2蛋白表达均显著降低,并随着大蒜素浓度的增加,COX-2蛋白表达逐渐降低,其中大蒜素(40 μg/mL)处理组与LPS组比较差距显著(P<0.05),其他各处理组及地塞米松组均极显著低于LPS组(P<0.01)。由图11~图13可知,LPS组小鼠腹腔巨噬细胞iNOS和IL-6的蛋白表达以及NF-κB p65磷酸化程度均极显著增加(P<0.01)。大蒜素各处理组与地塞米松组小鼠腹腔巨噬细胞iNOS和IL-6的蛋白表达以及NF-κB p65磷酸化程度均极显著降低(P<0.01),且都呈浓度依赖性。结果表明,大蒜素和地塞米松均能够显著抑制炎症因子COX-2、iNOS和IL-6的蛋白表达,也能显著抑制NF-κB p65发生磷酸化作用,抑制NF-κB信号通路的激活。
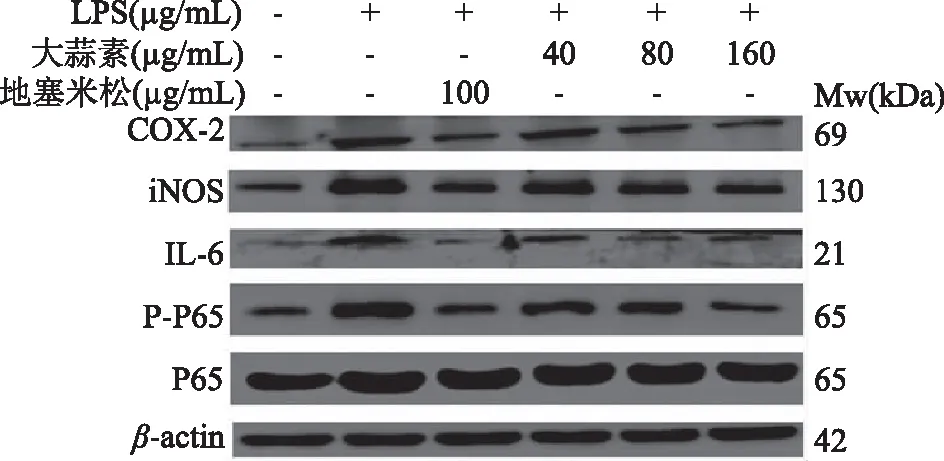
图9 大蒜素对LPS诱导的小鼠腹腔巨噬细胞中COX-2、iNOS、IL-6、P-P65和P65影响的蛋白表达电泳图Fig.9 Electrophoresis of allicin on the protein expression COX-2,iNOS,IL-6,P-P65 and P65 in LPS-induced mouse peritoneal macrophages
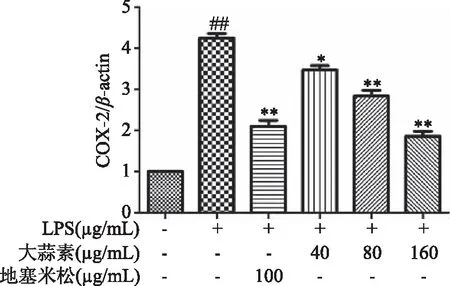
图10 大蒜素对LPS诱导的小鼠腹腔巨噬细胞中COX-2蛋白表达的影响Fig.10 Effect of allicin on the protein expression COX-2 in LPS-induced mouse peritoneal macrophages
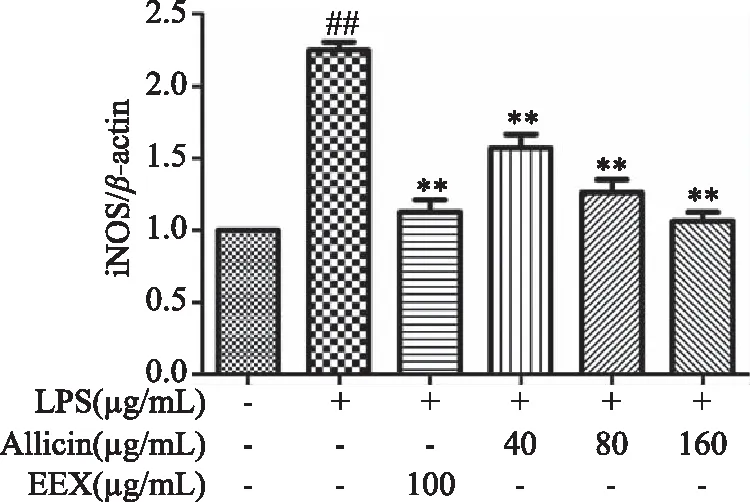
图11 大蒜素对LPS诱导的小鼠腹腔巨噬细胞中iNOS蛋白表达的影响Fig.11 Effect of allicin on the protein expression iNOS in LPS-induced mouse peritoneal macrophages
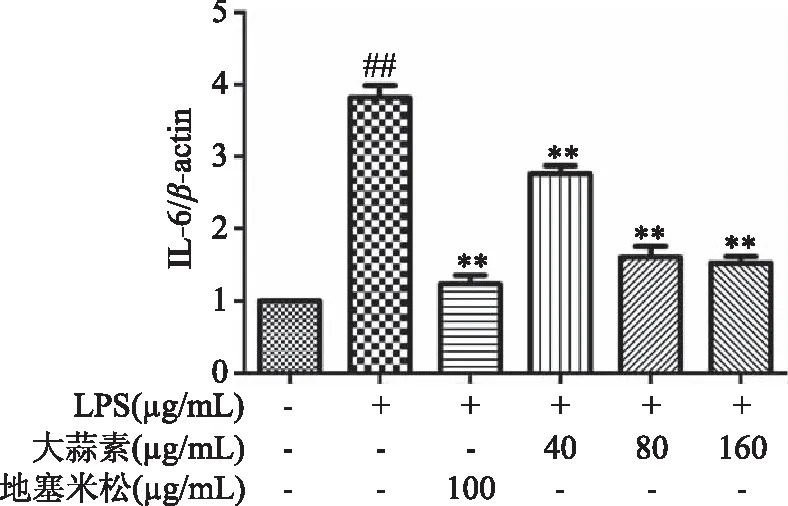
图12 大蒜素对LPS诱导的小鼠腹腔巨噬细胞中IL-6蛋白表达的影响Fig.12 Effect of allicin on the protein expression IL-6 in LPS-induced mouse peritoneal macrophages
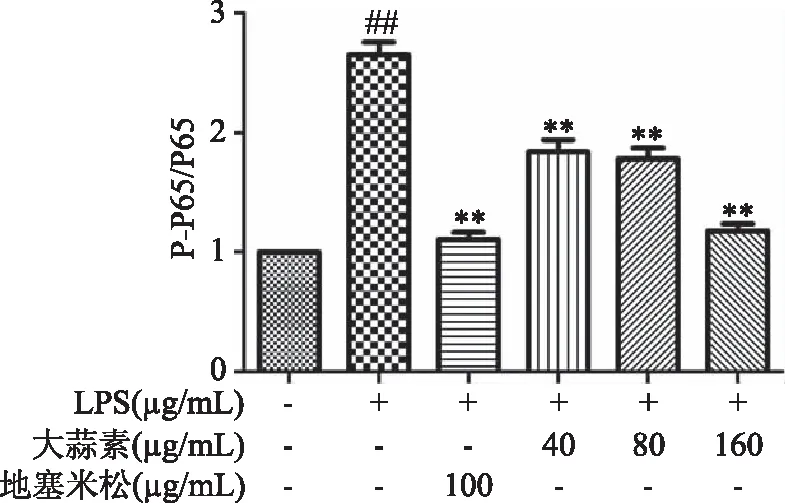
图13 大蒜素对LPS诱导的小鼠腹腔巨噬细胞中NF-κB p65磷酸化的影响Fig.13 Effect of allicin on NF-κB p65 Phosphorylation in LPS-induced mouse peritoneal macrophages
3 结论
本研究结果发现,大蒜素作用于小鼠腹腔巨噬细胞后,细胞生长状态良好,在一定剂量范围内,MTT测定证实其无细胞毒性;中性红吞噬实验表明大蒜素能提高巨噬细胞的吞噬能力;通过检测大蒜素作用后小鼠腹腔巨噬细胞的COX-2酶活性与NO和IL-6分泌降低,证实大蒜素具有抑制COX-2酶活性与NO和IL-6分泌的作用。同时大蒜素还能显著抑制小鼠腹腔巨噬细胞COX-2、iNOS和IL-6 mRNA和蛋白的相对表达,显著抑制NF-κB p65信号通路的磷酸化。表明大蒜素对LPS诱导的小鼠腹腔巨噬细胞的抗炎作用可能是通过抑制NF-κB信号通路激活途径来实现的。因此,本研究结果初步表明,大蒜素可能是治疗与巨噬细胞过度活化有关的各种炎性疾病的潜在药物。
