人乳头瘤病毒16型表位嵌合病毒样颗粒的构建及免疫原性研究
2020-09-22陈力源李玉华杨皓杰田一凡
郭 健,张 力,陈力源,李玉华,杨皓杰,田一凡,朱 洁, 刘 微
人乳头瘤病毒(human papillomavirus,HPV)感染是诱发女性宫颈癌的主要原因。已知发现的HPV亚型达200多种,其中HPV16和18型属于高危型中最易致癌型,超过70%的宫颈癌病变由此导致[1-3]。HPV疫苗是控制宫颈癌的有效手段之一。HPV的主要衣壳蛋白L1可以单独表达并自组装成病毒样颗粒(virus-like particles,VLPs)。VLPs与天然病毒的结构高度相似,将其免疫机体后可刺激产生高滴度的中和抗体,目前,利用VLPs研制的HPV预防性疫苗已用于临床。但是,此类疫苗诱导机体产生的细胞免疫应答较弱。HPV基因组的早期转录区(E区)编码的E7蛋白是导致细胞发生恶性转化的关键[4-5]。E749-57表位能诱导T淋巴细胞分化为细胞毒性T淋巴细胞(cytotoxicTMlymphocyte,CTL)[6]。本研究中将E749-57表位嵌合进L1后表达并组装形成VLPs,可以同时激发较强体液和细胞免疫应答,可使VLPs疫苗兼具预防和治疗双重功能。
1 材料与方法
1.1动物、试剂与仪器 Balb/c小鼠购自吉林大学白求恩医学院动物中心。293FT细胞由本实验室保藏;BamHI、XhoI内切酶,pET28a质粒购自TaKaRa公司;大肠杆菌BL21(DE3)、DH5感受态细胞购自北京鼎国生物技术有限公司;PVDF膜、ECL化学发光试剂盒、HRP标记山羊抗鼠IgG购自碧云天公司;鼠抗HPV16 L1单克隆抗体购自英国Abcam公司;DMEM、1640培养基购自美国GIBCO公司;质粒pShell16与pcDNA3.1-Luc+由吉林大学艾滋病疫苗重点实验室提供;Bright-GloTMLuciferase Assay system购自美国Promega公司;E749-57肽由上海生工公司合成;多因子流式分析试剂盒(LEGENDplexTMMouse Th1/Th2)购自美国BioLegend公司;其他试剂均为国产分析纯。纳米粒径电位分析仪Zetasizer Nano ZS90(Malvern, 英国);透射电子显微镜H-7650(Hitachi, 日本);AKTA蛋白纯化系统(GE, 美国);预装镍柱His Trap FF(GE-Healthcare, 美国);酶标仪(Bio-Rad, 美国);流式细胞仪C6(BD, 美国)。
1.2pET28a-16L1-E749-57重组质粒的构建 在蛋白质数据库(Protein Data Bank, PDB)获得HPV16 L1蛋白的高分辨率晶体结构作为模体,利用分子模拟软件Discovery Studio(version 2.1)分别于BC、DE、EF和HI环形区通过同源建模分析L1最佳的E749-57表位嵌合位点。在预测的HPV16 L1基因序列(GenBank,序列号: KU721788.1) 最佳嵌合位点处插入E749-57基因序列,运用http ://www.jcat. de/对序列进行优化,获得HPV16 L1-E749-57基因片段(上海捷瑞生物工程有限公司合成)。以合成的HPV16 L1-E749-57基因为模板进行PCR扩增。上游引物: 5′- CGCGGATCCATGCCGTCTGAAG-CGACC-3′, 下游引物: 5′-GGCG-AGCTCTTAG-TGATGGTGATGGTGATGAAA-TTTCGGTTT-AGCTTTCAG-3′。正确的扩增产物与pET28a载体双酶切连接(BamHI和XhoI),构建pET28a-16L1-E749-57重组表达质粒。转入大肠杆菌DH5,筛选阳性克隆并提取质粒进行测序。
1.3HPV16L1-E749-57蛋白的诱导表达及纯化 将阳性克隆质粒转入大肠杆菌BL21(DE3),接种于LB液体培养基中(含卡那霉素50 μg/mL),37 ℃、180 r/min震荡培养。0.2 mmol/L的IPTG,16 ℃条件下诱导过夜。向收集的菌体沉淀中以1∶10加binding buffer,冰浴超声15 min。分别收集上清和沉淀进行SDS-PAGE电泳,鉴定目的蛋白的表达及可溶性。将上清液经镍柱HisTrap FF亲和层析,以Elution buffer(20 mmmol/L NaH2PO3, 150 mmol/L NaCl, 300 mmol/L咪唑,pH=7.4)洗脱蛋白,SDS-PAGE电泳鉴定蛋白纯化结果。
1.4Western blot 鉴定HPV16L1-E749-57重组蛋白
HPV16L1-E749-57蛋白经SDS-PAGE电泳分离后,利用半干转法转印到PVDF膜上,条件为20 V、30 min。转印后的PVDF膜用5%脱脂奶粉室温封闭1 h。分别用HPV16 L1单克隆抗体作为一抗(1∶3 000)、HRP标记山羊抗鼠IgG作为二抗(1∶10 000)与PVDF膜37 ℃孵育1 h,ECL发光显色分析免疫印迹,检测HPV16L1-E749-57蛋白表达是否正确。
1.5E749-57嵌合VLPs的组装及纯化 向纯化的HPV16L1-E749-57蛋白中加入终浓度为10 mmol/L的DTT,4 ℃下充分作用2 h。用透析管透析72 h,待其自组装为E749-57嵌合VLPs。于30%(w/w)蔗糖/PBS层上缓慢加入自组装完毕的E749-57嵌合VLPs混合液,27 000 r/min 4 ℃离心3 h,取沉淀(小黄色圆斑样物质)加1 mL PBS重悬。将重悬液缓慢沿管壁加入10 mL的29% CsCl溶液中,35 000 r/ min、4 ℃离心20 h后收集沉淀。
1.6E749-57嵌合VLPs的形态学表征
1.6.1粒径分析 用0.22 μm 滤膜过滤嵌合VLPs样品后,通过 Malvern Zetasizer Nano ZS90 纳米粒径电位分析仪检测病毒样颗粒的粒径大小,Zetasizer Software软件分析数据。
1.6.2电镜观察 将样品滴于喷炭的铜网上,静置5 min,再滴加2%磷钨酸钾染色,静置5 min,自然半干固定。设定透射电镜放大倍率为50 000倍,电压80 kV,观察样品颗粒形态。
1.7E749-57嵌合VLPs的免疫原性的检测
1.7.1假病毒的包装与滴度检测 将结构基因表达质粒pShell16与荧光蛋白报告质粒pcDNA3.1-Luc+共转染1×107个293FT细胞,转染比例为1∶4。37 ℃孵育6 h后更换新鲜的DMEM完全培养基,继续培养40 h。收集细胞,加等体积裂解液,37 ℃继续培养16 h后,加入NaCl溶液至终浓度0.85 mmol/L。将混合物冰浴20 min, 12 000 r/min、4 ℃离心收集上清,用0.45 μm滤器过滤后分装,-80 ℃保存备用。将假病毒作10倍稀释,6个梯度,每个稀释度加4孔,每孔100 μL于96孔板中。将293FT细胞铺于96孔板,每孔细胞数3×104个/100 μL,与假病毒稀释液混匀。孵育72 h后,每孔取50 μL培养液,加等体积 Bright-GloTMLuciferase Assay试剂,作用5 min,酶标仪检测荧光素酶活性值,以10倍空白对照组为cutoff值,采用Reed-Muench法计算假病毒滴度(CCID50)。
1.7.2免疫血清中和试验 将24只Balb/c小鼠均分为3组,依次为E749-57嵌合VLPs组、野生型HPV16 VLPs组和PBS组,以Al(OH)3为佐剂。在第0、2、4周对小鼠进行腹腔注射免疫。在第0、1、2、3、4、6周尾静脉采血,收集血清,-80 ℃保存备用。将293FT细胞铺于96孔板,每孔细胞数3×104个/100 μL。将待测血清做4倍倍比稀释(初始稀释度为1∶20)。稀释血清和假病毒(400 CCID50/50 μL)各60 μL混合,冰浴1 h后,取混合物100 μL加入细胞板中,孵育72 h,计算假病毒滴度(方法同1.7.1)。
1.7.3Th1和Th2型细胞因子检测 二免后3周后,分离各组小鼠脾脏。将脾脏置于200目筛网上并浸泡淋巴细胞分离液,注射器活塞研磨。将细胞悬液移至15 mL离心管,缓慢加入1 mL预冷的1640培养液,2 000 r/min离心10 min。取淡白色淋巴细胞层,2 000 r/min离心5 min收集淋巴细胞,加5 mL预冷的红细胞裂解液,混匀后室温放置2 min,离心收集沉淀,加预冷的1640培养液重悬,离心收集细胞沉淀。用PBS清洗细胞2次,并调整细胞浓度为5×105个/100 μL。向细胞培养液内加E749-57肽5 μg/mL,37 ℃、5% CO2条件下刺激培养细胞24 h。按照流式多因子分析试剂盒说明书操作,流式细胞仪检测Th1和Th2型细胞因子情况,利用BioLegend LEGENDplexTM软件分析流式数据,得出所测细胞因子浓度值。
1.8统计分析 采用SPSS 22.0 对数据进行统计描述和分析。组间差异比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1HPV16 L1最佳E749-57嵌合位点预测 通过分子模拟软件Discovery Studio(version 2.1)同源模拟后确定HPV16 L1的HI loop区355/356为最佳表位嵌合位点(图1)。

A: The virtual structure of E749-57 chimeric L1 monomer; B: The virtual structure of E749-57 chimeric L1 pentamer图1 最佳嵌合位点预测Fig.1 Prediction of the optimal chimeric site
2.2pET28a-16L1-E749-57重组质粒的构建 pET28a-16L1-E749-57重组质粒经PCR鉴定,得到目的基因条带为1 400 bp,与预期结果一致(图2)。将质粒进行核酸测序,结果显示序列正确。

M: DNA Marker; 1: pET28a-16L1-E749-57 plasmid; 2: PCR product图2 pET28a-16L1-E749-57重组质粒PCR鉴定Fig.2 Identification of recombinant plasmid pET28a-16L1-E749-57 by PCR
2.3HPV16L1-E749-57蛋白的诱导表达 重组菌经IPTG诱导后表达HPV16L1-E749-57蛋白。将诱导菌体的上清和沉淀分别用SDS-PAGE电泳鉴定。结果如图3,诱导后在55 kD处可见特异性条带,表明蛋白诱导表达成功。检测诱导后超声破碎菌体后的上清与沉淀中均含有目的蛋白,且在上清中浓度较高,初步判断目的蛋白为可溶性蛋白(图4)。

M: Protein marker; 1: Before induction; 2: After induction图3 HPV16L1-E749-57蛋白表达的SDS-PAGE分析Fig.3 SDS-PAGE analysis of HPV16L1-E749-57 protein

M: Protein marker; 1 and 3: Precipitation of broken bacteria; 2 and 4: Supernatant of broken bacteria图4 HPV16L1-E749-57蛋白可溶性鉴定Fig.4 Identification about solubility of HPV16L1-E749-57 protein
2.4HPV16L1-E749-57蛋白的纯化 收集重组菌诱导表达后的上清液,经镍柱His Trap FF亲和层析,收集洗脱流分。SDS-PAGE电泳(图5),结果显示经镍柱纯化后得到较高纯度目的蛋白。蛋白免疫印迹(Western blot)(图6)显示在55 kD处出现目的斑带,证明目的蛋白表达正确。
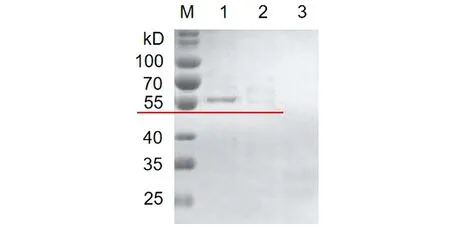
M: Protein marker; 1, 2, 3: 1 to 3 eluted fraction with 300 mmol/L imidazole图5 HPV16L1-E749-57蛋白纯化的SDS-PAGE分析Fig.5 SDS-PAGE analysis of HPV16L1-E749-57 protein

M: Protein marker; 1, 2, 3: HPV16L1-E749-57 protein图6 HPV16L1-E749-57蛋白纯化的Western blot分析Fig.6 Western blot analysis of HPV16L1-E749-57 protein
2.5E749-57嵌合VLPs的形态学表征 将体外组装后的E749-57嵌合VLPs进行动态光散射粒径分析和透射电镜检测,可观察到大量形态结构、直径(50~55 nm)与野生VLPs基本一致的球形颗粒,且粒径均一(图7,图8),说明HPV16L1-E749-57蛋白在体外成功自组装为VLPs。
2.6E749-57嵌合VLPs的免疫原性检测

图7 E749-57嵌合VLPs粒径分析Fig.7 Size distributions of cVLPs-E749-57
2.6.1假病毒滴度及中和试验 采用Reed-Muench法计算CCID50来表示假病毒滴度。结果显示假病毒的滴度为105.9/100 μL。
以400 CCID50/50 μL假病毒接种量测阳性血清中和滴度。初次免疫后E749-57嵌合VLPs组小鼠血清中和抗体滴度log10平均值为2.63;随着第2、3次免疫,中和抗体滴度明显升高,第6周时log10平均值达到4.23。野生型HPV16 VLPs组小鼠在初次免疫后血清中和抗体滴度log10平均值为3.17, 加强免疫后,第6周时log10平均值达到4.45。E749-57嵌合VLPs组中和抗体滴度较野生型HPV16 VLPs组略低(χ2=7.575,P<0.05)(图9)。

图9 免疫血清中和试验Fig.9 Neutralization test of serum samples
2.6.2Th1和Th2型细胞因子检测 小鼠脾脏淋巴细胞经E749-57肽体外刺激后,用流式多因子法检测Th细胞分泌细胞因子情况。结果如图10所示,E749-57嵌合VLPs能刺激小鼠分泌高水平的 Th1型细胞因子(INF-γ, IL-2, TNF-α), 与野生型HPV16 VLPs相比具有明显的统计学差异(χ2=7.410、4.333、8.308,P均<0.05),提示E749-57嵌合VLPs能刺激小鼠产生较强的细胞免疫应答。同时,E749-57嵌合VLPs刺激小鼠分泌的Th2型细胞因子水平与野生型HPV16 VLPs组相似(IL-5, IL-10),而野生型HPV16 VLPs组刺激小鼠分泌的IL- 4的含量更高一些。


*P<0.05, **P<0.01, ***P<0.001图10 Th1和Th2型细胞因子水平检测Fig.10 Levels of Th1 and Th2 cytokines
3 讨 论
宫颈癌是女性最常见的恶性肿瘤之一,发病率居女性恶性肿瘤第2位,且发病逐渐趋于年轻化[7-9]。据世卫组织报道,2018年全球宫颈癌新发病例57万,死亡人数31.1万[10], 严重危害女性健康。目前宫颈癌预防性疫苗的研究较成功,国际上市的HPV疫苗分别是默沙东公司生产的四价疫苗佳达修-4 (Gardasil-4)和九价疫苗佳达修-9(Gardasil-9),及葛兰素史克公司的二价疫苗希瑞适(Cervarix),3种疫苗均是以体外表达的HPV L1衣壳蛋白自组装成VLPs为有效抗原,混合佐剂诱导机体产生中和抗体。此类疫苗能有效预防高危型HPV病毒感染,但对已经感染HPV的人群无效[11-12]。
为了使疫苗具有治疗功能,HPV E7基因成为近年来国际上的研究热点[13-14]。E7蛋白作为高危型(HPV16、18、31、45)早期致癌蛋白,能干扰宿主细胞正常周期,诱导细胞无限增殖最终进展为癌症[15-16]。E7蛋白在宫颈癌及癌前病变组织中持续表达,是肿瘤特异性抗原,因此成为免疫治疗的理想靶标[17-18]。但全长E7蛋白仍有转化活性,不能直接应用到疫苗中[19],而将优势表位E749-57(短肽)作为抗原递送至患者体内,既能保证疫苗安全,又能有效激活细胞免疫应答,特异性杀伤表达E7蛋白的肿瘤细胞,起到免疫治疗作用[20]。国内外学者对此已展开研究: Liu WJ等[21]利用昆虫细胞表达牛乳头瘤病毒1型(bovine papillomavirus type 1, BPV1)L1嵌合E749-57蛋白(插入多个表位取代L1的C末端23个氨基酸); Monroy-García A等[22]利用番茄表达HPV16 L1嵌合E749-57蛋白(插入多个表位取代L1的C末端34个氨基酸),形成的嵌合VLPs均可刺激小鼠产生E749-57表位特异性CTL。褚晓杰[23]将E749-57表位与乙肝核核心抗原(HBcAg)嵌合,制备的HBcAg -VLPs能够激发持续有效的特异细胞免疫应答并显著抑制肿瘤生长。这些研究共同揭示了E749-57表位嵌合型VLPs成为治疗性疫苗载体的潜力。
在本研究中,通过同源模拟分析HPV16 L1 环形区最佳嵌合位点。该方法利用生物信息学的手段,可以直接从蛋白的一级结构预测蛋白质的高级结构。所有的建模方法中,以同源建模法应用最为广泛,预测结果的准确性最大[24-25]。我们以已知的天然HPV VLPs的结构为模体,预测表位嵌入后顺利组装成VLPs的可能结构,最终确定HI loop区355/356为最佳嵌入点。将优势CTL表位E749-57嵌入该位点,形成的VLPs粒径均一,形态饱满,稳定性好,与野生型VLPs相似度高,这样的结构对激发机体免疫应答极为重要。构建HPV16 L1- E749-57基因突变体后利用大肠杆菌进行表达,成本低廉,VLPs得率较高,这为疫苗的生产提供更大的可能性。
嵌合型VLPs免疫小鼠后,能激发小鼠体液免疫反应产生中和抗体,但是与野生组比较中和抗体滴度偏低;对细胞因子水平检测则发现嵌合组的IL-4(Th2型)细胞因子水平也略低于野生组。此前报道显示,HPV主要中和抗体HPV16.V5的中和表位位于HPV16 L1的FG 和HI loop区,将表位插入HI loop区(352/353)致使嵌合后的VLPs免疫原性与野生型相比下降[26]。我们推测,在L1- E749-57嵌合过程中(插入位点355/356)一定程度上破坏了L1原有的中和表位的完整性,影响到体液免疫应答发生。但是嵌合型VLPs可以刺激小鼠产生较强的细胞免疫应答,使VLPs能够具备预防和治疗双重功效,这与我们的初衷是一致的。
人乳头瘤病毒16型表位嵌合病毒样颗粒(E749-57嵌合VLPs)的构建为宫颈癌治疗性疫苗的探索和研制提供重要基础,对于控制和治疗宫颈癌、保障女性健康有着重要意义。
利益冲突:无
