欧前胡素对小鼠急性肺损伤的影响及其机制研究
2020-09-21华俊萍王宋平
华俊萍,王宋平
(西南医科大学附属医院 呼吸一科,四川 泸州 646000)
急性肺损伤是由各种因素导致的急性弥漫性肺损伤,其特点是肺实质过度的急性炎症反应[1]。急性肺损伤发病率、病死率高,在全世界重症监护室其发病率约占10%,尽管近年对该疾病的研究有所进展,但大多数研究表明其病死率仍高达30%~40%[2-3]。目前该病的治疗重点是肺保护性通气,尚无特定的药物治疗该疾病[4]。因此迫切需要探索新的药物治疗急性肺损伤。
脂多糖是革兰阴性菌外膜的关键成分,是包括急性肺损伤在内的各种炎症疾病最常见的致病因素之一,常用于急性肺损伤模型的复制[4-5]。氧化应激是急性肺损伤的重要发病机制之一,脂多糖可诱导细胞内活性氧类(reactive oxygen species, ROS)的产生,进而产生大量肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)等细胞因子,对肺组织造成损伤[5]。ROS 是重要的调节因子,在急性肺损伤中起重要作用,通常被认为是激活下游信号级联而扩展炎症的次级信使[5-7]。因此,阻断ROS 的产生或作用可能对急性肺损伤等炎症疾病有治疗价值。
欧前胡素是呋喃香豆素的衍生物之一,存在于多种中药材中,具有抗炎、抗菌等多种生物活性,体内外有研究表明其对炎症疾病有保护作用[8-10]。欧前胡素在体内是否抑制脂多糖诱导的ROS,进而抑制磷脂酰肌醇3-激酶/蛋白激酶B/核转录因子κB(PI3K/Akt/NF-κB)通路对炎症疾病(如急性肺损伤等)起到保护作用尚未见报道。本研究通过脂多糖复制急性肺损伤模型,探究欧前胡素对急性肺损伤的影响,并探讨其可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物清洁级健康雌性BALB/c 小鼠32 只[动物室注册批文号: SCXK(湘)2016-0002],6 周龄,体重(20±2)g,购自重庆莱彼特生物科技有限公司,动物饲养及实验方案均严格按照西南医科大学动物伦理委员会动物实验规范执行。
1.1.2 主要实验试剂及仪器欧前胡素购自成都瑞芬思生物科技有限公司,脂多糖(LPS)、ROS 检测荧光探针DHE 购自上海Sigma 生物公司,髓过氧化物酶(MPO)试剂盒购自南京建成公司,小鼠IL-1β 和TNF-α ELISA 试剂盒购自武汉ELK Bio 公司,PI3K、磷酸化蛋白激酶B(p-Akt)、磷酸化核转录因子κB(p-NF-κB)、Akt、NF-κB 抗体购自上海CST 公司,磷酸化磷脂酰肌醇3-激酶(p-PI3K)、基质金属蛋白酶-9(MMP-9)抗体购自上海Abcam 公司,电泳仪购自北京市六一仪器厂,酶标仪购自山东Diatek 公司。
1.2 方法
1.2.1 急性肺损伤模型的复制健康雌性BALB/c小鼠32 只,喂养于12 h 明暗循环的清洁级动物房,可自由获取食物和水。适应性喂养2 周后,随机分为正常对照组(Control 组)、模型组(LPS 组)、欧前胡素30 mg/kg 组(LPS+IMP 30 mg/kg 组)欧前胡素60 mg/kg 组(LPS+IMP 60 mg/kg 组),每组8 只小鼠。参照文献[11]的方法复制急性肺损伤动物模型,LPS+IMP 30 mg/kg 组、LPS+IMP 60 mg/kg 组分别腹腔注射欧前胡素30 和60 mg/kg,Control 组、LPS 组腹腔注射相应体积3%二甲基亚砜溶液。1 h 后各组小鼠经腹腔注射水合氯醛(10%,4 mg/kg)[12]麻醉,LPS 组、LPS+IMP 30 mg/kg 组、LPS+IMP 60mg/kg 组小鼠经鼻滴入含10 μg 脂多糖的50 μl 磷酸盐缓冲液(PBS)中,Control 组小鼠经鼻滴入相应体积的PBS。
1.2.2 肺组织的采集模型复制7 h 后,脱臼处死各组小鼠,小鼠固定于手术板上,暴露胸腔无菌条件下迅速取出肺组织,并冷冻保存备用。
1.2.3 肺湿/干重比取左肺用滤纸擦干后置于玻璃试管中称重,获得肺组织湿重;然后将其放置在70℃的电热鼓风干燥箱中连续干燥、称重,直至肺组织重量不再变化,获得肺组织干重;计算肺湿重与干重之比,评价肺组织水肿。
1.2.4 肺组织病理学变化取小鼠右肺固定于4%多聚甲醛中,经脱水、石蜡包埋后进行4 μm 连续切片,行苏木精-伊红(HE)染色。参照文献[13]的方法进行小鼠肺组织病理损伤评分。
1.2.5 ROS 检测配置二甲基亚砜溶解ROS 检测荧光探针DHE 为5 mmol/L 的溶液,避光放置备用;使用前将溶液按照1 ∶1 000 稀释后备用;取冷冻保存的右肺组织切片;制片后,将稀释好的探针溶液滴加到组织,37℃孵育30 min;PBS 洗去多余探针溶液,抗荧光淬灭剂封片,荧光显微镜下观察并拍照。
1.2.6 MPO 活力检测取右肺组织制备肺组织匀浆,用MPO 测试盒检测MPO 活力,参照该试剂盒说明书分别取肺组织匀浆上清及相应试剂于对照管及测定管中混匀,37℃水浴30 min,再加入相应试剂混匀,60℃水浴10 min,取出后立即在波长460 nm 处测量各管的光密度(OD)值。MPO 活力(u/g 组织湿重)=(测定OD 值-对照OD 值)/[11.3×取样量(g)]。
1.2.7 TNF-α、IL-1β 含量检测取肺组织匀浆上清,采用酶联免疫吸附试验(ELISA)检测TNF-α、IL-1β 水平,按照ELISA 试剂盒说明书分别将100 μl稀释好的标准品与待测样品加入96 孔的聚乙烯板中,37℃孵育2 h,弃掉样品,加洗涤缓冲液洗涤3 次;分别在相应的96 孔板中每孔加入100 μl 生物素化的TNF-α、IL-1β 抗体工作液,37℃孵育1 h;分别在相应的96 孔板中每孔加入100 μl 链霉亲和素-辣根过氧化物酶,37℃孵育1 h;分别在相应的96 孔板中每孔加入90 μl 四甲基联苯胺底物稀释溶液,避光放置15 min;每孔加入50 μl 终止液;用酶标仪在波长450 nm 处测量OD 值;计算TNF-α、IL-1β 的浓度。
1.2.8 Western blotting采用Western blotting 检测p-PI3K、p-Akt、p-NF-κB、PI3K、Akt、NF-κB、MMP-9 蛋白水平,提取右肺组织总蛋白并检测蛋白浓度,然后电泳分离蛋白,转膜,加入一抗4℃封闭蛋白质过夜,第2 天弃去一抗,加入酶标羊抗兔二抗,滴加化学发光液,曝光显影。
1.3 统计学方法
数据分析采用SPSS 17.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步的两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 欧前胡素对脂多糖诱导的急性肺损伤小鼠肺湿/干重比的影响
各组小鼠肺湿/干重比比较,差异有统计学意义(P<0.05)。LPS组高于Control 组(P<0.05);LPS+IMP 30mg/kg 组、LPS+IMP 60mg/kg 组低于LPS 组(P<0.05);LPS+IMP 60mg/kg 组低于LPS+IMP 30mg/kg 组(P<0.05)。见表1。
2.2 欧前胡素对脂多糖诱导的急性肺损伤小鼠肺组织病理学变化的影响
Control组肺组织结构完整,肺泡壁未见明显充血,肺泡间隔内无水肿及炎症细胞浸润,肺泡腔清晰,无蛋白、炎症细胞浸润;与Control 组比较,LPS 组正常肺组织结构丧失,肺泡间隔增厚,可见水肿、充血及炎症细胞浸润,肺泡腔减少;LPS+IMP 30mg/kg 组、LPS+IMP 60mg/kg 组可见部分正常肺组织结构,肺泡间隔增厚,水肿、充血及炎症细胞浸润较LPS 组减轻,LPS+IMP 60mg/kg 组肺组织损伤较LPS+IMP 30mg/kg 组轻。各组肺组织损伤评分比较,差异有统计学意义(P<0.05)。LPS 组高于Control 组(P<0.05);LPS+IMP 30mg/kg 组、LPS+IMP 60mg/kg 组低于LPS组(P<0.05);LPS+IMP 60mg/kg 组 低 于LPS+IMP 30mg/kg 组(P<0.05)。见图1和表2。
表1 各组小鼠肺湿/干重比的比较 (%,±s)
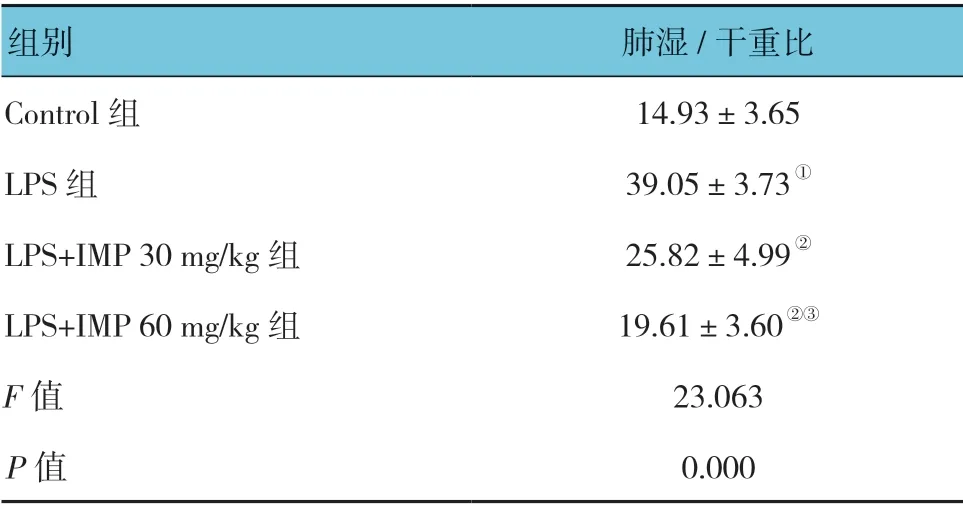
表1 各组小鼠肺湿/干重比的比较 (%,±s)
注: ①与Control 组比较,P <0.05;②与LPS 组比较,P <0.05;③与LPS+IMP 30 mg/kg 组比较,P <0.05。
组别 肺湿/干重比Control 组 14.93±3.65 LPS 组 39.05±3.73①LPS+IMP 30 mg/kg 组 25.82±4.99②LPS+IMP 60 mg/kg 组 19.61±3.60②③F 值 23.063 P 值 0.000
2.3 欧前胡素对脂多糖诱导的急性肺损伤小鼠肺组织ROS 相对荧光强度的影响
小鼠肺组织ROS 相对荧光强度各组比较,差异有统计学意义(P<0.05)。LPS 组肺组织较Control 组高(P<0.05);LPS+IMP 60mg/kg 组、LPS+IMP 30mg/kg组较LPS 组低(P<0.05);LPS+IMP 60mg/kg 组较LPS+IMP 30mg/kg 组低(P<0.05)。见图1和表2。
2.4 欧前胡素对脂多糖诱导的急性肺损伤小鼠肺组织MPO 的影响
各组小鼠肺组织MPO 活力比较,差异有统计学意义(P<0.05)。LPS 组较Control组高(P<0.05);LPS+IMP 30mg/kg 组较LPS 组低;LPS+IMP 60mg/kg 组较LPS 组低(P<0.05);LPS+IMP 60mg/kg组较LPS+IMP 30mg/kg 组低(P<0.05)。见表3。

图1 各组小鼠肺组织(HE 染色×200)与ROS 水平(HE 染色×400)
表2 各组小鼠肺组织损伤评分及ROS 相对荧光强度的比较 (±s)
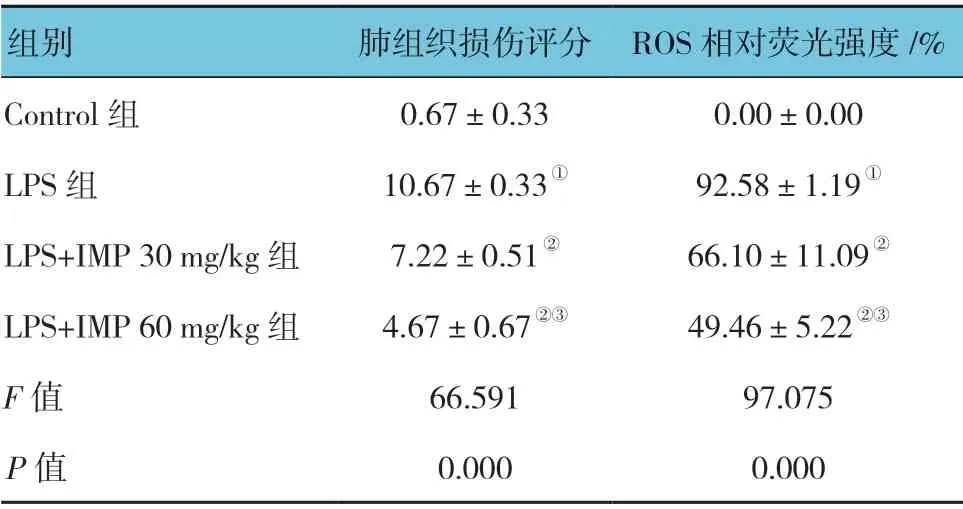
表2 各组小鼠肺组织损伤评分及ROS 相对荧光强度的比较 (±s)
注: ①与Control 组比较,P <0.05;②与LPS 组比较,P <0.05;③与LPS+IMP 30mg/kg 组比较,P <0.05。
组别 肺组织损伤评分 ROS 相对荧光强度/%Control 组 0.67±0.33 0.00±0.00 LPS 组 10.67±0.33① 92.58±1.19①LPS+IMP 30 mg/kg 组 7.22±0.51② 66.10±11.09②LPS+IMP 60 mg/kg 组 4.67±0.67②③ 49.46±5.22②③F 值 66.591 97.075 P 值 0.000 0.000
2.5 欧前胡素对脂多糖诱导的急性肺损伤小鼠肺组织IL-1、TNF-α 的影响
各组小鼠肺组织IL-1β、TNF-α 细胞因子水平比较,差异有统计学意义(P<0.05)。LPS 组较Control 组高(P<0.05);LPS+IMP 30mg/kg 组、LPS+IMP 60mg/kg组较LPS 组低(P<0.05);LPS+IMP 60mg/kg 组较LPS+IMP 30mg/kg 组低(P<0.05)。见表4。
2.6 欧前胡素抑制ROS 介导的PI3K/Akt/NF-κB通路活化及对MMP-9 蛋白表达的影响
各组小鼠肺组织中p-PI3K、p-Akt、p-NF-κB p65、MMP-9 蛋白表达水平比较,差异有统计学意义(P<0.05)。LPS 组较Control 组高(P<0.05);与LPS 组比 较,LPS+IMP 30mg/kg 组、LPS+IMP 60mg/kg 组 较低(P<0.05);LPS+IMP 60mg/kg 组较LPS+IMP30 mg/kg组低(P<0.05)(见表5)。各组间Akt、PI3K、NF-κB p65 蛋白表达水平无明显变化(见图2)。
表3 各组小鼠MPO 活力的比较 (±s)
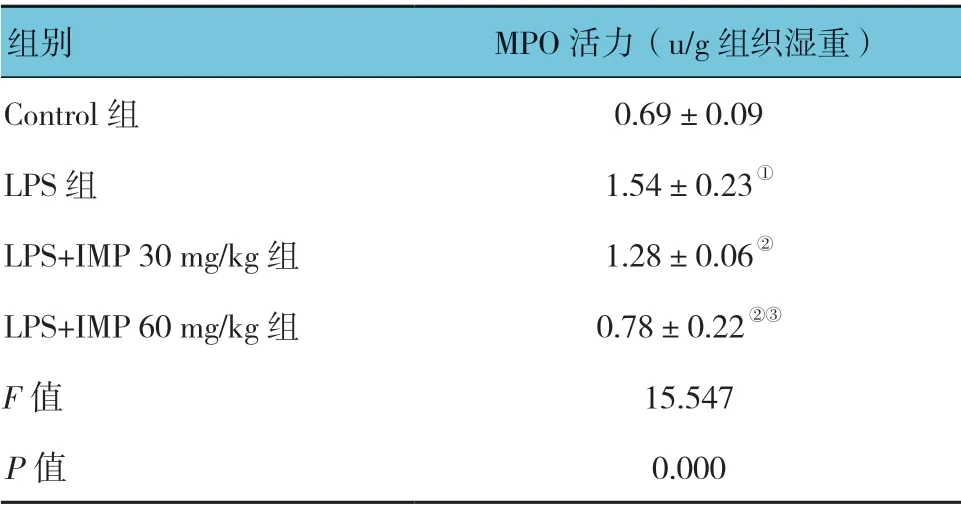
表3 各组小鼠MPO 活力的比较 (±s)
注: ①与Control 组比较,P <0.05;②与LPS 组比较,P <0.05;③与LPS+IMP 30 mg/kg 组比较,P <0.05。
组别 MPO 活力(u/g 组织湿重)Control 组 0.69±0.09 LPS 组 1.54±0.23①LPS+IMP 30 mg/kg 组 1.28±0.06②LPS+IMP 60 mg/kg 组 0.78±0.22②③F 值 15.547 P 值 0.000
表4 各组小鼠肺组织IL-1、TNF-α 水平的比较(pg/ml,±s)

表4 各组小鼠肺组织IL-1、TNF-α 水平的比较(pg/ml,±s)
注: ①与Control 组比较,P <0.05;②与LPS 组比较,P <0.05;③与LPS+IMP 30 mg/kg 组比较,P <0.05。
组别 IL-1β TNF-α Control 组 41.68±4.58 93.40±4.67 LPS 组 132.45±17.25① 226.71±31.99①LPS+IMP 30 mg/kg 组 76.80±15.11② 156.36±16.05②LPS+IMP 60 mg/kg 组 66.32±9.56②③ 125.31±7.08②③F 值 25.573 26.345 P 值 0.000 0.000
表5 各组小鼠p-PI3K、p-Akt、p-NF-κB p65、MMP-9 蛋白表达水平的比较 (±s)

表5 各组小鼠p-PI3K、p-Akt、p-NF-κB p65、MMP-9 蛋白表达水平的比较 (±s)
注: ①与Control 组比较,P <0.05;②与LPS 组比较P <0.05;③与LPS+IMP 30 mg/kg 组比较,P <0.05。
组别 p-PI3K p-Akt p-NF-κB p65 MMP-9 Control 组 0.05±0.00 0.04±0.00 0.04±0.01 0.07±0.03 LPS 组 0.64±0.16① 0.40±0.06① 0.62±0.10① 0.58±0.08①LPS+IMP 30mg/kg 组 0.43±0.06② 0.23±0.01② 0.39±0.02② 0.31±0.06②LPS+IMP 60mg/kg 组 0.15±0.08②③ 0.08±0.03②③ 0.16±0.02②④ 0.14±0.01②③F 值 19.922 42.573 60.740 49.247 P 值 0.000 0.000 0.000 0.000
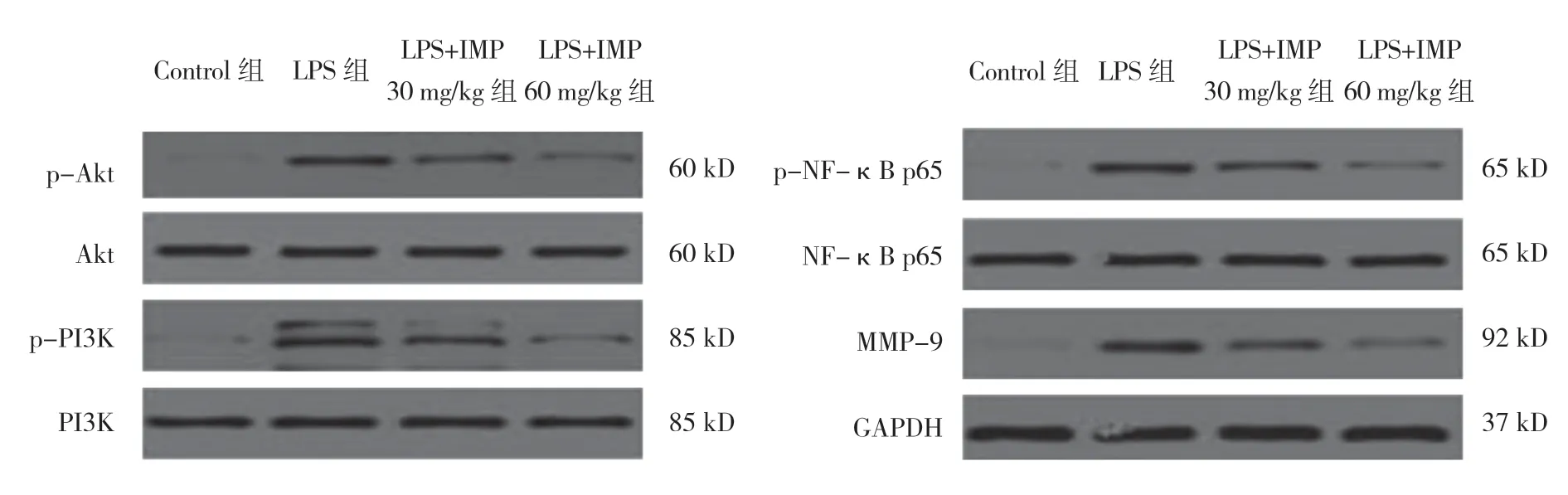
图2 各组小鼠肺组织中p-PI3K、p-Akt、p-NF-κB p65、MMP-9 蛋白表达水平情况
3 讨论
急性肺损伤是由各种肺内外致病因素引起的危及生命的疾病,肺部过度急性弥漫性炎症反应是其主要特点,导致肺泡上皮和内皮屏障功能障碍,弥漫性肺泡损伤,肺泡腔渗出富含蛋白质的液体,肺泡出血,肺水肿,进而肺容积减少,肺顺应性降低等[14]。本研究结果显示,LPS 组肺湿/干重比高于Control 组,提示肺水肿,HE 染色示LPS 组正常肺组织结构丧失,肺泡间隔增厚,充血及炎细胞浸润,肺泡腔减少,支气管腔内见蛋白及炎症细胞浸润,提示急性肺损伤[15],而欧前胡素预处理上述病理变化有所减轻,表现出对脂多糖诱导的急性肺损伤有保护作用,且欧前胡素高剂量组效果优于低剂量组。中性粒细胞浸润是急性肺损伤的特征之一,其可通过脱颗粒释放出杀菌蛋白,同时释放细胞因子、ROS,以及中性粒细胞外陷阱的产生对疾病的发生、发展起重要作用。MPO 由中性粒细胞分泌,可用于评估中性粒细胞在肺组织中的积聚[16-17]。本研究显示脂多糖刺激使急性肺损伤小鼠肺组织中MPO 活力升高,中性粒细胞在肺组织中大量积聚,而欧前胡素预处理使MPO 活力降低,中性粒细胞在肺组织中积聚减少,且欧前胡素剂量高者优于剂量低者。
基质金属蛋白酶是一组锌依赖的内肽酶,参与急性肺损伤的发生,MMP-9 属于明胶酶亚类,MMP-9 是已知的降解细胞外基质的主要成分。MMP-9 从活化的中性粒细胞中释放,其可降解细胞外基质的主要成分,包括细胞间连接蛋白、基底膜和将细胞锚定在基底膜上的蛋白质,从而增加肺泡毛细血管通透性,介导炎症细胞向肺泡间隙的迁移,蛋白渗漏,肺组织细胞外间隙含水量增加,导致肺结构的广泛改变,其还可活化细胞因子、趋化因子等,最终放大气道炎症。有研究显示减低MMP-9 对急性肺损伤有保护作用[16,18-20]。TNF-α、IL-1β 等在急性肺损伤中起重要作用,可启动、放大和维持急性肺损伤的炎症反应[16]。据报道,IL-1β 可引起促炎细胞因子和趋化因子产生,炎症细胞聚集,减少上皮钠通道,改变内皮-上皮屏障通透性和液体运输,导致肺水肿等造成急性肺损伤[21-22]。TNF-α 是炎症反应的主要调节因子,失调的TNF-α信号使细胞发生氧化应激、坏死及凋亡,刺激白细胞在损伤和感染部位的积累、增殖和分化,激活组织中性粒细胞及巨噬细胞,该活化的炎症细胞又可分泌TNF-α 和其他促炎细胞因子,趋化因子等造成急性肺损伤[6,23]。本研究显示,脂多糖刺激使MMP-9 蛋白表达水平升高,小鼠肺组织中TNF-α、IL-1β 水平升高,而欧前胡素预处理使MMP-9 蛋白表达水平降低,TNF-α、IL-1β 的释放减少,LPS+IMP 60 mg/kg组效果优于LPS+IMP 30 mg/kg 组。表明欧前胡素对脂多糖诱导的急性肺损伤的保护作用可能与降低MMP-9 蛋白表达及减少TNF-α、IL-1β 的释放,进而减轻肺组织水肿、蛋白渗出、炎症细胞的迁移积聚,减少细胞因子等的释放活化有关。
ROS 包括羟基自由基、超氧物和过氧化氢氧自由基,主要由还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶参与产生[24]。ROS 在炎性疾病中,尤其是急性肺损伤中起重要的作用,是扩展炎症的次级信使[5]。ROS 还可介导PI3K/Akt/NF-κB 通路激活增加炎症细胞因子等的释放[5,10]。PI3K/Akt 通路是炎症反应的重要信号级联,是NF-κB 的上游分子,可使NF-κB 激活[25-27]。有研究显示抑制PI3K/Akt 的磷酸化,对急性肺损伤有保护作用[5,28]。NF-κB 在炎症的调控中起着关键作用[26,29],NF-κB家族包括NF-κB1(p105/p50)、NFκB1(p100/p52)、RelA(p65)、c-Rel 和RelB,其都包含有介导二聚化,DNA 结合,核定位的Rel 同源结构域,仅RelA(p65)、c-Rel 和RelB 包含有靶基因表达所必需的转录激活结构域,NF-κB 家族中的各成员间可以彼此缔合成各种异二聚体和同二聚体[10]。NF-κB 常由p50/p65 亚基组成,调控炎症反应[5]。RelA(p65)的核易位使炎症细胞因子等基因表达[1],从而导致TNF-α、IL-1β 等细胞因子的生成及MMP-9 蛋白的表达。该研究显示,欧前胡素预处理可使脂多糖诱导的急性肺损伤小鼠肺组织中ROS 水平降低,PI3K/Akt/NF-κB 通路磷酸化水平降低,有体外研究表明欧前胡素可抑制ROS 介导的PI3K/Akt/NF-κB 通路激活[10],表明欧前胡素可能是通过阻断脂多糖诱导的急性肺损伤中的ROS,以及阻断ROS介导的PI3K/Akt/NF-κB 通路激活有关,对急性肺损伤表现出保护作用。而TNF-α、IL-1β 对TNF-α、IL-1β 起正反馈作用,使NF-κB 激活增加,进一步促进细胞因子的释放,从而放大炎症反应[30]。该研究表明,欧前胡素预处理可减低细胞因子TNF-α、IL-1β 等的释放,从而减少其对NF-κB 的正反馈作用,减少细胞因子的进一步增加,减少炎症反应的瀑布效应,对急性肺损伤起保护作用。
综上所述,与Control 组比较,LPS 组脂多糖刺激可致急性肺损伤,使肺组织水肿,肺泡完整性破坏,蛋白及炎症细胞渗出,中性粒细胞浸润,肺泡腔减少,并使细胞因子TNF-α、IL-1β 的释放增加,MMP-9的表达水平升高,提高ROS 水平,提高PI3K、Akt、NF-κB p65 的磷酸化;而欧前胡素预处理可使脂多糖诱导的急性肺损伤小鼠肺组织中ROS 水平降低,降低PI3K、AKT、NF-κB p65 的磷酸化,减少细胞因子TNF-α、IL-1β 的释放,降低MMP-9 的表达水平,从而减轻肺水肿,减轻中性粒细胞浸润,减轻肺组织病理变化,减轻小鼠急性肺损伤。因此,欧前胡素对脂多糖诱导的急性肺损伤有保护作用,其可能与减少细胞因子TNF-α、IL-1β 的释放,降低MMP-9的表达水平有关,其作用机制可能与脂多糖诱导的急性肺损伤中ROS 被抑制,以及ROS 介导的PI3K/Akt/NF-κB 通路被抑制有关。该实验存在一定的局限: ①样本量偏小,但本实验中该样本量仍具有统计学意义,下一步可增大样本量进一步研究;②欧前胡素是否通过其他机制对脂多糖诱导的急性肺损伤发挥保护作用有待进一步探索。该实验为欧前胡素治疗急性肺损伤提供了一定的实验依据和理论基础。
