量子点流式微球技术用于DNA的检测研究*
2020-09-21蔡冰洁熊晓庆
蔡冰洁,熊晓庆
(1.武汉大学人民医院 检验科,湖北 武汉430060;2.海南医学院 热带医学与检验医学院,海南 海口 571199)
目前基因检测的方法主要有PCR、液态生物芯 片、基因芯片、微流控技术等,这些传统的检测方法有一些较明显的缺陷,如操作繁琐、易污染、耗时耗力、成本高等[1-4]。量子点是一种新型半导体纳米材料,尺寸2 ~10 nm,是一种较传统荧光染料更优良的荧光探针[5-7]。流式微球技术是在流式细胞术的基础上新建的一种技术。其作用机制是通过携带有荧光信号的微球与待测物结合在一起形成一个可以发荧光的复合物,然后通过检测其平均荧光强度反映待测物的浓度[8]。流式细胞仪可以对细胞水平之外的分子水平进行检测[9-10]。为建立一种高通量、操作简单、成本低的快速检测方法,本文拟利用新型纳米材料量子点流式微球技术检测DNA,该新型方法结合量子点优异的荧光特性和流式微球技术的高通量,具有反应灵敏快速、操作简单等优势,利用微球-DNA-量子点夹心结构,通过检测核酸杂交前后荧光强度的变化来实现DNA 的高通量快速检测。该新型技术有望实现临床疾病相关核酸分子的快速检测。
1 材料与方法
1.1 材料与试剂
量子点购自武汉珈源量子点技术开发有限公司,链霉亲和素包被的微球购自武汉珈源生物医学工程有限公司,3-二甲基氨基丙基-N′-乙基碳二亚胺盐酸盐(EDC)、N-羟基丁二酰亚胺(NHS)、生物素琥珀酰亚胺酯(生物素-NHS)购自美国Sigma Aldrich 公司,DNA 序列购自宝生生物工程(大连)有限公司(见表1),通过高效液相纯化,并用1×磷酸盐缓冲液(PBS)稀释,其余试剂购自上海捷瑞生物有限公司。
1.2 仪器与设备
FACSCanto Ⅱ流式细胞仪(美国BD 医疗器械有限公司),干式恒温器(杭州奥盛有限公司),HFsafe-1500TE 生物安全柜(上海力申有限公司),高速离心机(德国艾本德有限公司),震荡器(海门市其林贝尔仪器制造有限公司),纯水过滤器(法国ELGA 有限公司),YM75Z 高温高压灭菌锅(上海三申医疗器械有限公司)。
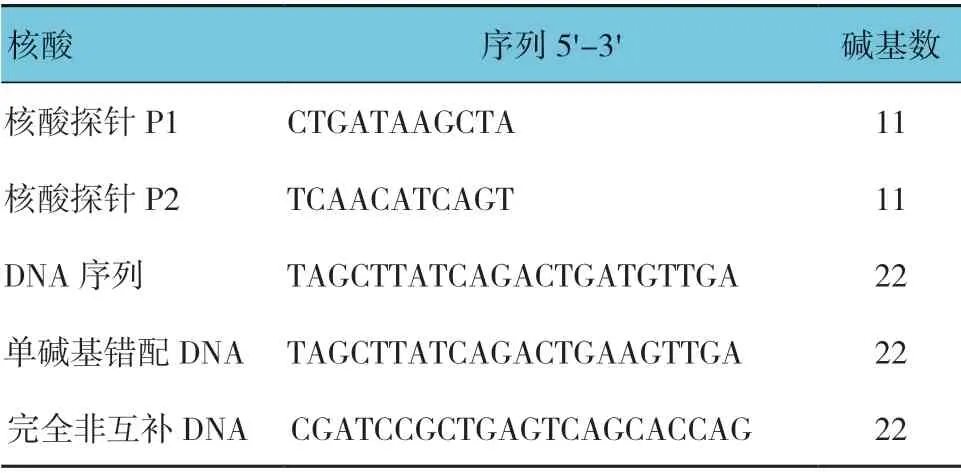
表1 DNA 序列
1.3 方法
1.3.1 在微球表面固定探针P1(微球-P1)将25 μl、10 μmol/L 的探针P1 加入150 μl、5 mmol/L的生物素-NHS 中,室温避光反应4 h,反应完后用1×PBS 洗涤3 次,除去未结合的探针,接着用1×PBS 配成50 μl、5 μmol/L 的生物素化的探针P1(Biotin-P1)。将约7 μg/ml 链霉亲和素包被的微球用1×PBS 洗涤2 次后,取20 μl 洗涤后的磁珠溶液和5 μl、5 μmol/L Biotin-P1 于干燥的Ep 管中,混匀,室温避光反应30 min。
1.3.2 量子点修饰探针P2(QDs-P2)将5 μl、10 mmol/L 的EDC,5 μl、10 mmol/L 的NHS,5 μl、2 μmol/L 的QDs,5 μl、400 μmol/L 的探针P2 分别加到干燥Ep 管中,室温反应2 h,反应后用1×PBS洗涤3 次,最终用1×PBS 配成400 μl、5 μmol/L 的QDs-P2。
1.3.3 核酸杂交反应及检测分析取1.3.1 中合成的微球-P1 与5 μl 不同浓度的DNA 在56℃恒温箱中杂交30 min,接着于杂交体系中加入1.3.2 中QDs-P2在56℃恒温箱中杂交30 min,杂交完成后用1×PBS将体系终体积补液至1 ml,随后用流式细胞仪进行荧光信号检测。分别研究互补DNA、单碱基错配DNA及完全非互补DNA。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验,同时做一元线性(线性拟合)回归分析,P<0.05 为差异有统计学意义。
2 结果
2.1 实验原理
灰色圆球为固定有探针DNA(探针P1)的磁珠,绿色为固定有探针DNA(探针P2)且发绿色荧光的量子点。首先,将靶DNA 与固定有能与DNA 一端互补的探针P1 的磁珠微球反应,然后加入能与DNA另一端互补杂交的QDs-P2,最后形成一个微球-P1-DNA-P2-QDs 复合结构,该结构为不易洗脱的复合物。用1×PBS 洗涤2 次,去除反应体系中未结合的物质,接着用流式细胞仪检测其反应前后平均荧光强度的变化,该平均荧光强度与DNA 的浓度成正比,从而实现DNA 的检测。见图1。
2.2 方法可行性分析
为验证该新型检测方法的可行性,分别检测空白组(不含DNA 和DNA 测试组的平均荧光强度变化。在没有DNA 存在的条件下,微球-P1、QDs-P2 不能特异结合,洗涤后检测其荧光信号,其荧光强度极弱,荧光强度仅在1 ~10 MFI;而在DNA 存在的条件下,微球-P1、DNA 及QDs-P2 核酸杂交,形成一个特异的紧密复合体结构,洗涤后检测其荧光强度在10 ~100 MFI区间内较空白磁珠明显增大。实验结果符合预期,所以本实验所设计方案具有可行性,可以用该新型方法检测DNA。见图2。
2.3 方法的敏感性
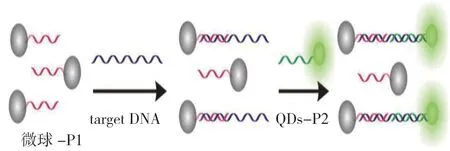
图1 实验原理图
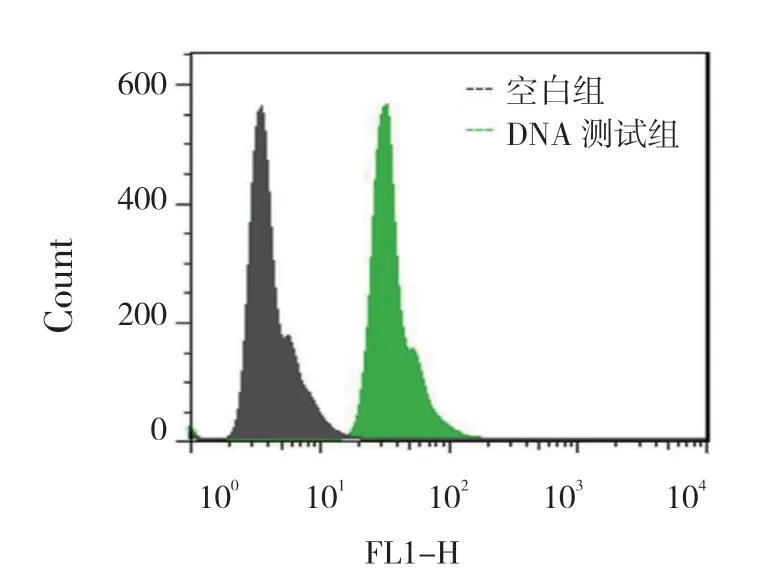
图2 可行性验证荧光图
为检验方法的敏感性,分别将0.2、1.0、10.0、20.0 和100.0 nmol/L 互补DNA 加入体系中与微球-P1和QDs-P2 进行杂交,通过检测杂交前后荧光强度的变化来分析方法的敏感性。流式细胞仪检测到的平均荧光强度随着DNA 浓度的升高,其荧光强度也不断增强。因为DNA 的浓度越大,DNA 中的碱基对与探针DNA 互补序列中的碱基对杂交就愈多,从而形成的微球荧光复合结构越多,其荧光强度越大,所以随着DNA 的浓度高,检测到的荧光强度越强(见图3)。荧光强度与DNA 浓度成良好的线性关系,其线性回归方程为Y=23.55X+24.36[Y为平均荧光强度,X为lgC(DNA 浓度)],方程的决定系数R2=0.989。基于3σ/S(σ 为空白对照的标准偏差,S 为线性方程的斜率),可计算该方法的最低检测限为0.2 nmol/L。不同浓度DNA 测量值比较,差异有统计学意义(F=98.250,P=0.001)。DNA 浓度0.0 与0.2 nmol/L 的检测值比较,差异有统计学意义(t=3.003,P=0.008),DNA 浓度0.2 与1.0 nmol/L 的检测值比较,差异有统计学意义(t=5.232,P=0.001),DNA 浓度1.0 与10.0 nmol/L 的检测值比较,差异有统计学意义(t=5.396,P=0.001),DNA 浓度10.0 与20.0 nmol/L 的检测值比较,差异有统计学意义(t=6.663,P=0.001),DNA 浓度20.0 与100.0 nmol/L 的检测值比较,差异有统计学意义(t=5.318,P=0.001)(见图4)。
2.4 量子点流式微球技术的特异性
为探讨本文构建的新检测方法的特异性,分别将完全非互补DNA、单碱基错配DNA、互补DNA 加入体系中反应。将100.0 nmol/L 完全非互补DNA、单碱基错配DNA、互补DNA 分别与微球-P1 和QDs-P2 进行杂交反应,接着用流式细胞仪检测杂交前后的荧光强度变化。不同DNA 在量子点流式微球技术中的荧光强度比较,差异有统计学意义(F=171.622,P=0.001)。完全非互补DNA 和单碱基错配DNA 引起的荧光强度几乎可以忽略不计,互补DNA 引起的荧光强度变化较完全非互补DNA 及单碱基错配DNA 强。从实验结果可知该新型方法可以很好地将互补DNA 和完全非互补DNA、单碱基错配DNA 区别开来(P<0.05),所以该技术对检测DNA 具有很好的特异性。见图5。
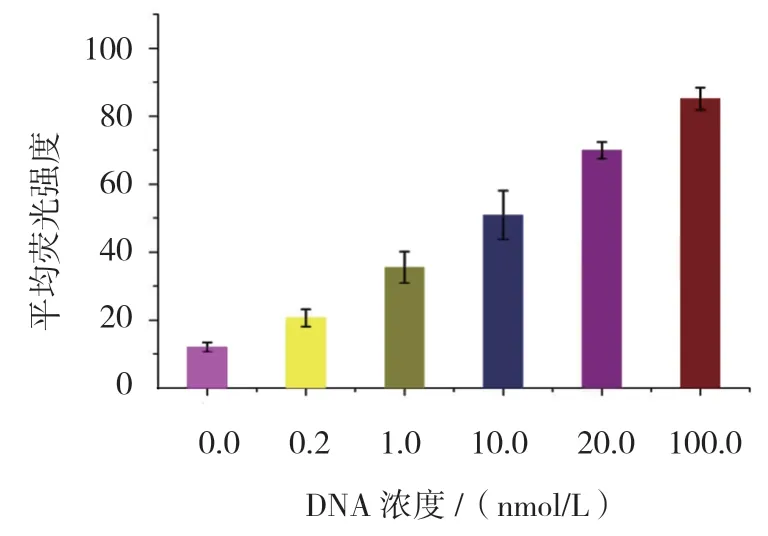
图3 不同浓度DNA 在量子点流式微球技术中的平均荧光强度 (±s)
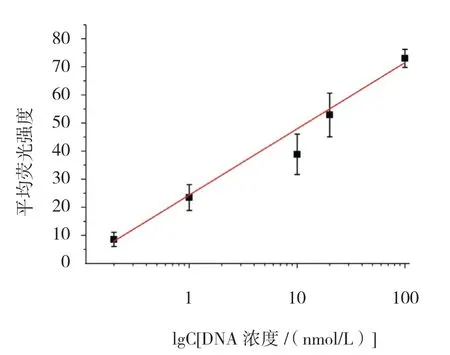
图4 不同浓度DNA 在量子点流式微球技术中的线性拟合曲线
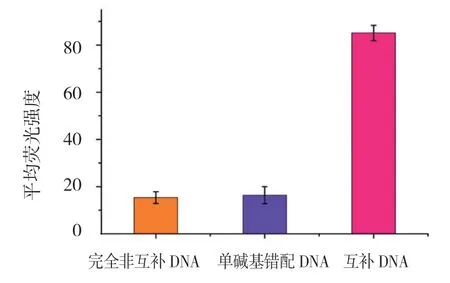
图5 不同DNA 在量子点流式微球技术中的荧光强度(±s)
3 讨论
量子点是一种可以应用到各种学科中的新型半导体纳米材料,其粒子直径往往<20 nm,由几种元素混合构成,其组成元素多是Ⅱ~Ⅳ族元素中的Zn S、Cd Se、Cd S 和Ⅲ~Ⅴ族元素中的In As、Pa 等[5,11-12]。传统的荧光染料有一些明显的缺陷,如荧光容易消散、激发光谱较窄、容易被光漂白、荧光效率低、对环境有危害等。量子点是一种新型荧光材料的出现,很好地解决传统荧光染料的上述缺陷。量子点的性质比较活泼,荧光稳定且寿命长;激发光谱宽且发射光谱窄;通过调节量子点的组成元素和大小,改变荧光的发射光谱,实现不仅能检测紫外区域,还可以检测到红外区域,减少因紫外辐射对生物体的危害;不会损坏检测对象的结构,还可以接受激发光产生荧光;非常适用于生物分子的荧光标记[13-14]。综上可知,量子点是一种非常优良的荧光探针,在未来的科学研究中有望被广泛应用[15-18]。
近年来,一种可以定量检测和分析细胞水平以及微生物水平的新方法流式细胞术产生[19],流式细胞术可同时对多个参数进行分析,分析时间短且效率高,高通量且灵敏,还可以对其设定的检测项目大量收集,并进行全面分析,具有非常强的灵活性,在临床医学中主要用于细胞分析[20]。流式微球技术是在流式细胞术的基础上新建的一种技术,作用机制是通过携带有荧光信号的微球与待测物结合在一起形成一个可以发荧光的复合物,然后通过检测其平均荧光强度从而反映待测物的浓度[21]。该技术检测速度较快,可以通过将生物分子结合在微球上,从而实现在生物分子水平上的检测,实现流式细胞仪对细胞水平之外的分子水平进行检测[22-27]。
本实验将高性能的量子点和流式细胞术结合,形成一种崭新的量子点荧光探针流式微球技术用于DNA分子的快速、高通量检测,该新型技术能高敏感性、高特异性地检测DNA 分子,最低检出限能达到0.2 nmol/L,且具有操作简单、成本低、耗时短等优势,有望用于各疾病相关核酸分子的高敏感性、高特异性及高通量的检测。
