棉花与几种作物根际土壤酶活性及细菌多样性分析
2020-09-21刘海洋张仁福
刘海洋,王 伟,张仁福,姚 举
(新疆农业科学院植物保护研究所/农业部西北荒漠绿洲作物有害生物综合治理重点实验室,乌鲁木齐 830091)
0 引 言
【研究意义】土壤酶在土壤物质与能量的循环过程中起重要作用,能反映土壤中各种生物化学反应的强度方向,是土壤生态系统中有机质分解和养分循环必需的催化剂[1],可表征土壤微生物种群与生物活性对农业操作中各种人为措施的响应。土壤中微生物群落结构及其组成变化同样能反映土壤生态环境的变化趋势,对作物生长具有重要意义[2-3],土壤酶活性及土壤微生物是评价土壤状况的重要指标[4]。新疆棉田由于长年连作导致枯、黄萎病等土传病害发生严重,土壤肥力下降,缺乏解决手段。分析不同抗病性棉花品种或不同绿肥等经济作物根际土壤酶活性以及微生物群落结构,对于研究棉田土壤微生态变化趋势,促进土地资源的持续利用有着重要意义。【前人研究进展】根际土壤酶活性和微生物群落结构受作物的影响较大,作物在生长过程中不断以根际沉积的形式向土壤输入有机化合物[5],间接影响土壤的微生物群落结构和土壤酶活性。土壤酶主要来源于土壤微生物,其活性与土壤微生物的数量和群落结构有密切关系[6]。张向前等[7]研究发现,间作玉米田中细菌、真菌和放线菌对土壤酶有正向促进作用,贾志红等[8]研究发现,新疆棉区棉花连作5~10 a土壤酶活性明显降低,谷岩等[9]同样发现,大豆长期连作土壤中脲酶和转化酶活性降低,王志刚等[10]研究表明,韭菜长年连作降低了根际土壤中过氧化氢酶与多酚氧化酶活性,Sun等[11]研究转Bt基因棉毒素对土壤酶活性的影响发现,Bt毒素提升了土壤脲酶、碱性磷酸酶、转化酶和纤维素酶的活性。【本研究切入点】新疆是我国最大的植棉区,大规模长年连作的问题极其突出,棉花黄萎病等土传病害发生愈加严重[12]。目前关于不同抗病性棉花品种对根际土壤酶活性以及微生物群落结构影响的研究较少。前期研究发现,不同抗性棉花品种与不同作物根际土壤中微生物多样性和病原菌数量存在差异,研究不同抗性棉花品种和不同作物间作对根际土壤酶活性的影响。【拟解决的关键问题】检测不同抗病性棉花品种和几种不同经济作物根际土壤中过氧化氢酶、脱氢酶、脲酶活性以及细菌多样性,分析土壤酶活性、细菌多样性对棉花品种抗病性、不同种植作物的响应, 为构建健康土壤微态及棉田土传病害防治提供参考。
1 材料与方法
1.1 材 料
1.1.1 供试品种
感病棉花品种军棉1号由新疆农业科学院植物保护研究所提供,耐病品种新陆中66号由市场上购买,耐病棉花材料K3、中5由中国农业科学院植物保护研究所提供,番茄、玉米、棉花、花生、大豆、甜菜、苜蓿种子均由市场上购买,水稻品种新稻11号由新疆农业科学院核生物技术研究所提供。
1.1.2 供试土壤
将军棉1号以及中5、K3种植于库尔勒棉花黄萎病病圃内,小区随机区组排布,3个重复,于2018年5月10日出苗期和7月10日花铃期分别取棉花根际土壤进行分析。在该病圃内设新稻11号、新稻11号+新陆中66号、新陆中66号3个处理,每处理5个重复,于7月10日采集各处理根际土壤,分析土壤酶活性及细菌α多样性。
在库尔勒棉花基地内连续多年种植棉花的常规棉田内设置苜蓿、大豆、花生、棉花、玉米、番茄、甜菜共7种作物处理小区,每小区225 m2,3次重复,于7月10日每处理采集6份土壤,分析土壤酶活性及细菌α多样性。
1.1.3 试剂与仪器
土壤过氧化氢酶试剂盒、土壤脱氢酶试剂盒、土壤脲酶试剂盒均购自南京建成生物工程研究所;甲苯等购自新疆鼎枫生物科技有限公司。DWP-9272恒温培养箱(上海一恒科学仪器有限公司),Eppendorf 5427 R台式高速离心机(艾本德中国),Eppendoff可调式移液枪(艾本德中国),Thermo Fisher 1510-01788C全波长酶标仪(上海坤肯生物化工有限公司),ZC-100B恒温摇床(常州冠军仪器)。
1.2 方 法
1.2.1 过氧化氢酶活性测定
利用过氧化氢酶试剂盒进行测定。取0.1 g处理好的土样到测定管、无基质管当中,将测定管和无土管加入1 000 μL试剂一溶液,无基质管加入1 000 μL的蒸馏水。之后分别在25℃条件下震荡20 min,将培养好的每个管都加入25 μL的试剂二溶液,将所有管都混匀后25℃条件下离心5 min。离心后用移液枪取820 μL上清液,然后将96 g的试剂三加入到每个管中。上清液加入96孔板当中,每孔100 μL,重复4次,利用酶标仪在240 nm波长度下测定吸光值。
1.2.2 脱氢酶活性测定
利用脱氢酶试剂盒进行测定,将准备好的0.1 g风干土样加入测定管之后再加200 μL试剂一,空白管加入200 μL的试剂二,充分混匀后在37℃的培养箱中孵育24 h,之后每管加入1 800 μL的试剂三后震荡1 h,25℃条件下8 000 r/min离心5 min,取上清液加入96孔板当中,每孔100 μL,重复4次,利用酶标仪在485 nm波长度下测定吸光值。
1.2.3 脲酶活性测定
利用脲酶试剂盒进行测定,取0.2 g土壤样品加入到测定管与对照管中,随后分别加100 μL的甲苯,震荡混匀,室温放置15 min。测定管加入500 μL的试剂二,对照管加入500 μL蒸馏水,混匀后测定管和对照管中分别加入1 000 μL的试剂三,混匀放入37℃恒温暗培养24 h后,25℃条件下10 000 r/min离心10 min,取上清液并稀释10倍,各取400 μL稀释后的上清液,分别加80 μL的试剂四,随后分别加入60 μL的试剂五,充分混匀,室温放置20 min后分别加460 μL蒸馏水,取混合液加入96孔板当中,每孔100 μL,重复4次。利用酶标仪在波长578 nm下测定吸光度值。
1.2.4 土壤总 DNA 的提取与文库构建、测序
利用北京百泰克生物技术公司生产的DP4001土壤试剂盒,严格按照操作步骤提取土壤总DNA,利用1%琼脂糖凝胶电泳检测提取的DNA质量,使用 Nano Drop 2000 ΜV-Vis 光谱仪测定DNA浓度,总量满足3次及以上建库要求。细菌16S rDNA (V3+V4)区域引物:338F:5'- ACTCCTACGGGAGGCAGCA-3',806R:5'- GGACTACHVGGGTWTCTAAT-3'。扩增程序:98℃预热2 min,98℃变性30s,50℃退火30s,72℃延伸1 min,30个循环,72℃延伸5 min。由北京百迈客生物科技有限公司构建DNA文库,采用 Illumina Hiseq 2500 PE250 模式进行测序。
1.3 数据处理
对测序获得的原始数据使用 FLASH V1.2.7 软件,按照最小重叠长度10 bp重叠区最大错配比率0.2对每个样品的序列进行拼接,得到的拼接序列即原始序列。将拼接得到的序列用Trimmomatic 软件设置50 bp的窗口,如果窗口内的平均质量值低于20,截去后端碱基,过滤质控后长度小于标签长度75%的标签,使用ΜCHIME软件并去除嵌合体,得到高质量的序列。在相似性97%的水平上使用ΜCLΜST软件对序列进行聚类,以所有序列数的0.005%作为阈值过滤OTΜ。选择细菌16S Silva数据库进行比对,利用Mothur version V.1.30 软件进行Alpha 多样性指数分析,包括Chao1丰富度估计量、Ace 丰富度估计量、香农-威纳多样性指数。
2 结果与分析
2.1 土壤酶活性
2.1.1 土壤过氧化氢酶活性2.1.1.1 不同抗病性棉花根际土壤过氧化氢酶活性
研究表明,5月感病品种军棉1号以及耐病品种中5、K3 3个棉花品种根际土壤的过氧化氢酶活力值分别为63.55和63.21、63.70 U/g土,3个棉花品种之间没有显著性差异。7月中5、K3土壤过氧化氢酶与5月相比无明显变化,军棉1号根际土壤中的过氧化氢酶值为58.83 U/g,与5月相比降低7.42%。各品种之间酶活性值没有显著差异,2个采样时期之间同样没有显著差异。图1
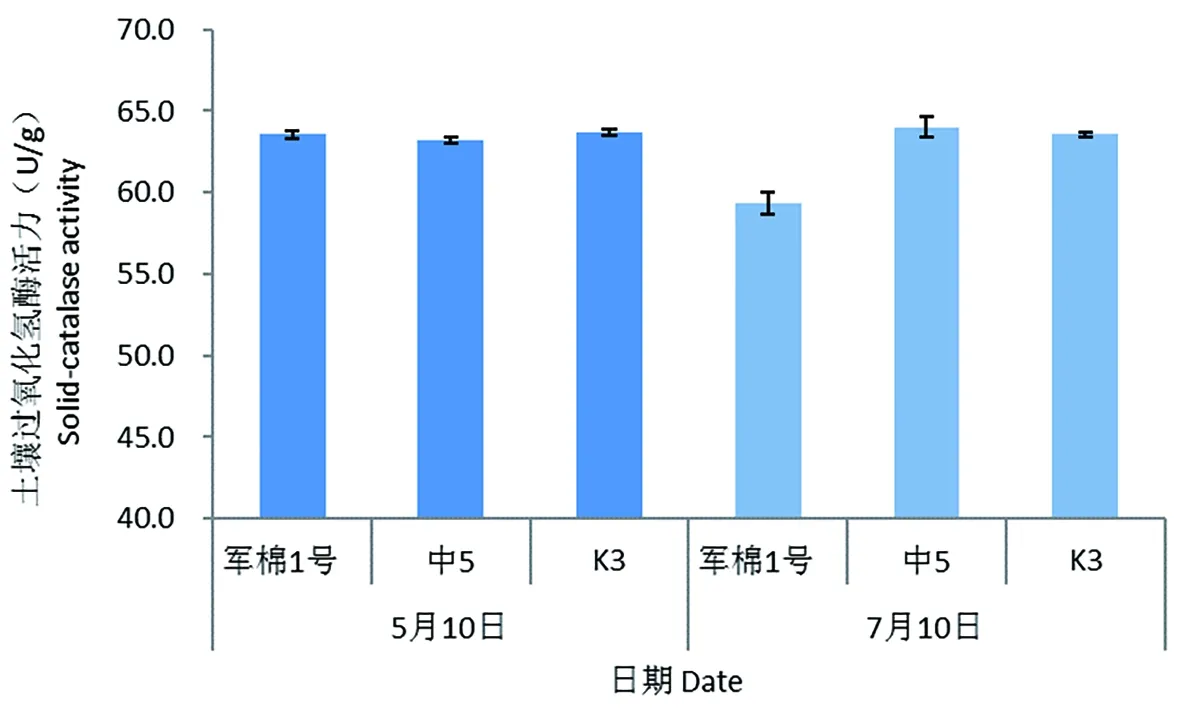
图1 不同抗病性棉花品种根际土壤过氧化氢酶活性
2.1.1.2 棉花水稻间作土壤过氧化氢酶活性
研究表明,新陆中66号根际土壤过氧化氢酶为58.72 U/g,新稻11号根际土壤过氧化氢酶为63.93 U/g,较新陆中66号升高8.87%,新稻11号与新陆中66号间作土壤过氧化氢酶为60.98 U/g,低于新稻11号处理,高于新陆中66号处理,水稻对棉田土壤过氧化氢酶活性表现出一定的提升作用,3个处理之间土壤过氧化氢酶活性没有达到显著性差异。图2

图2 棉花水稻间作根际土壤过氧化氢酶活性Fig.2 Catalase activity of the rhizosphere soil of cotton and rice intercropping
2.1.1.3 不同作物根际土壤过氧化氢酶活性
研究表明,苜蓿、大豆、花生3种豆科经济作物根际土壤过氧化氢酶值分别为65.57、64.49和64.71 U/g,棉花根际土壤过氧化氢酶活力值为64.56 U/g,玉米、番茄以及甜菜3种作物根际土壤过氧化氢酶值分别为64.34、64.15和64.38 U/g,7种作物根际土壤的过氧化氢酶活性没有显著性差异,豆科作物作为常用的绿肥没有显著提升棉田土壤过氧化氢酶活性。图3
[31] Bonnie Glaser, “US-China Relations: Tensions Rise and Fall, Once Again”, Comparative Connections, October 2010.

图3 不同作物根际土壤过氧化氢酶活性Fig.3 Catalase activity of the rhizosphere soil of different crops
2.1.2 土壤脱氢酶活性2.1.2.1 不同抗病性棉花根际土壤脱氢酶活性
研究表明,5月感病品种军棉1号以及耐病品种中5、K3 3个棉花品种根际土壤的脱氢酶活力值分别为99.0和128.1、136.0 U/g土,其中感病品种军棉1号根际土壤脱氢酶活性最低,但是3个棉花品种之间没有显著性差异。
7月军棉1号以及中5、K3土壤脱氢酶活力值分别为202.4和225.1、382.8 U/g土,与5月相比均有提升,分别升高104.4%、75.7%和181.4%,多重分析表明,各品种之间脱氢酶活性值没有达到显著差异,2个采样时期之间在统计学上同样没有显著差异。图4
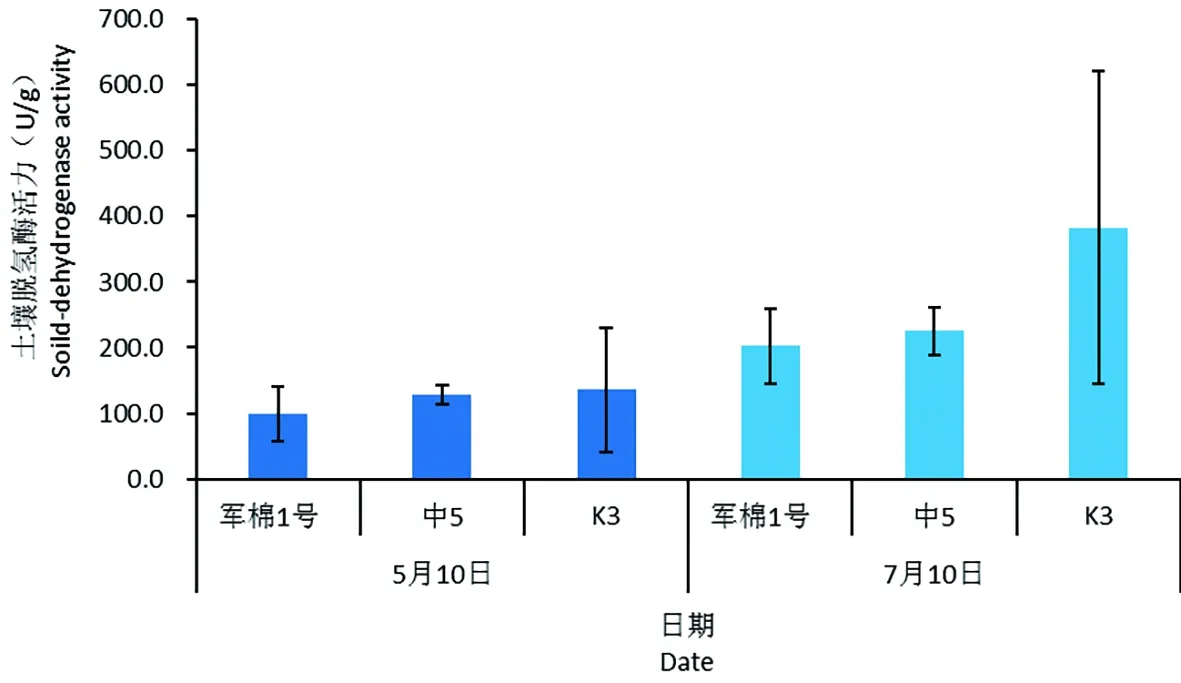
图4 不同抗病性棉花品种根际土壤脱氢酶活性Fig.4 Dehydrogenase activity of the rhizosphere soil of different resistant cotton varieties
2.1.2.2 棉花水稻间作根际土壤脱氢酶活性
研究表明,新陆中66号根际土壤脱氢酶活性值为199.0 U/g,新稻11号根际土壤脱氢酶活性值为402.9 U/g,较新陆中66号升高102.4%;新稻11号与新陆中66号间作处理土壤脱氢酶为256.1 U/g,低于新稻11号处理,高于新陆中66号处理,水稻对棉田土壤脱氢酶活性表现出一定的提升作用,但是3个处理之间土壤脱氢酶活性没有达到显著差异。图5

图5 棉花水稻间作根际土壤脱氢酶活性Fig.5 Dehydrogenase activity of the rhizosphere soil of cotton and rice intercropping
2.1.2.3 不同作物根际土壤脱氢酶活性
研究表明,苜蓿根际土壤脱氢酶活性最高,为33.3 U/g,其次为棉花,脱氢酶活性为30.25 U/g,大豆、花生根际土壤脱氢酶值分别为25.8和25.3 U/g,低于棉花根际土壤;甜菜、番茄和玉米3种作物根际土壤的脱氢酶活性分别为24.0、21.8和19.17 U/g,玉米根际土壤中的脱氢酶活性最低。7种作物根际土壤的脱氢酶活性无显著差异。图6

图6 不同作物根际土壤脱氢酶活性Fig.6 Dehydrogenase activity of the rhizosphere soil of different crops
2.1.3 土壤脲酶活性2.1.3.1 不同抗病性棉花根际土壤脲酶活性
研究表明,5月感病品种军棉1号以及耐病品种中5、K3 3个棉花品种根际土壤脲酶活力值分别为429.3和427.9、457.0 U/g,3个棉花品种之间没有显著差异。7月3个棉花品种根际土壤的脲酶活性相比5月均大幅升高,分别为735.6、1 296.2和1 658.6 U/g,分别增长71.3%、203.2%和263.0%,抗病性高棉花品种根际土壤脲酶活性高。各品种之间脲酶活性没有显著差异,2个采样时期之间同样没有显著差异。图7
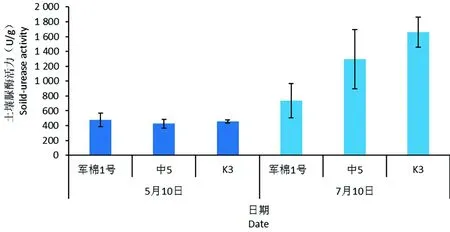
图7 不同抗性棉花品种根际土壤脲酶活性Fig.7 Urease activity of the rhizosphere soil of different resistant cotton varieties
2.1.3.2 棉花水稻间作根际土壤脲酶活性
研究表明,新陆中66号根际土壤脲活性值为856.4 U/g,新稻11号根际土壤脲酶活性值为1 544.9 U/g,较新陆中66号根际土壤高80.4%;新稻11号与新陆中66号间作处理土壤脲酶为1 243.2 U/g,低于新稻11号处理,高于新陆中66号处理。水稻对棉田土壤脲酶活性表现出一定的提升作用,但是3个处理之间同样没有达到显著差异。图8
2.1.3.3 不同作物根际土壤脲酶活性
研究表明,花生、大豆、苜蓿3种豆科作物根际土壤脲酶值均高于棉花根际土壤,分别为522.6、496.6和516.6 U/g,豆科作物表现出对土壤脲酶活性具有一定的提升作用;番茄、玉米根际土壤脲酶值均低于棉花根际土壤,分别为437.3和459.3 U/g;甜菜根际土壤脲酶活力值为504.3 U/g,较棉花根际土壤高9.08%。7种不同作物根际土壤的脲酶活性无显著差异。图9

图8 棉花水稻间作根际土壤脲酶活性Fig.8 Urease activity of the rhizosphere soil of cotton and rice intercropping
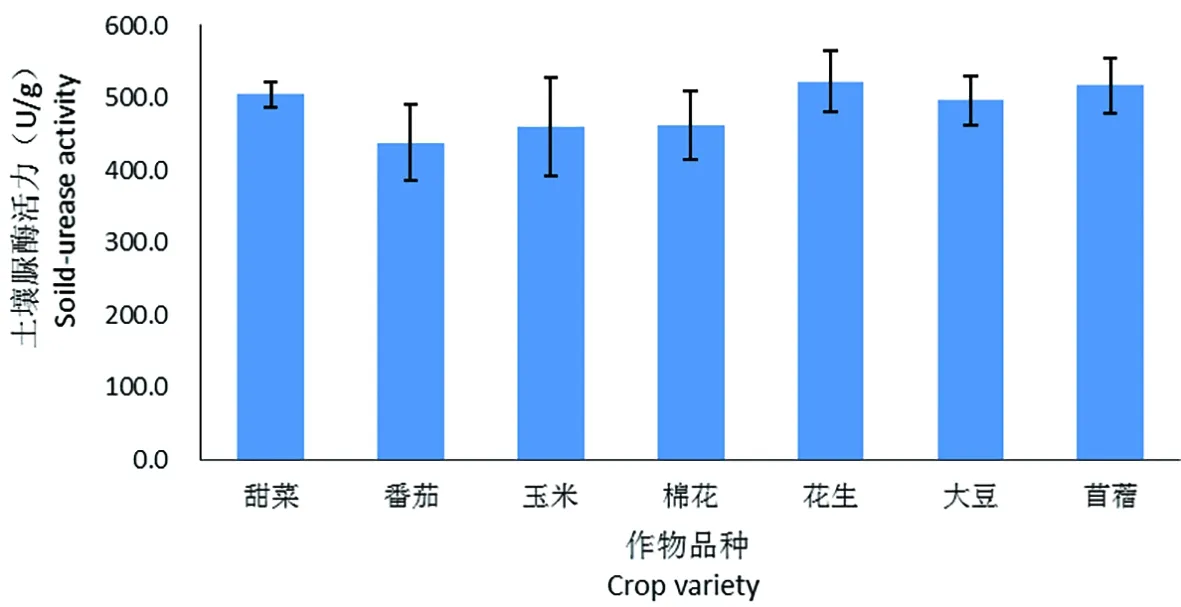
图9 不同作物根际土壤脲酶活性Fig.9 Urease activity of the rhizosphere soil of different crops
2.2 土壤细菌多样性
2.2.1 不同抗病性棉花品种以及水稻根际土壤细菌多样性
研究表明,耐病品种新陆中66号根际土壤的细菌OTU数量、Ace 丰富度、Chao1丰富度均高于感病品种军棉1号,新陆中66号根际土壤的香农指数低于军棉1号,但是2个棉花品种之间均没有显著差异。对棉花黄萎病免疫的水稻品种新稻11号根际土壤的细菌OTU数量、Ace 丰富度、Chao1丰富度均低于棉花,各指标之间同样没有显著性差异。表1

表1 不同抗病性棉花品种以及水稻根际土壤细菌多样性Table 1 Bacterial diversity of rhizosphere soil of different resistant cotton varieties and rice
2.2.2 棉花以及6种不同作物根际土壤细菌多样性
大豆、花生、苜蓿3种豆科作物根际土壤细菌的OTU数量、Ace 丰富度、Chao1丰富度均高于棉花,花生和苜蓿的香农指数低于棉花,其中大豆的增幅较大,OTU数量、Ace 丰富度、Chao1丰富度分别较棉花高14.3%、14.5%、14.8%,豆科植物对土壤细菌的种群丰度增加有一定的促进作用,但是没有达到显著性差异;番茄、玉米、甜菜3种作物根际土壤细菌的OTU数量、Ace 丰富度、Chao1丰富度、香农指数均低于棉花,表现出降低趋势,其中甜菜根际土壤细菌的OTU数量、Ace 丰富度、Chao1丰富度降幅较大,分别降低29.8%、29.8%和29.9%,但是,没有达到显著性差异。表2
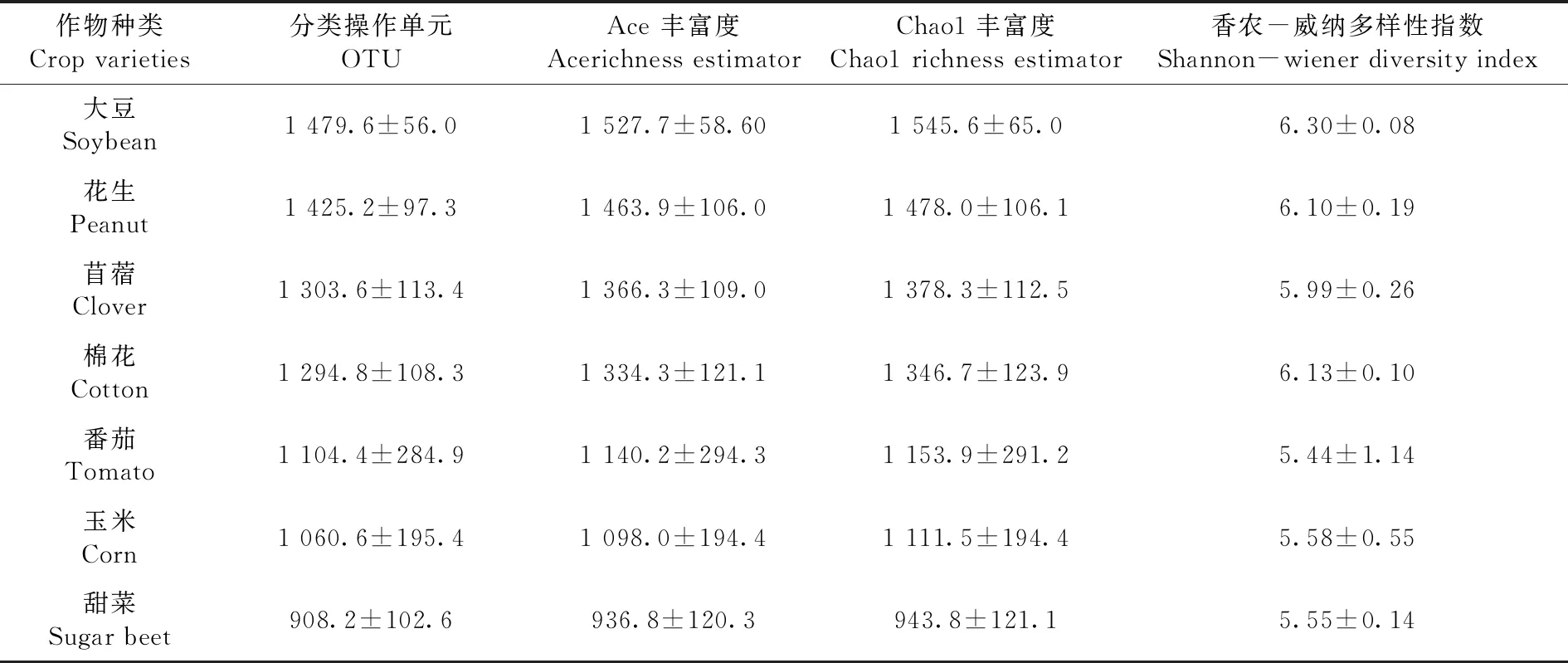
表2 棉花以及6种不同作物根际土壤细菌多样性Table 2 Bacterial diversity of rhizosphere soil of cotton and six different economic crops
2.3 土壤细菌多样性与酶活性的相关性
研究表明,土壤中代表细菌丰度和数量的指标OTU数量、Ace丰富度、Chao1丰富度均与土壤过氧化氢酶、脱氢酶、脲酶没有达到显著相关,而代表土壤细菌种群多样性的香农指数与土壤过氧化氢酶达到显著相关,相关系数为0.832(Sig.=0.02),仍未与土壤脱氢酶、脲酶活性达到显著相关。表3

表3 细菌多样性与土壤酶活性的相关性Table 3 Correlation analysis between bacterial diversity and soil enzyme activity
3 讨 论
土壤酶活性能够敏感的反映土壤环境的变化,易受土壤环境变化的影响,诸如土壤肥力[13-15]、栽培模式[16-17]、种植作物品种[18]以及种类[19]的变化都是影响土壤酶活性以及微生物群落变化的重要因素。其中,品种的抗病性差异对土壤中部分酶类有影响作用,刘丽青等[20]研究了3个黑穗病抗性不同谷子品种被致病菌黑粉菌侵染后对谷田土壤酶活性的影响,发现3个谷子品种根际土壤CAT、PPO、蔗糖酶和碱性磷酸酶活性水平在不同品种间存在差异,但脲酶活性差异出现在不同发育期之间,并无品种间差异,证明土壤酶参与谷子植株对黑穗病的抗病防御生理过程,不同品种对土壤酶活性有较大影响[20]。棉花黄萎病作为土传病害难以防治,种植抗病品种是最为直接有效的方法。研究表明,极度感病的军棉1号与抗病性较好的中5、K3根际土壤的过氧化氢酶、脱氢酶、脲酶活性均没有达到显著性差异,在2个采样时期之间同样未达到显著差异。但是,感病品种军棉1号根际土壤中过氧化氢酶值7与5月相比下降;耐病品种K3、中5根际土壤的脲酶活性7月高于军棉1号,脱氢酶活性在5和7月均高于军棉1号,棉花品种的抗病性差异对土壤的酶活性产生显著影响可能需要一个较长时期。土壤酶主要来源于土壤微生物,其活性与土壤微生物的数量和群落结构密切[6,7],而作物对土壤中的细菌数量和种群多样性有明显影响。研究表明,抗病性较好的棉花品种新陆中66号根际土壤的细菌OTU数量和α多样性均与感病品种军棉1号没有显著差异,与土壤酶活性没有差异的结论比较一致。
连作是新疆棉花种植面对的棘手问题,长期作物连作会导致土壤养分平衡失衡、土壤生物活性下降、微生物群落结构发生变化等问题[21-22]。刘瑜等[23]研究表明,棉田土壤脲酶、碱性磷酸酶、β-葡萄糖苷酶、纤维素酶和多酚氧化酶均随连作年限增加而下降,而棉花/苜蓿轮作后各土壤酶活性均高于棉花连作处理。不同作物间作、轮作是改良土壤微生态环境,保障土壤健康的重要措施[24]。孟自力等[17]研究表明,大蒜与小麦间作模式下,大蒜定植越早,小麦根际细菌、硝化细菌和氨化细菌数量越多,真菌数量越低,磷酸酶、脲酶和过氧化氢酶活力越高,间作大蒜对土壤起到了正面促进作用,孟亚利等[25]研究表明,棉-麦套作时棉花根际与非根际土壤脲酶、蔗糖酶、蛋白酶及过氧化氢酶活性均明显高于单作棉。李伶俐等[26]研究表明,棉花分别与小麦、玉米、谷子和高粱同穴互作育苗土壤中细菌和放线菌数量显著增加,真菌数显著降低,脱氢酶、中性磷酸酶、转化酶和脲酶活性显著提高,两苗同穴互作育苗改善了育苗土壤微生物数量和结构。研究表明,水稻根际土壤过氧化氢酶、脱氢酶和脲酶活性分别较棉花升高8.87%、102.4%和80.4%,棉花与水稻间作土壤较棉花根际土壤升高3.84%、28.7%和45.2%,棉花与水稻间作对土壤酶活性表现出一定的提升作用,而水稻根际土壤细菌的OTU数量和α多样性却均低于棉花根际土壤,但不同处理之间土壤酶活性与细菌多样性均在统计学上未达到显著差异水平,可能与栽培周期有关。谢利等[27]研究棉花-孜然间作表明,与棉花单作相比,土壤细菌、放线菌、真菌数量及脲酶、过氧化氢酶、蔗糖酶活性均显著降低,间作作物的选择可能对土壤活性和微生物多样性起到主要的调节作用。
不同作物对土壤酶活性、微生物多样性的影响存在差异。张明发等[28]研究表明,不同品种绿肥种植翻压均可显著改善土壤的物理性状,提高土壤养分含量和土壤酶活性,在效应上具有相似的特点,主要影响土壤脲酶、过氧化氢酶与酸性磷酸酶活性及碱解氮和有效磷的含量,主要差异是土壤理化性状以及过氧化氢酶的变化。李红燕等[29]研究表明,长武怀豆和油菜翻压入土后,增加了土壤的养分含量和酶活性,培肥效果优于绿豆和毛叶苕子;王晓军等[19]研究表明,豆科绿肥氮还田量高于十字花科,可能与油菜自身不能固氮的原因导致。研究发现,苜蓿、大豆、花生3种豆科作物根际土壤过氧化氢酶、脱氢酶、脲酶活性以及土壤细菌的OTU数量、Ace 丰富度、Chao1丰富度均普遍高于甜菜、番茄和玉米3种作物,其中大豆的增幅较大,甜菜降幅较大,显示出固氮作物对土壤酶活性以及微生物多样性的提升能力,但是不同作物之间未达到显著性差异。张明发等[28]研究表明,土壤酶活性与土壤肥力指标均呈极显著相关;顾美英等[30]研究表明,新疆棉田土壤中细菌数量与土壤酶活性有一定的相关性,研究发现,土壤中代表细菌丰度和数量的OTU数量、Ace丰富度、Chao1丰富度均与土壤过氧化氢酶、脱氢酶、脲酶没有达到显著相关,而代表土壤细菌种群多样性的香农指数与土壤过氧化氢酶达到显著相关,可能不同作物引起特定微生物的富集会显著影响土壤的酶活性,但可能需要一个较长的生长周期。
新疆棉花黄萎病发生严重,目前除种植抗病品种外缺少有效的防治手段,前期研究发现,不同抗病性棉花品种和不同作物根际土壤中大丽轮枝菌的数量存在显著差异,利用作物根系的化感作用来影响土壤的微生物群落结构和土壤的酶活性,继而改善棉花根系微生态,减少病原菌的数量。
4 结 论
4.1 抗病性不同棉花品种根际土壤的过氧化氢酶、脱氢酶、脲酶活性均无明显差异,5与7月2个采样时期同样无显著差异;棉花-水稻间作处理过氧化氢酶、脱氢酶和脲酶分别较棉花单作升高3.84%、28.7%、45.2%,间作对土壤酶活性表现出提升作用,但未达到显著水平;苜蓿、大豆、花生3种豆科作物根际土壤酶活性普遍高于甜菜、番茄和玉米,但是未达到显著差异。
4.2 抗病性不同棉花品种根际土壤的细菌OTU数量和α多样性指数均无显著差异;大豆、花生、苜蓿3种豆科作物根际土壤细菌的OTU数量和Ace、Chao1指数均高于棉花,番茄、玉米、甜菜3种作物根际土壤细菌OTU数量和α多样性指数均低于棉花,其中大豆的增幅最大,甜菜降幅较大,不同作物之间未达到显著性差异。
4.3 种植不同抗病性棉花品种、棉花-水稻间作以及种植不同作物均虽对土壤酶活性、细菌数量和多样性形成了一定影响,但是单生育期内影响程度有限,通过棉花与不同作物搭配、间作等模式改变棉田土壤的微生态环境可能需要较长的生长周期。
