银杏种子萌发过程低场核磁T2反演谱解译初探
2020-09-20赵茂程汪希伟汪贵斌
赵茂程,顾 盛,汪希伟,汪贵斌,李 忠
银杏种子萌发过程低场核磁T2反演谱解译初探
赵茂程1,2,顾 盛1,汪希伟1,汪贵斌3,李 忠4
(1. 南京林业大学机械电子工程学院,南京 210037;2. 泰州学院,泰州 225300;3. 南京林业大学林学院,南京 210037;4. 南京林业大学机电产品包装生物质材料国家地方联合工程研究中心,南京 210037)
随着科学技术的发展,低场核磁共振(Low Field Nuclear Magnetic Resonance, LF-NMR)横向弛豫时间(Transverse Relaxation Time, T2)反演谱检测技术越来越多的被应用于农业,但当前对T2反演谱的解译尚停留在水分相态分布层面。为探索从物质成分角度对种子T2反演谱进行解译的新方法,该研究以银杏种子为对象,利用低场核磁共振技术检测并对比银杏鲜种、种子粉末及其主要成分试样的T2反演谱,分析各信号峰的形成机理,并以此为依据对其在种子萌发过程中的变化进行解译。研究结果表明:淀粉与蛋白质混合试样T2反演谱的峰T21、T22、T23以及淀粉与油脂混合试样的峰T24在峰顶时间上和种子粉末试样相对应信号峰完全一致;在物质成分及配比完全相同的情况下,种子粉末试样T2反演谱的峰T21~T24的峰顶时间较鲜种分别相差12.98%、32.21%、13.02%、0%,T21、T22峰比例较鲜种分别偏少41.72%、29.33%,T23峰比例偏多92.26%,T24峰比例偏少91.71%,说明种子组织结构会对其内部水分的弛豫时间和相态分布比例造成一定影响。仅从物质成分角度考虑,种子内水分的弛豫时间主要在淀粉、蛋白质的影响下表现为T21、T22、T23,在淀粉和油脂的影响下表现为T24。由此认为峰T21、T22主要为吸附在淀粉和蛋白质上相态不同的结合水的信号,峰T23为主要被淀粉和蛋白质束缚后产生的半结合水的信号,峰T24主要为种子中自由水的信号(少量源自油脂)。此外,种子即将裂壳时将形成T2a(峰顶时间在10 ms左右)、T2b(峰顶时间>1 000 ms)2个新信号峰,可作为预示种子萌发状态即将发生重要变化的“预兆峰”。提出的从化学组分及核磁检测原理角度对银杏种子萌发过程T2反演谱进行解译的新途径,可为基于LF-NMR方法对种子萌发过程中化学组分变化进行活体分析提供参考。
核磁共振;种子;水分;T2反演谱;解译;萌发过程
0 引 言
银杏(L.)是原产于中国的珍贵树种之一,其叶具有极高的药用和经济价值[1-4],现已大量推广种植。银杏主要的繁殖方法有播种、扦插、嫁接、分蘖等,由于实生苗叶总萜内脂和黄酮含量高[5],叶用银杏常采用播种繁殖。研究银杏种子萌发过程中的水分状态分布以及成分含量变化,对探究其萌发机理、指导科学种植具有重要意义。
低场核磁共振技术(Low Field Nuclear Magnetic Resonance,LF-NMR)的横向弛豫时间(Transverse Relaxation Time,T2)反演谱检测可以快速、无损地获知样品内水分含量和相态分布情况,已广泛运用于食品[6-9]、环保[10]、材料[11-12]、地质[13-14]等领域。T2反演谱检测在种植业也成为了重要的研究手段,宋平等[15]通过LF-NMR技术动态监测玉米种子的萌发过程,研究其内部各相态水分的流动规律和生理代谢状态;杨洪伟等[16]利用T2弛豫谱和质子密度加权成像分析在聚乙二醇处理下水稻种子萌发过程内部水分分布和变化规律;牟红梅等[17]结合T2弛豫谱和质子密度加权成像分析,对冬小麦籽粒进行连续活体检测,揭示了小麦灌浆过程水分变化规律。国外学者也利用T2反演谱对植物萌发过程进行了诸多研究[18-21]。但目前对T2反演谱的解译仅停留在水分相态分布的层面,未能将其与检测对象的化学组分建立关联。
为突破当前对T2反演谱解译的局限,本文以银杏种子为研究对象,通过低场核磁共振技术,检测并分析鲜种、种子粉末及其主要成分试样的T2反演谱,探究各信号峰的形成机理,拟提出一种从物质成分角度对种子萌发过程中T2反演谱的变化进行解译的新方法。
1 材料与方法
1.1 试验设备
本文主要设备为MesoMR23-060H-I在线低温核磁共振分析与成像系统(苏州纽迈分析仪器股份有限公司)、RXZ-500B人工气候箱(宁波江南仪器厂)、Allegra 64R台式高速离心机(贝克曼库尔特有限公司)、DHG-9246A电热恒温鼓风干燥箱(上海精宏实验设备有限公司)、JA1003电子天平(上海浦春计量仪器有限公司);麦芽糖购自上海源叶生物科技有限公司,其他试剂均为国产分析纯试剂,另索氏提取器、玻璃试管、培养盒、吸水纸若干。
试验采用的银杏种子取自江苏省邳州市银杏良种基地,品种为道真5号,于2018年10月采摘后带皮储藏。2019年3月,在种子完成生理后熟后,洗去外种皮,晾干表面水分并挑选出颗粒饱满、大小和质量相近的银杏种子。选取20颗用于萌发试验,其余种子备用。
1.2 试验方法
1.2.1 主要成分提取
参照GB 5009.6-2016[22]提取银杏种子粗脂肪。通过碱溶酸沉法获得粗银杏种子蛋白质[23],并参照文献[24-25]的方法提取淀粉。将去壳去皮的银杏种子在40 ℃下烘干后粉碎,过400目筛。采用正己烷脱脂(种子粉末:正己烷=1:8(质量/体积)),4 ℃下低速搅拌1 h后抽滤,重复2次。将脱脂后的种子粉末分散在蒸馏水(10%,质量/体积)中,使用1 mol/L的NaOH将pH值调节至9.0,并在室温下搅拌30 min,以8 500 r/min的转速离心15 min,收集上清液用于提取蛋白质,并刮除沉淀物表面绿色蛋白质层(剩余部分即淀粉)。重复上述操作,直至沉淀物表面无绿色蛋白质层。将淀粉用1 mol/L的HCl中和至pH值7.0,使用鼓风干燥箱在40℃下干燥24 h,研磨后过150目筛,在室温下保存备用。将上清液用1 mol/L的HCl酸化至pH值4.4,通过离心回收沉淀物,用1 mol/L的NaOH中和至pH值7.0,经冷冻干燥后获得银杏种子蛋白质。
1.2.2 T2弛豫谱检测与反演
将样品置入探头线圈后,首先通过核磁共振分析应用软件中的FID(Free Induction Decay)脉冲序列自动寻找90°脉宽P1,并校正中心频率O1,再选择CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列检测T2弛豫谱。主要参数设置如下:90°脉宽P1=6s,180°脉宽P2=12s,回波时间TE=0.25 ms,回波个数NECH=15 000,累加次数NS=12,模拟增益RG1=20 dB,数字增益DRG1=3,前置放大倍数PRG=1,频率漂移O1每次检测时自动校准。T2弛豫谱检测完成后,通过分析软件自带的SIRT方法进行反演,迭代次数设置为1 000 000。对每组样品进行3次连续的信号采集,取均值进行分析。
1.2.3 银杏种子萌发试验
本文的研究目的在于建立种子主要成分与T2反演谱之间的关联,而银杏种子的主要成分种类均相同,因此种子个体间的差异不对本文研究造成影响。本文选用20颗种子分为10组(每次检测2颗种子的共同信号)进行萌发试验,期间进行称质量及T2反演谱检测。设定第一次检测的时间为0 h,检测完成后把种子埋入盛有湿沙(相对湿度60%~80%)的培养盒中,放进人工气候箱,温度设定为30 ℃[26],湿度100%,光照12 h/d。每隔24 h将种子取出,洗去沙粒后用吸水纸擦拭掉表面的水分,静置5 min后重复上述检测,记录下种子在萌发过程中各个时刻的质量(认为种子增加的质量源于吸收的水分)、T2反演谱。检测完成后立即将种子埋入培养盒,并适量浇水,保证种子在萌发的过程中有充足的水分。萌发试验进行到胚根长出体外2 mm左右。根据式(1)计算出种子在萌发过程中各时间点的吸水率W[27],并绘制吸水率变化曲线(仅用于寻找本研究中种子萌发过程吸水规律发生明显变化的时间节点,作为T2反演谱变化过程中的典型时刻)。

式中W为银杏种子的吸水率,%;W为银杏种子t时刻的含水质量,g;0为银杏种子初始含水质量,g;0为种子初始鲜质量,g。
1.2.4 种子粉末及主要成分试样T2反演谱检测
为分析银杏种子T2反演谱各信号峰的形成机理,采集种子粉末及主要成分试样的T2反演谱,并与鲜种进行比对,检测参数见1.2.2节。称取种子粉末0.5 g,添加水分制成含水率为50%的试样(银杏种子初始含水率约为50%,下述试样采用同样的含水率)进行T2反演谱检测;称取淀粉、蛋白质、麦芽糖、油脂各0.5 g,分别添加水分制成单成分试样进行检测;另外将4种物质按照干种子中的近似质量分数(淀粉60%,蛋白质20%,麦芽糖5%,油脂10%)逐一添加,制成混合试样,每次添加物质时加入相应质量的水分并检测T2反演谱。
1.2.5 数据处理方法
使用Excel 2016和Origin 2018对数据进行计算处理并作图。
2 结果与分析
2.1 银杏种子萌发过程吸水率变化情况
银杏种子萌发过程吸水率随时间变化关系曲线见图1,数据以平均值±标准差的形式呈现。由图1可知,0~24 h种子吸水率快速增长,24~72 h吸水率增加有所减缓,72 h之后种子吸水率进入振荡阶段,直至288 h开始持续增加,随后骨质中种皮开裂(裂壳),胚根长出体外(露白)。因此,可以将银杏种子的吸水率变化大致分为4个阶段:快速吸水期(0~24 h)、慢速吸水期(24~72 h)、振荡期(72~288 h)、持续吸水期(288 h~露白)。
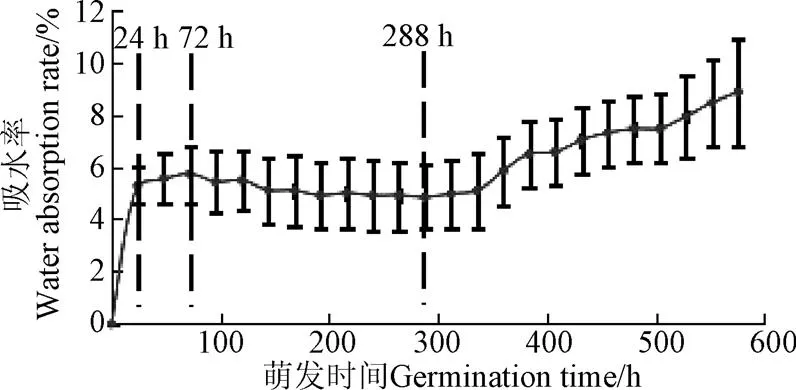
图1 银杏种子萌发过程吸水率变化
2.2 银杏种子内水分相态划分
横向弛豫时间T2反映了种子内水分与物质结合的紧密程度,T2弛豫时间越短,说明结合得越紧密,水分流动性越差。图2为银杏种子不同萌发阶段的典型T2反演谱。裂壳前,T2反演谱上存在4个波峰,各个波峰的峰面积(信号幅值)即不同相态水分对应的信号量,反映该相态水的含量。参照已有研究的划分方式[28-29],将横向弛豫时间为T21和T22(峰顶时间<10 ms)的水分分别定义为结合水A和结合水B,这2个组分的水吸附在种子内大分子有机物上,流动性较差;将横向弛豫时间为T23(10 ms<峰顶时间<100 ms)的水分定义为半结合水,这部分水受一定束缚;将横向弛豫时间为T24(峰顶时间>100 ms)的水分定义为自由水,该组分水具有较强流动性,可在细胞内外流动。需要说明的是,孙旭等[30]仅在银杏种子中检测到1种峰顶时间<10 ms的结合水,与本文的检测结果不一致。原因可能是检测参数设置不同,本文或设置了更小的回波时间(Time of Echo,TE)。TE越小,回波点越密集,能更好地采集弛豫时间短的信号;当TE设置较大时,会导致系统无法区分出短弛豫信号。
另外,在种子即将裂壳时有2个新信号峰形成,横向弛豫时间分别为T2a(峰顶时间在10 ms左右)和T2b(峰顶时间>1 000 ms),对应的信号幅值分别为A2a和A2b。随着萌发的进行,A2a、A2b均呈逐渐增大的趋势。T2a、T2b两个新信号峰的出现说明种子内部环境发生了明显变化,能够很好地预示种子即将裂壳,可作为反映种子萌发状态即将发生重要变化的“预兆峰”,在其他关于种子萌发过程的LF-NMR研究中未见有类似的“预兆峰”出现,但此类“预兆峰”是否为银杏种子特有,有待进一步探究。

注:T21、T22、T23、T24分别为结合水A、结合水B、半结合水以及自由水信号峰的横向弛豫时间;T2a、T2b为种子萌发过程中新增相态水分信号峰的横向弛豫时间。
2.3 银杏种子T2反演谱各信号峰形成机理
通过对比分析银杏鲜种与各试样的T2反演谱,探究其信号峰的形成机理。图3为银杏鲜种与单成分试样的T2反演谱,银杏种子的信号为萌发试验中样本的平均初始信号。图中以主要成分代表试样种类。由图3可知,单成分试样各信号峰的弛豫时间与种子信号差异较大。
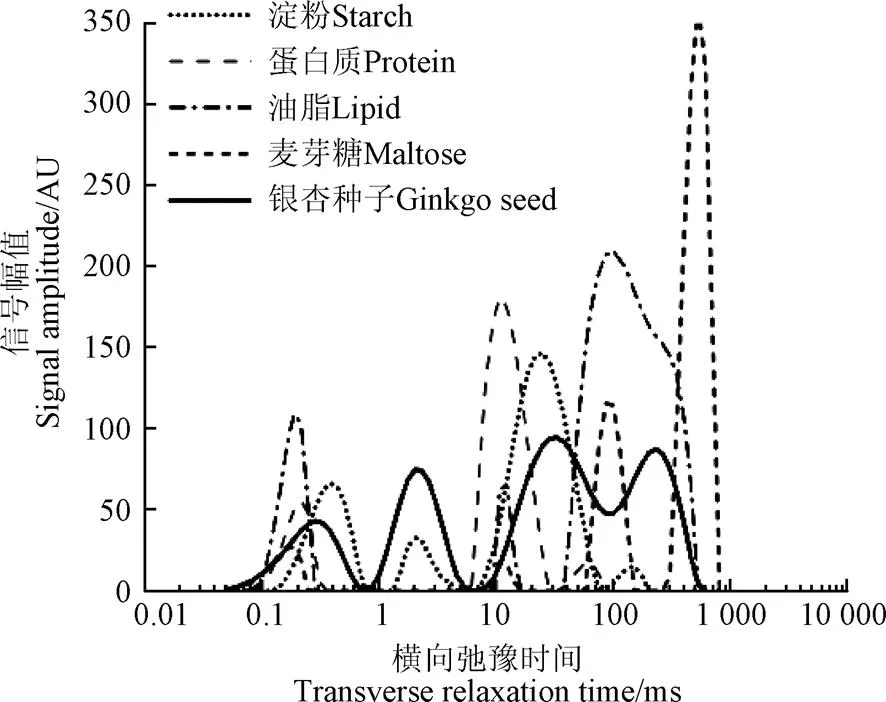
图3 银杏种子及其主要成分试样的T2反演谱
表1为银杏鲜种、种子粉末及混合成分试样各信号峰的峰顶时间及峰比例,以主要成分代表试样种类。
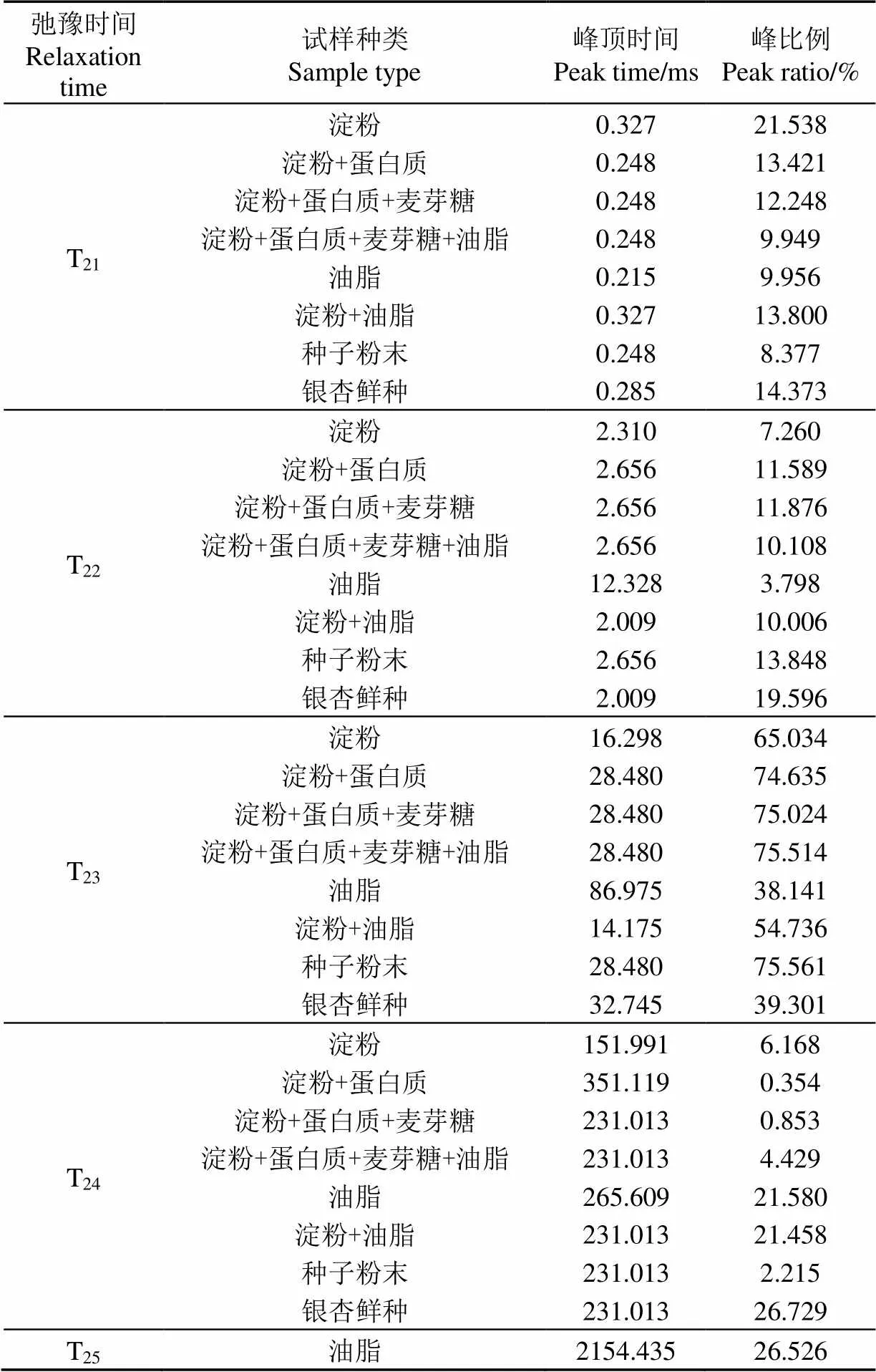
表1 银杏鲜种、种子粉末及混合成分试样各信号峰峰顶时间及峰比例
由LF-NMR的检测原理可知,水分在不同物质、组织结构的影响下表现为不同的弛豫时间[31]。由表1可知,淀粉与蛋白质混合试样的T21、T22、T23峰顶时间和种子粉末试样完全一致,后续加入麦芽糖和油脂后,这3个信号峰的峰顶时间均未发生改变,说明种子粉末试样中T21、T22、T23峰顶时间主要受淀粉和蛋白质的影响;油脂试样的T24峰顶时间为265.609 ms,加入淀粉后变为231.013 ms,和种子粉末试样一致,说明种子粉末试样的T24峰顶时间主要受淀粉和油脂的影响。然而因为尚有含量约5%的成分未提取,且混合试样与种子粉末的成分配比略有不同,因此两者的T2反演谱存在一定差异。
此外与鲜种相比,在物质成分及配比完全相同的情况下,种子粉末试样的峰T21~T24峰顶时间分别相差12.98%、32.21%、13.02%、0%,因此种子组织结构会对信号峰峰顶时间造成一定影响。
另外,银杏种子与其粉末试样的T2反演谱存在较大差异,相比鲜种,粉末试样的T21、T22峰比例分别偏少41.72%、29.33%,T23峰比例偏多92.26%,T24峰比例偏少91.71%(见表1)。虽然银杏种子与其粉末试样在成分上并无差异,但将种子烘干并粉碎的过程会破坏细胞结构,由于结合水是细胞结构的重要组成成分,重新添加水分无法将其复原,因此导致种子粉末试样T21、T22峰比例偏少。粉末试样的T23峰比例较鲜种大幅偏多是因为试样中的水分可直接与淀粉、蛋白质等物质接触,被其束缚后大量形成半结合水,而在鲜种中这些物质贮藏于细胞内的质体中,水分无法与其充分接触,因此在同样的含水率下,粉末试样的半结合水比例远高于鲜种。鲜种的T24峰比例较粉末试样大幅偏多是由于在细胞结构的维持下,有部分水受物质影响较弱,形成了可在细胞内外流动的自由水,而粉末试样中的细胞结构已被破坏,无法阻隔水分与物质的接触,因此不具备形成较多自由水的条件。
综合上述内容,种子组织结构会对信号峰峰顶时间及峰比例造成一定影响,仅从物质成分角度考虑,种子内水分的弛豫时间主要在淀粉、蛋白质的影响下表现为T21、T22、T23,在淀粉和油脂的影响下表现为T24。由此认为种子的峰T21、T22主要为吸附在淀粉和蛋白质上相态不同的结合水的信号,峰T23为主要被淀粉和蛋白质束缚后产生的半结合水的信号,峰T24主要为种子中自由水的信号(少量源自油脂)。
需要说明的是,本文的研究旨在建立T2反演谱与种子化学组分之间的关联,进而从物质成分角度解译T2反演谱,为定性分析。为得到银杏鲜种组织结构、各成分含量对T2反演谱信号峰弛豫时间及峰比例所造成影响的量化指标,需进一步开展定量研究。
2.4 银杏种子萌发过程T2反演谱各信号峰的变化趋势
种子内各相态水分含量与T2反演谱信号峰幅值呈线性关系[32]。银杏种子萌发过程不同时间节点各信号峰的峰顶时间及单位质量信号幅值见表2。为显示各相态水分信号幅值的变化规律,将其除以种子初始鲜质量(g),得到单位质量信号幅值,以U21~U24代表峰T21~T24的单位质量信号幅值。数据以平均值±标准差的形式呈现。

表2 各萌发节点信号峰峰顶时间及单位质量信号幅值
由表2可知,自萌发节点0 h至24 h(下述时间均代表萌发节点),仅U21略有减少,U22~U24均有所增加。自24 h至72 h,U21变化幅度较大,减少50.10%,U22、U24均略有减少,U23增加7.97%。自72 h至288 h,仅U23增加5.38%,其余各信号峰单位质量信号幅值均小幅度降低。从288 h至裂壳,U21小幅增加,U22降低15.33%,U23少量增加,U24增加19.98%。自种子裂壳至露白,U21无明显变化,U22略有增加,U23迅速增加16.70%,U24少量减少。可见在银杏种子萌发过程中,U23增加最多(43.99%),其余各信号峰单位质量信号幅值均呈不同幅度的波动。另外,T21弛豫时间有较大幅度的波动(自0 h至24 h减小36.61%,自24 h至72 h增加170.42%),其余各信号峰弛豫时间整体上缓慢增加。
3 讨 论
本文重点从物质成分角度对银杏种子萌发过程中T2反演谱的变化进行讨论。在萌发过程中种子内部发生了复杂的水交换过程,涉及到一系列物质转化与生理变化,在此期间T2反演谱的变化能够反映种子内水分相态转化、大分子分解(淀粉,蛋白质)、新蛋白质合成以及含水量增加等情况[20],另外新信号峰的出现能够预示种子萌发状态即将发生重要变化。对银杏种子萌发过程T2反演谱的初步解译如下。
3.1 信号峰幅值及弛豫时间变化原因
种子吸水率在最初24 h迅速增加的主要原因可归结为与生命活动无关的纯物理现象[33],在此阶段种子内淀粉、蛋白质等亲水胶体大量吸水,种子整体含水量迅速提升,因此U22、U23、U24随萌发节点均有所增加。U21减少可能是因为结合水A向其它组分转化:水分进入胚乳后,种子的代谢能力被激活,吸附在大分子物质上的部分结合水A开始转化为半结合水,与宋平等[15]的观点类似;另一方面,结合水A受束缚程度增强,弛豫时间大幅缩短。
快速吸水期过后,种子被动吸水的能力逐渐下降,但在接下来的阶段,种子生理活动并未随吸水率降低而减弱。慢速吸水期结合水A大量转化为半结合水,U21大幅减少,同时其自由度提高,弛豫时间大幅增加。可见在萌发的0~72 h银杏种子内部环境发生较大变化,直至振荡期峰T21弛豫时间和单位质量信号幅值迅速变化的趋势才明显减缓。
自24~288 h,U22、U24持续小幅度减少,U23快速增加。这段时间内种子整体含水率变化幅度较小,但种子内部的生理活动仍较为旺盛。种子代谢需要自由水的参与,但由于吸水率停滞,自由水未能得到补充(在此期间种子吸收的水分主要转化为了半结合水),U24有所减少。U23增加、U22减少或因淀粉与蛋白质在此阶段大量吸水并逐渐开始被水解:种子在萌发过程中需要将贮藏的淀粉和蛋白质分解成小分子糖类和氨基酸,为胚的生长发育提供所需营养和材料,在此阶段这些物质大量吸水,以备水解所需,水分被束缚后即形成半结合水;同时有部分淀粉和蛋白质已开始水解,结合水B主要通过氢键与淀粉、蛋白质中的极性基团互相作用,形成水胶体[30],水解过程中淀粉与蛋白质的结构发生变化,或导致吸附其上的结合水B减少。此外如前所述,慢速吸水期有部分结合水A转化为半结合水,导致U23增加。
脱离振荡期后,种子代谢能力迅速增强,吸水率得以增加,胚进入快速生长发育阶段(288 h~裂壳),但此时种子吸收的水分不再大量转化为半结合水,U23增加趋势停滞。该阶段增加最多的组分为自由水,自由水是良好的溶剂,其含量增加表明种子代谢进入了一个十分旺盛的时期。期间淀粉酶、蛋白酶的总体活性不断增强,加快淀粉和蛋白质的分解速率。这些物质快速分解导致吸附其上的结合水B含量迅速降低,U22大幅减少。此外,银杏种子在胚快速生长的过程中会合成新的蛋白质[34],该阶段U21少量增加以及裂壳至露白期间U22少量增加或与新蛋白质合成有关。
种子裂壳至露白期间,-淀粉酶、肽酶、硝酸还原酶活性达到最大[34]。各类酶活性的增强加速了种子内物质转化和代谢活动,为胚芽生长提供足够的能量和所需氨基酸,该阶段种子吸收的水分主要被淀粉、蛋白质束缚形成半结合水,致使U23大幅增加而U24有所减少。
在整个萌发过程中,种子所有信号峰的弛豫时间整体上均呈增加趋势,且除T21外无明显波动。弛豫时间增加说明水分自由度提高,可能是由于萌发过程中种子不断吸水、物质浓度降低,导致物质对水分的束缚减弱。
3.2 新信号峰形成原因
由图2可知,在裂壳前种子T2反演谱上有T2a、T2b两个新信号峰形成,说明种子内部环境发生了明显变化。新信号峰形成原因分析如下:一方面,胚乳中蛋白质、淀粉等物质水解后,其水解产物使与之结合的水分弛豫时间或分别表现为T2a、T2b;另外,在萌发过程中种子内有新蛋白质合成,水分与之结合后弛豫时间或表现为T2a。随着萌发过程的进行,A2a和A2b均逐渐增大,能够很好地预示种子即将裂壳(T2a更为明显),因此这两个新增信号峰可作为反映种子萌发状态即将发生重要变化的“预兆峰”。
4 结 论
1)通过对比分析银杏鲜种、种子粉末及其主要成分试样的T2反演谱,研究各信号峰的形成机理。研究表明:淀粉与蛋白质混合试样T2反演谱的峰T21、T22、T23以及淀粉与油脂混合试样的峰T24在峰顶时间上和种子粉末试样相对应信号峰完全一致;在物质成分及配比完全相同的情况下,种子粉末试样T2反演谱的峰T21~T24的峰顶时间较鲜种分别相差12.98%、32.21%、13.02%、0%,T21、T22峰比例较鲜种分别偏少41.72%、29.33%,T23峰比例偏多92.26%,T24峰比例偏少91.71%,说明种子组织结构会对其内部水分的弛豫时间和相态分布比例造成一定影响。仅从物质成分角度考虑,种子内水分的弛豫时间主要在淀粉、蛋白质的影响下表现为T21、T22、T23,在淀粉和油脂的影响下表现为T24。由此认为峰T21、T22主要为吸附在淀粉和蛋白质上相态不同的结合水的信号,峰T23为主要被淀粉和蛋白质束缚后产生的半结合水的信号,峰T24主要为种子中自由水的信号(少量源自油脂)。
2)在裂壳前银杏种子T2反演谱上有T2a(峰顶时间在10 ms左右)、T2b(峰顶时间>1 000 ms)两个新信号峰形成。T2a、T2b两个新信号峰的出现说明种子内部环境发生了明显变化,能够很好地预示种子即将裂壳,可作为反映种子萌发状态即将发生重要变化的“预兆峰”。
3)银杏种子萌发过程的T2反演谱检测发现,各相态水分信号量在萌发过程中呈现互异的变化规律,其中半结合水信号量持续增加,其余各相态水分信号量以不同幅度波动;所有信号峰的弛豫时间整体上均呈增加趋势,除T21外无明显波动。
本文研究了银杏种子T2反演谱各信号峰的形成机理,提出了一种从化学组分及核磁检测原理角度对种子萌发过程中的T2反演谱进行解译的新方法,从而为基于LF-NMR方法对种子萌发过程中的化学组分变化进行活体分析提供参考。
[1] Cho H K, Kim S, Lee E J, et al. Neuroprotective effect of ginkgo biloba extract against hypoxic retinal ganglion cell degeneration in vitro and in vivo[J]. Journal of medicinal food, 2019, 22(8): 771-778.
[2] Li T H, Zhang Y Y, Tian J W, et al. Ginkgo biloba pretreatment attenuates myocardial ischemia-reperfusion injury via mitoBKCa[J]. The American journal of Chinese medicine, 2019, 47(5): 1057-1073.
[3] Wang G X, Cao F L, Chen J. Progress in researches on the pharmaceutical mechanism and clinical application of ginkgo biloba extract on various kinds of diseases[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2006, 12(3): 234-239.
[4] 马文祥. 银杏发展态势及其价值分析[J]. 生物学杂志,2003,20(4):34-35.
Ma Wenxiang. Developing situation and the value analyses of Ginkgo Biloba L.[J]. Journal of Biology, 2003, 20(4): 34-35. (in Chinese with English abstract)
[5] 辜夕容,江亚男,倪亚兰,等. 叶用银杏的良种选育与定向培育研究进展[J]. 中草药,2017,48(15):3218-3227.
Gu Xirong, Jiang Yanan, Ni Yalan, et al. Research progress on breeding and cultivation of Ginkgo biloba for leaf use in China[J]. Chinese Traditional and Herbal Drugs, 2017, 48(15): 3218-3227. (in Chinese with English abstract)
[6] Maureen D, Isabel S A, Guillaume D, et al. LF1H NMR T2relaxation rate as affected by water addition, NaCl and pH in fresh, frozen and cooked minced hake[J]. Food chemistry, 2019, 277: 229-237.
[7] Qian X. Drying process of sodium alginate edible films forming solutions studied by LF NMR[J]. Food Chemistry, 2018, 250: 83-88.
[8] 程天赋,俞龙浩,蒋奕,等. 基于低场核磁共振探究解冻过程中肌原纤维水对鸡肉食用品质的影响[J]. 食品科学,2019,40(9):16-22.
Chen Tianfu, Yu Longhao, Jiang Yi, et al. Effect of myofibrillar water on chicken quality during thawing as studied by low-field nuclear magnetic resonance[J]. Food Science, 2019, 40(9): 16-22. (in Chinese with English abstract)
[9] 梁钻好,陈海强,梁凤雪,等. 液浸速冻对牡蛎水分迁移及品质的影响[J]. 食品科学,2019,40(23):233-238.
Liang Zuanhao, Chen Haiqiang, Liang Fengxue, et al. Impact of immersion freezing on oyster quality and water migration[J]. Food Science, 2019, 40(23): 233-238. (in Chinese with English abstract)
[10] Rao B Q, Su X Y, Qiu S X, et al. Meso-mechanism of mechanical dewatering of municipal sludge based on low-field nuclear magnetic resonance[J]. Water research, 2019, 162: 161-169.
[11] Carlos M, Bulat G, Siegfried S. Dynamics of ionic liquids in poly (vinyl alcohol) porous scaffold. Low field NMR study[J]. Magnetic Resonance Imaging, 2019, 56: 126-130.
[12] 孙振平,穆帆远,康旺,等. 纤维素醚改性硫铝酸盐水泥浆体中可蒸发水的1H低场核磁弛豫特征[J]. 硅酸盐学报,2019,47(8):1109-1115.
Sun Zhenping, Mu Fanyuan, Kang Wang, et al.1H low-field NMR relaxation characteristics of evaporable water in hydroxyethyl methyl cellulose ether modified calcium sulfoaluminate cement[J]. Journal of theChinese Ceramic Society, 2019, 47(8): 1109-1115. (in Chinese with English abstract)
[13] 热依拉·阿布都瓦依提,马凤云,张翔,等. 低场核磁共振技术在煤炭岩相孔隙结构中的应用[J]. 核技术,2017,40(12):47-52.
Rahila·Abduwahit, Ma Fengyun, Zhang Xiang, et al. Application of low-field nuclear magnetic resonance technology in coal petrographic pore structure[J]. Nuclear Techniques, 2017, 40(12): 47-52. (in Chinese with English abstract)
[14] 姚艳斌,刘大锰. 基于核磁共振弛豫谱技术的页岩储层物性与流体特征研究[J]. 煤炭学报,2018,43(1):181-189.
Yao Yanbin, Liu Dameng. Petrophysical properties and fluids transportation in gas shale: A NMR relaxation spectrum analysis method[J]. Journal of China Coal Society, 2018, 43(1): 181-189. (in Chinese with English abstract)
[15] 宋平,彭宇飞,王桂红,等. 玉米种子萌发过程内部水分流动规律的低场核磁共振检测[J]. 农业工程学报,2018,34(10):274-281.
Song Ping, Peng Yufei, Wang Guihong, et al. Detection of internal water flow in germinating corn seeds based on low field nuclear magnetic resonance[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(10): 274-281. (in Chinese with English abstract)
[16] 杨洪伟,张丽颖,纪建伟,等. 低场核磁共振分析聚乙二醇对萌发期水稻种子水分吸收的影响[J]. 农业工程学报,2018,34(17):276-283.
Yang Hongwei, Zhang Liying, Ji Jianwei, et al. Analysis on water absorption of rice seeds during germination process under polyethylene glycol solution using low-field nuclear magnetic resonance[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(17): 276-283. (in Chinese with English abstract)
[17] 牟红梅,何建强,邢建军,等. 小麦灌浆过程籽粒水分变化的核磁共振检测[J]. 农业工程学报,2016,32(8):98-104.
Mou Hongmei, He Jianqiang, Xing Jianjun, et al. Water changes in wheat spike during grain filling stage investigated by nuclear magnetic resonance[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(8): 98-104. (in Chinese with English abstract)
[18] Garnczarska M, Zalewski T, Kempka M. Water uptake and distribution in germinating lupine seeds studied by magnetic resonance imaging and NMR spectroscopy[J]. Physiologia Plantarum, 2007, 130(1): 23-32.
[19] Katarzyna L, Szymon K, Łukasz W, et al. New insight on water status in germinating brassica napus seeds in relation to priming-improved germination[J]. International Journal of Molecular Sciences, 2019, 20(3): 540-563.
[20] Lahaye M, Falourd X, Limami A M, et al. Water mobility and microstructure evolution in the germinating Medicago truncatula seed studied by NMR relaxometry. A revisited interpretation of multicomponent relaxation[J]. Journal of Agricultural and Food Chemistry, 2015, 63(6): 1698-1710.
[21] Wojtyla Ł, Garnczarska M, Zalewski T, et al. A comparative study of water distribution, free radical production and activation of antioxidative metabolism in germinating pea seeds[J]. Journal of Plant Physiology, 2006, 163(12): 1207.
[22] 食品中脂肪的测定, GB 5009.6-2016[S]. 北京:中国标准出版社.
[23] Chavan U D, McKenzie D B, Shahidi F. Functional properties of protein isolates from beach pea (L.)[J]. Food Chemistry, 2001, 74(2): 177-187.
[24] 赖小玲,何春林,黄义,等. 菠萝蜜种子淀粉提取及其理化性质的研究[J]. 食品与发酵工业,2006,32(10):132-136.
Lai Xiaoling, He Chunlin, Huang Yi, et al. Starch extraction and its characteristics of jack-fruit seeds[J]. Food and Fermentation Industries, 2006, 32(10): 132-136. (in Chinese with English abstract)
[25] Zheng Y, Zhang H X, Yao C, et al. Study on physicochemical and in-vitro enzymatic hydrolysis properties of ginkgo (Ginkgo biloba) starch[J]. Food Hydrocolloids, 2015, 48: 312-319.
[26] Feng J, Shen Y B, Shi F H, et al. Embryo development, seed germination, and the kind of dormancy ofL.[J]. Forests, 2018, 9(11): 700-714.
[27] 要世瑾,牟红梅,杜光源,等. 小麦种子吸胀萌发过程的核磁共振检测研究[J]. 农业机械学报,2015,46(11):266-274.
Yao Shijin, Mou Hongmei, Du Guangyuan, et al. Water imbibition and germination of wheat seed with nuclear magnetic resonance[J]. Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(11): 266-274. (in Chinese with English abstract)
[28] 张绪坤,祝树森,黄俭花,等. 用低场核磁分析胡萝卜切片干燥过程的内部水分变化[J]. 农业工程学报,2012,28(22):282-287.
Zhang Xukun, Zhu Shusen, Huang Jianhua, et al. Analysis on internal moisture changes of carrot slices during drying process using low-field NMR[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012, 28(22): 282-287. (in Chinese with English abstract)
[29] 刘潇,沈飞,黄怡,等. 基于LF-NMR的糙米发芽过程水分状态变化[J]. 中国粮油学报,2018,33(4):7-12.
Liu Xiao, Shen Fei, Huang Yi, et al. Moisture state change brown rice during soaking and germination process by LF-NMR[J]. Journal of the Chinese Cereals and Oils Association, 2018, 33(4): 7-12. (in Chinese with English abstract)
[30] 孙旭,姜东,徐莉,等. 银杏白果干燥过程中水分分布及迁移的变化[J]. 南京林业大学学报:自然科学版,2019,43(6):188-192.
Sun Xu, Jiang Dong, Xu Li, et al. Moisture distribution and migration of Ginkgo biloba seeds during air drying process[J]. Journal of Nanjing Forestry University: Natural Science Edition, 2019, 43(6): 188-192. (in Chinese with English abstract)
[31] McDonnell K C, Allen P, Duggan E, et al. The effect of salt and fibre direction on water dynamics, distribution and mobility in pork muscle: A low field NMR study[J]. Meat Science, 2013, 95(1): 51-58.
[32] 要世瑾,杜光源,牟红梅,等. 基于核磁共振技术检测小麦植株水分分布和变化规律[J]. 农业工程学报,2014,30(24):177-186.
Yao Shijin, Du Guangyuan, Mou Hongmei, et al. Detection of water distribution and dynamics in body of winter wheat based on nuclear magnetic resonance[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014, 30(24): 177-186. (in Chinese with English abstract)
[33] Bewley J D, Black M. Seeds: Physiology of Development and Germination[M]. New York: Plenum Press, 1985.
[34] 李生平. 银杏种子萌发过程中贮藏物质代谢机理的研究[D]. 南京:南京林业大学,2004.
Li Shengping. Studies on Mechanism of Storage Substance Metabolize of Gingko Biloba Seeds during Germination[D]. Nanjing: Nanjing Forestry Univeristy, 2004. (in Chinese with English abstract)
Preliminary study on interpretation of LF-NMR T2inversion spectrum of ginkgo biloba seed during germination process
Zhao Maocheng1,2, Gu Sheng1, Wang Xiwei1, Wang Guibin3, Li Zhong4
(1.210037; 2.225300,; 3.210037,; 4.210037,)
With the development of science and technology, low field nuclear magnetic resonance (LF-NMR) is increasingly used in agriculture.At present, the interpretation of the transverse relaxation time (T2) inversion spectrum stays at the level of the water phase state distribution in the measured sample. It is beneficial to connect the T2inversion spectrum to the chemical composition of test subject. In order to find such a connection as the substance-oriented interpretation of the T2inversion spectrum,LF-NMR was applied for 20 ginkgo biloba (L.) seeds during germination that divided into 10 groups. Temporal observation of ginkgo biloba seeds over the germination process were carried out in vivo using LF-NMR. Their T2inversion spectra were collected and compared with those from the reference samples that made from seed powder or different mixtures of the main ingredients of ginkgo biloba seeds to explore the forming mechanism of the signal peaks of T2inversion spectra for a viable interpretation from the perspective of substances. Analysis of the T2inversion spectra of ginkgo biloba seeds indicated that water in live ginkgo biloba seed could be divided into 4 phase states according to T2, including 2 distinctive bound water of different kinetic activity with transverse relaxation times spiking at T21and T22, semi-bound water spiking at T23, and free water at T24. The peak T21, T22, T23of the T2inversion spectrum of the starch and protein mixed sample and the peak T24of the starch and oil mixed sample were exactly the same as the corresponding signal peaks of the seed powder sample in terms of peak time. When the material composition and the ratio were completely the same, the peak times of the peak T21-T24of the T2inversion spectrum of the seed powder sample were 12.98%, 32.21%, 13.02% and 0% different from those of the fresh seed, respectively. The proportions of peak T21and T22are 41.72% and 29.33% less than those of fresh species, respectively, the proportion of peak T23is 92.26% higher, and the proportion of peak T24is 91.71% lower. This showed that the seed tissue structure would affect the relaxation time and phase distribution ratio of its internal water to a certain extent. Only from the perspective of material composition, the water in seed was mainly expressed as relaxation time T21, T22, T23under the influence of starch and protein, and T24under the influence of starch and lipid. Therefore, it was believed that peak T21and T22was the signal of bound water (their phases are different) that mainly adsorbed on starch and protein, peak T23is the signal of semi-bound water that mainly fettered by starch and protein, and peak T24is mainly the signal of free water in seed (a small amount derived from lipid). Results of the temporal observation over the germination process found an interesting pattern of change regarding the water phase states in live seeds. While the unit mass signal amplitude of semi-bound water on a monotonous rise and the rest phase states fluctuate over time, the relaxation time of all signal peaks showed an increasing trend on the whole, and there was no significant fluctuation except T21. What’s more, 2 new signal peaks that spiking at T2a(around 10 ms) and T2b(over 1 000 ms) developed when a seed approaches the stage of seed-split and the spikes continued to grow ever since. We called them the “prophet spikes” for they foretell an important change in the seed and was about to split. The approach supply a new angle to interpret T2inversion spectra with chemical and NMR detection principle insights and a new reference for in vivo analysis of chemical composition changes during seed germination based on LF-NMR method.
nuclear magnetic resonance; seed; water; T2inversion spectrum; interpretation; germination process
赵茂程,顾盛,汪希伟,等. 银杏种子萌发过程低场核磁共振T2反演谱解译初探[J]. 农业工程学报,2020,36(15):317-324.doi:10.11975/j.issn.1002-6819.2020.15.038 http://www.tcsae.org
Zhao Maocheng, Gu Sheng, Wang Xiwei, et al. Preliminary study on interpretation of LF-NMR T2inversion spectrum of ginkgo biloba seed during germination process[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(15): 317-324. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.15.038 http://www.tcsae.org
2020-02-18
2020-08-10
国家自然科学基金面上项目(31570714)
赵茂程,教授,博士生导师,主要从事无损检测与图像处理、现代机械设计理论与方法研究。Email:mczhao@njfu.edu.cn
10.11975/j.issn.1002-6819.2020.15.038
S351.5+1
A
1002-6819(2020)-15-0317-08
