钛铁矿精矿碳热还原制取碳氧化钛(TiCxO1-x)物相演化机理研究
2020-09-19何春林郑春慧韦悦周
戴 蔚 何春林,2 郑春慧 韦悦周,2,3 李 杰 赵 健
(1.广西大学资源环境与材料学院,广西 南宁 530004;2.广西有色金属及特色材料加工重点实验室,广西 南宁 530004;3.上海交通大学核科学与技术学院,上海 200240)
钛及其合金具有优异的物理、化学性能,具有密度小、强度高、耐高温和耐腐蚀等特性,是重要的轻型结构材料、新型功能材料[1]。钛材料广泛应用于航空航天、军工及化工、船舶、建筑、体育器材、医疗器械、生物医学等领域,被誉为“未来金属”、“第三金属”[2]。钛在矿物中主要以TiO2和钛酸盐形式存在,经常与铁共生。含钛矿物主要有钛铁矿、钛磁铁矿、钒钛磁铁矿和金红石等[3]。目前,金属钛制备技术主要有镁热还原法(Kroll法)和钠热还原法(Hunter法)、剑桥工艺法(FFC法)、OS(Ono Suzuki)法、EMR/MSE 法、PRP(Preform Reduction Proces)工艺、USTB(University of Science and Technology Beijing)工艺、SOM法和离子液体电析法等[4-12]。其中,Kroll法和Hunter法已实现工业化,但Kroll法存在工艺复杂、能耗大、成本高和环境污染等缺点,使金属钛的开发与利用受到很大限制;Hunter法虽然在还原剂的生产、运输和贮存等方面的成本较镁还原法低,但生产得到的海绵钛熔铸性能差、氯含量较高,而且钛的回收率较低,因此总的成本较镁热还原法高,使其在工业应用过程中也受到限制[12]。目前,最具研究优势的是USTB工艺,该工艺是朱鸿民研究团队于2006年在可溶性阳极材料的基础上开发的一种新的电解还原制取金属钛的技术[13-19],在一定程度上克服了其他方法的缺点,可显著提高电流效率,减少杂质元素带入,提高电解钛金属的品质。
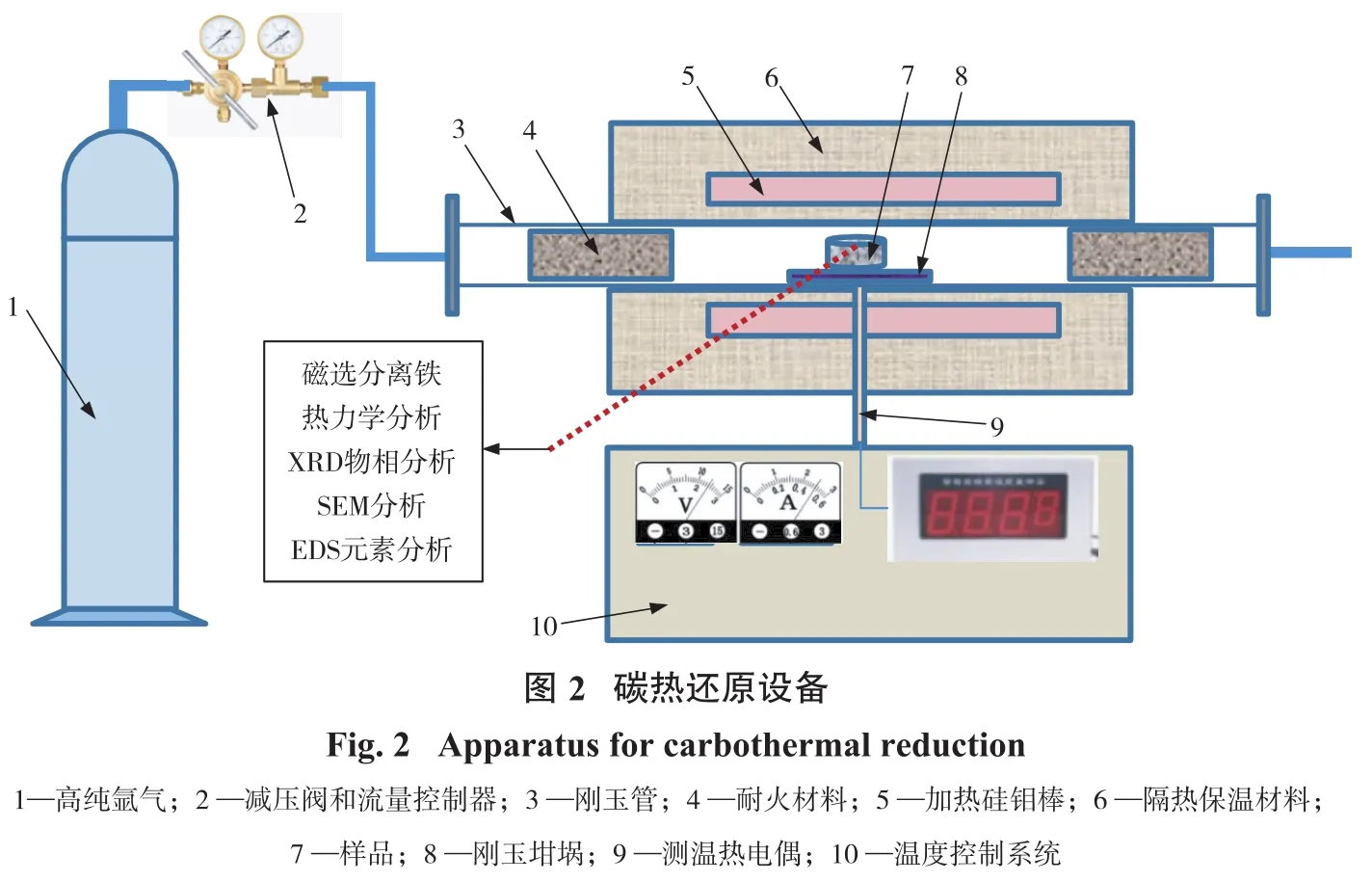
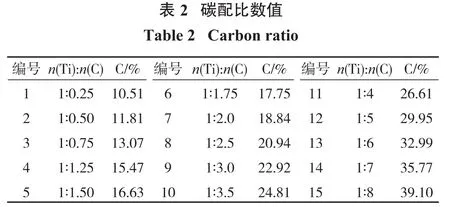
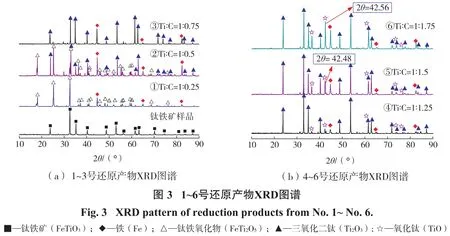
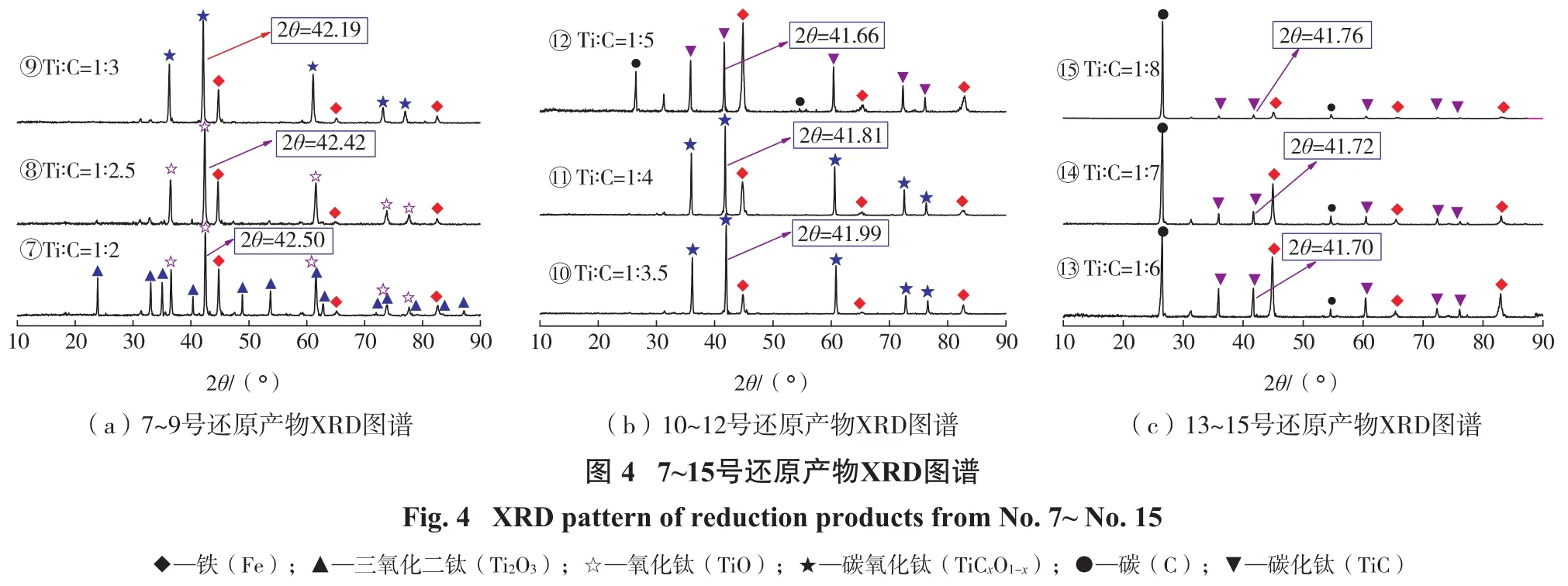
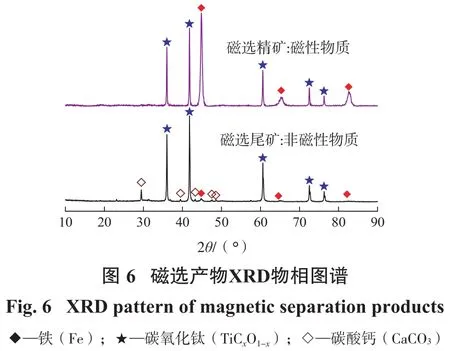
USTB新工艺的关键之一是制取合格高品质的碳氧化钛(TiCxOy(其中x+y=1)或 TiCxO1-x(其中 0 试验样品取自广西某钛业公司浮选钛铁精矿。还原剂为分析纯级别的石墨粉。钛铁精矿XRD衍射图谱如图1(a)所示,扫描电镜和能谱结果如图1(b)所示。钛铁精矿中各元素含量的X射线荧光光谱(XRF-1800,Shimadzu,Japan)分析结果如表1所示。 由图1可知,原矿中主要物相是钛铁矿(FeTiO3)。表1显示样品中TiO2和Fe2O3的含量分别为44.18%、45.74%,主要杂质成分为SiO2、MgO、Al2O3、CaO。 试验探究碳热还原反应的碳配比对制备还原产物物相变化的影响,采用X射线衍射和扫描电镜及能谱等手段研究碳热还原产物的组成及微观结构特征,并利用热力学分析软件HSC Chemistry 6.0进行吉布斯自由能变化的计算[20,21],结合物相测试结果从热力学角度分析讨论碳热还原反应机理。 试验步骤:固定钛铁精矿样的样品质量为10 g,按照Ti和C的摩尔比计算碳的质量并使用万分之一的电子天平称取相应质量的石墨粉。将称取好的石墨粉末与钛铁矿精矿粉在玛瑙研钵中研磨直至混合均匀,然后利用四柱油压机以8 MPa的压力进行样品压制15 min,压制成形后的块状样品直径为20 mm、高度为6 mm。之后,将压制好的样品放置于管式气氛炉中,设定升温速度、还原温度和保温时间进行相应的还原试验,还原在氩气气氛下进行,设备见图2所示。还原后利用磁选管对磁性物质进行磁选分离,对还原样品、磁选精矿和尾矿进行XRD物相、扫描电镜和能谱等分析。 试验研究碳配比对还原钛铁精矿的影响,分析碳还原钛铁精矿反应过程物相的变化趋势及其反应原理。试验条件:按照Ti和C的摩尔比来确定碳的配比,试验中钛与碳的摩尔比范围为1∶0.25~1∶8,即碳和钛铁精矿混合物中碳的质量分数范围为10.51%~39.10%,如表2所示。试验还原反应温度设定为1 550℃,还原时间为4 h(保温时间)。达到设定还原时间时停止保温,待样品在管式炉中冷却后取出还原后的样品,将样品研磨制样进行XRD物相、扫描电镜和能谱等分析;而后进行磁选试验(粒度-200目100%),再对磁选的精矿和尾矿进行表征分析。 2.1.1 还原产物物相分析 不同碳配比条件下钛铁精矿还原产物的XRD物相图谱如图3、图4所示。 从图3(a)可以看出:在碳配比较低的条件下(样品1~3号),FeTiO3首先被还原成FeTi2O5和单质Fe;随着碳配比的进一步增加,即当n(Ti)∶n(C)为1∶0.5时,还原产物出现新物相Ti2O3,说明此时部分FeTi2O5被进一步还原成Ti2O3。当n(Ti)∶n(C)为1∶0.75时,物相FeTi2O5的特征峰消失,FeTi2O5全部转化为Ti2O3和单质Fe。图3(b)可以看出:继续增大碳配比,XRD图谱中出现TiO的特征峰,而单质Fe未发生改变,不与其他物质反应;随着碳配比增加,Ti2O3特征峰值减小,TiO的特征峰值增大,TiO的2θ特征峰出现在42.48°~42.56°;n(Ti)∶n(C)为1∶1.75时,Ti2O3的特征峰依然存在,FeTi2O5转变为Ti2O3、TiO、Fe。 由图4(a)可知:当n(Ti)∶n(C)为1∶2.5时,Ti2O3的特征峰完全消失,此时还原产物主要为TiO和单质Fe;当n(Ti)∶n(C)为1∶3时,还原产物的特征峰2θ值从42.42°微移至42.19°,说明新物相TiCxO1-x出现[22,23]。从图4(b)可知,继续增大碳配比,还原产物的特征峰2θ值持续减小,说明TiCxO1-x中碳含量在增加而氧含量在减少,直至n(Ti):n(C)为1∶5时,出现碳的特征峰说明碳过量。由图4(c)可知碳过量后,XRD图谱中TiC的特征峰2θ值稳定在41.7°,说明TiC的2θ特征峰值位置在41.7°,此时TiCxO1-x被完全还原成TiC。 图5为还原产物物相中出现TiO、TiC和TiCxO1-x的XRD图中2θ值在41.7°~42.5°范围的特征峰合并对比图(样品7~13号)。 根据软件 jade 6分析以及文献资料[22,23]可知:图5中7号和8号的还原产物在2θ=42.42°~42.5°的峰值为TiO的特征峰,而12号和13号的还原产物在2θ=41.66°~41.7°的峰值对应TiC的特征峰,9号~11号的还原产物的2θ特征峰值位置落在42.42°和41.7°之间。由此,推测TiCxO1-x的2θ特征峰值位置越大者,TiCxO1-x中的含氧量越大,随着碳配比的增加,TiCxO1-x逐渐被还原,其氧的比例减少而碳的比例增加。因此,当石墨的配比质量分数为22.92%~26.61%时,在1 550℃氩气气氛下还原4 h可以得到TiCxO1-x。 综上可知,随着碳配比的增加,还原过程出现的主要物相为:FeTi2O5、Ti2O3、Fe、TiO、TiCxO1-x、TiC 等。还原后期主要是TiO向TiC进行转化,当碳配比质量为22.92%~26.61%时可以还原得到中间产物TiCxO1-x。钛铁矿碳热还原反应产物随着碳配比的增加物相的演化规律为:FeTiO3→FeTi2O5→Ti2O3+Fe→TiO+Fe→TiCxO1-x+Fe→TiC+Fe。 2.1.2 磁选产物物相和SEM-EDS分析 经磁选分离的磁性和非磁性产物的XRD物相如图6所示。 从图6可以看出:非磁性物质主要物相为碳氧化钛,少量杂质碳酸钙;磁性物质主要物相为铁和碳氧化钛,并且铁的特征峰强度增强。磁选精矿铁和碳氧化钛二次分离问题有待后续深入研究。 还原产物SEM表观形貌和EDS元素分析结果分别如图7和图8所示。 从图7可以看出,还原产物非磁性物质碳氧化钛形貌为小块状,磁性产物铁的形貌为近似球形,说明高温下FeTiO3中的铁被还原以液滴形态长大形成小球形。 从图8可以看出:磁选后非磁性碳氧化钛的主要元素为Ti、C、O,而Fe、Mg、Ca、Mg、Al含量低,说明磁选脱除大部分的铁;球形颗粒表面主要元素为Fe、O,少量Ti、C。 根据以上还原产物的存在形式,表3列出了石墨和钛铁矿精矿在高温下可能发生的反应。为了了解碳热还原钛铁矿反应的历程和温度的影响,揭示还原过程反应机理和物相演化规律,利用HSC软件计算得到了钛铁矿碳热还原过程可能发生的反应方程(表3)以及相关反应的标准吉布斯自由能与温度(25~1 600℃)的关系,结果如图9所示。 因为HSC软件和文献资料中并无TiCxO1-x的热力学数据,但根据以上结果可知TiCxO1-x是由TiO或Ti2O3逐步还原得到,还原彻底时转变为TiC,即物相变化过程为TiO/Ti2O3→TiCxO1-x→TiC,因此可以根据TiO/Ti2O3转化TiC的过程解析TiCxO1-x生产过程的热力问题。 根据以碳为还原剂时钛铁矿精矿及产物ΔG⊖-T变化趋势可知,在一定的温度下,当ΔG⊖小于零时上述反应才可能发生。由图9可知,随着温度的升高,ΔG⊖值越负的反应其还原反应的驱动力越大,温度升高对反应的进行越有利,各阶段还原产物才可能进一步被还原。 结合图9(a)和表3的反应可知:当温度高于725℃、775℃、925℃时,式(2)、式(1)、式(3)的ΔG⊖小于零,FeTiO3和FeTi2O5的还原反应开始进行,主要生成FeTi2O5、Ti2O3和TiO;当温度高于1 175 ℃、1 325 ℃时,式(5)、式(6)的ΔG⊖小于零,TiO和Ti2O3开始被还原成TiC并根据碳量大小按照式(5)、式(6)进行;当温度高于1 600℃时,Ti2O3才能按照式(4)进行反应生成TiO,而在本实验中还原温度为1 550℃,式(4)无法进行,Ti2O3的热力学稳定性比TiO强,在此温度下Ti2O3无法被碳还原成TiO。 从图9(b)可以看出:当温度高于818 ℃,式(9)的ΔG⊖小于零,反应式(9)开始进行,加速FeTi2O5还原的进行,产生Ti2O3;当温度高于1 170℃时,式(8)的ΔG⊖小于零,反应式(8)开始进行,但因ΔG⊖绝对值很小,反应进行的驱动力可能很小;当温度高于1 373℃时,式(10)的ΔG⊖小于零,反应式(10)开始进行,加速FeTi2O5还原成Fe和TiO。在25~1 600℃范围内式(11)、(12)和(13)的ΔG⊖均大于零,它们的反应无法进行,即在实验温度1 550℃下,TiO和Ti2O3无法被CO还原成TiC。 综上可知,碳热还原钛铁精矿的初期和中期过程固定碳和CO均参与还原过程,随着碳配比的增加,Ti2O3含量的变化主要是受式(2)、(6)和(9)的影响,还原产物中的TiO主要来源于式(3)和(10)的还原反应,当n(Ti):n(C)=1∶2.5时,式(3)和式(10)为主要反应,产物基本为TiO。当控制碳配比在一定合适范围时,其后期还原反应主要为TiO/Ti2O3+C→TiCxO1-x+CO,生成的碳氧化钛TiCxO1-x的ΔG⊖介于TiC和TiO之间,属于不完全还原状态。后期反应生成TiCxO1-x或TiC过程主要是固定碳起还原作用,CO无法起到还原作用。 (1)以石墨对钛铁精矿进行碳热还原,利用XRD、SEM-EDS等分析手段对还原产物物相、形貌和表面元素分析。结果表明,还原过程物相主要为:FeTi2O5、Ti2O3、Fe、TiO、TiCxO1-x、TiC等。 (2)当石墨的配比质量分数为22.92%~26.61%时,1 550℃氩气气氛下还原4 h可以得到TiCxO1-x,还原反应热力学和物相分析表明整个还原过程主要是固相C参与还原,CO还原作用小,物相演化规律为FeTiO3→FeTi2O5→Ti2O3+Fe→TiO+Fe→TiCxO1-x+Fe。 (3)钛铁精矿初期和中期还原过程固定碳和CO均参与还原过程,后期反应生成TiCxO1-x过程主要是固定碳起还原作用,CO无法起到还原作用。而还原生成碳氧化钛TiCxO1-x的ΔG⊖介于TiC和TiO之间,属于不完全还原状态,主要通过控制碳配比量在反应温度内即可还原得到碳氧化钛。1 试验部分
1.1 试验原料

1.2 试验方法及步骤
2 试验结果与讨论
2.1 碳热还原试验


2.2 还原热力学分析


3 结论
