抗中性粒细胞胞浆抗体相关性血管炎伴肾功能异常患者的临床与病理特征分析
2020-09-18汤海莲李建军董洪方陈光磊张文生马路
汤海莲 李建军 董洪方 陈光磊 张文生 马路
系统性血管炎是以血管炎症和纤维素样坏死为病理改变的一组系统性疾病。抗中性粒细胞胞浆抗体(ANCA)相关性小血管炎(AASV)是一种多累及小动脉、小静脉和毛细血管为主的全身多系统、多脏器损害的自身免疫性疾病[1-2]。随着近年来对ANCA相关性血管炎(AAV)的重视,其在肾脏疾病患者中的检出率逐年增高,严重影响人类健康[3]。该病常伴有不同程度的肾功能异常,为了解肾功能异常时的临床病理特征,本研究对AAV伴肾功能异常患者的临床病理特征进行对比分析,以期为临床治疗提供依据。
对象与方法
1.对象:2009年1月~2018年12月于我中心住院并经肾脏穿刺病理活检确诊AAV肾损害患者110例。纳入标准:(1)临床病理资料完整,均符合2012年Chapel Hill会议制定的血管炎分类标准[4];(2)血清核周型抗中性粒细胞胞质抗体(p-ANCA)和髓过氧化物酶抗中性粒细胞胞质抗体(MPO-ANCA)阳性;(3)行肾脏病理检查,光镜下≥10个肾小球,病理表现为坏死性小血管炎改变,如肾小球新月体形成、毛细血管袢坏死、间质炎细胞浸润及小血管坏死等,免疫荧光结果显示阴性或仅有少量免疫球蛋白沉积;(4)除肾脏受累外,伴或不伴肺脏、皮肤、关节等其他脏器受累;(5)无大、中血管受累表现。排除标准:药物所致、狼疮性肾炎或类风湿关节炎等自身免疫性疾病及冷球蛋白血症、过敏性紫癜等继发性血管炎。根据是否伴肾功能异常(血肌酐≥106 μmol/L)将110例患者分为肾功能异常组(62例)及肾功能正常组(48例)。其中肾功能异常组男18例,女44例,年龄11~78岁,平均年龄(42.2±21.8)岁;肾功能正常组男15例,女33例,年龄10~76岁,平均年龄(41.9±20.7)岁。两组患者性别、年龄比较差异均无统计学意义(P>0.05),具有可比性。本研究经我院伦理委员会审核批准。
2.方法
(1)临床资料收集:收集所有患者的临床资料,包括性别、年龄、临床症状(发热、乏力、消瘦、咳嗽、关节痛、肺间质纤维化、水肿、血尿、蛋白尿、贫血)、既往病史(高血压、肾病综合征)。
(2)ANCA、红细胞沉降率(ESR)、肾功能、24 h尿蛋白定量检测:分别采用间接免疫荧光法(IIF)和靶抗原(PR3、MPO)明确的酶联免疫吸附试验(ELISA)联合检测ANCA水平。使用OLYMPUS AU-640全自动生化分析仪检测肾功能、24小时尿蛋白定量。采用红细胞沉降仪检测ESR水平。ESR增快标准:0~25 mm/h时为轻度增快,25~50 mm/h时为中度增快;>50 mm/h为重度增快。
(3)AAV肾损害病理分型及诊断标准:参照2010年Berden的“ANCA相关肾炎的形态学分级”[5]分为局灶型(≥50%肾小球大致正常)、新月体型(≥50%肾小球存在新月体)、硬化型(≥50%肾小球球性硬化)及混合型(大致正常肾小球、肾小球伴有新月体、伴有硬化肾小球均<50%)。
(4)ANCA相关肾炎的光镜下病理变化:根据2009年《肾活检病理学》[6]中的诊断标准,ANCA相关性肾炎典型病理变化包括以下3点:①肾小球局灶节段性毛细血管袢纤维素样坏死,细胞性、细胞纤维性或纤维性新月体;②肾小动脉纤维素样坏死,也可累及中血管;③肾间质、肾小管炎细胞浸润。
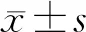
结 果
1.两组患者临床资料比较:肾功能异常组患者水肿、蛋白尿、贫血、高血压发生率明显高于肾功能正常组,差异有统计学意义(P<0.01),而两组间其他资料比较差异无统计学意义(P>0.05)。见表1。
2.两组患者肾脏病理类型分布情况比较:肾功能异常组患者病理类型相对分散,以局灶型、新月体型、硬化型较多。而肾功能正常组患者病理类型相对集中,以局灶型为主,两组患者病理类型构成比较差异有统计学意义(χ2=22.962,P<0.001)。其中肾功能异常组新月体型患者比例明显高于肾功能正常组,而肾功能正常组局灶型患者比例明显高于肾功能异常组(P<0.001);两组混合型、硬化型患者比例比较差异均无统计学意义(P=0.073)。见表2。
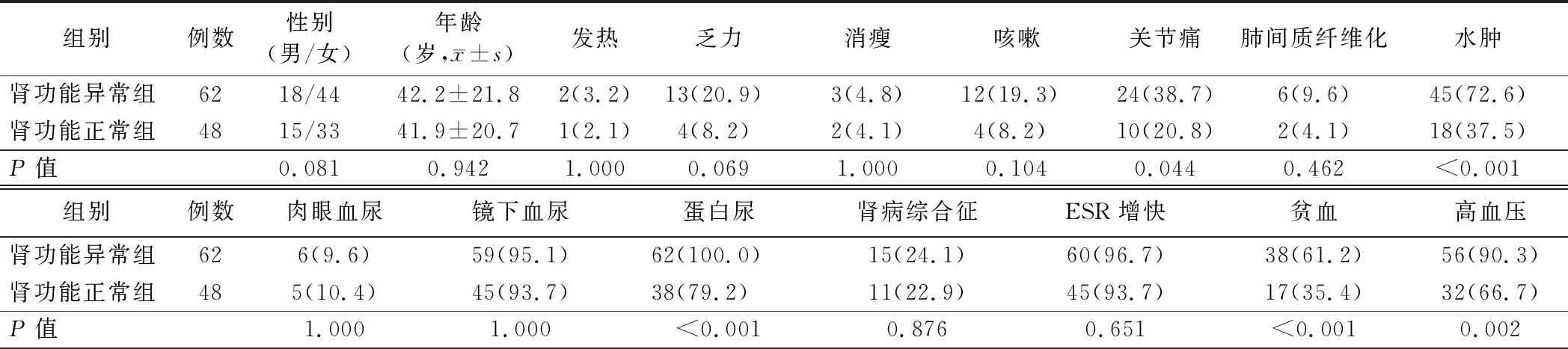
表1 两组患者临床资料比较[例,(%)]

表2 两组患者病理类型分布情况比较[例,(%)]
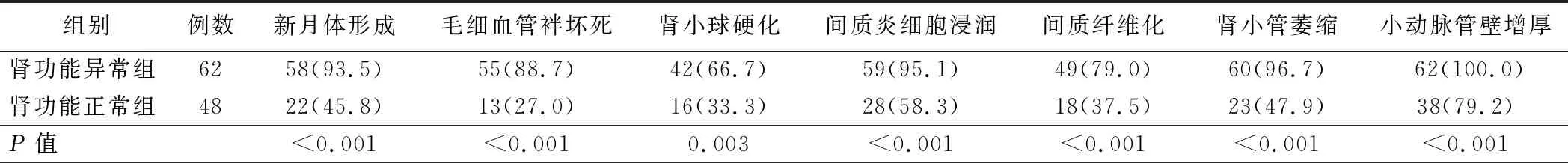
表3 两组患者特殊肾脏病理表现比较[例,(%)]
3.两组患者特殊肾脏病理表现比较:肾功能异常组肾脏病理表现为新月体形成、毛细血管袢坏死、肾小球硬化、间质炎细胞浸润、间质纤维化、肾小管萎缩、小动脉管壁增厚的患者比例明显高于肾功能正常组,差异均有统计学意义(P<0.01)。见表3。
讨 论
AAV是一种可累及全身多系统、多脏器的自身免疫性疾病,多伴毛细血管、小动脉、小静脉病变,任何一个系统器官均可受累,其中肾脏是常见受累器官,典型表现为肾功能不全,多数为急性肾损伤[7]。患者在发病初期及血管炎活动期常有发热、疲乏、厌食、恶心、全身不适感、关节疼痛和体重下降、皮疹等非特异性症状。AAV多发于老年患者,呼吸系统最易受累,表现为咳嗽、咯血、胸痛、气短,使用抗生素疗效欠佳,糖皮质激素、免疫抑制剂治疗可明显改善其预后[8-10]。并发间质性肺炎及肺出血也是其不良预后因素[11]。本研究中肾功能异常组患者临床症状较对照组重,主要表现为水肿、蛋白尿、贫血、高血压等,可能是因为肾功能异常时,尿量减少,体内水钠潴留,导致组织间隙水分增多,引起下肢水肿;肾功能下降导致促红细胞生成素产生减少,出现贫血及乏力;肾素-血管紧张素系统被激活,导致血压明显升高。有文献报道AAV患者临床表现以肾脏受累和肺脏受累多见,年龄、肾小球滤过率、血清白蛋白水平及血管炎活动评分(BVAS)是AAV患者死亡的独立影响因素,间质性肺病、D-二聚体水平高、低钠血症也可能与AAV预后有关[12]。
本研究结果发现,肾功能异常组患者病理类型相对分散,以局灶型、新月体型、硬化型较多,而肾功能正常组患者病理类型相对集中,以局灶型为主。局灶型患者肾功能相对稳定,一般预后良好;新月体型可导致患者肾功能急剧减退,但若治疗及时可使肾功能恢复,存在修复机会;混合型和硬化型较局灶型和新月体型更容易进展至终末期肾病,硬化型患者肾功能不可恢复,预后差[13];混合型是中间结局。掌握AAV肾损害的肾脏病理分型,了解疾病活动和缓解的潜在病理生理基础,对其治疗与预后将产生积极影响[14]。
肾脏是AASV最常受累的脏器[15]。国内有关文献报道AASV患者中约80%~90%有肾脏受累的临床表现,而肾脏病理检查结果几乎100%受累[16]。ANCA相关性肾小球肾炎被认为与足细胞丢失或功能丧失有关[17]。肾脏病理改变主要表现为肾小球毛细血管袢纤维素样坏死和新月体形成。细胞性新月体逐渐形成,若未经治疗,很快转变为细胞纤维性新月体,接着形成纤维性新月体,进而发展为肾小球硬化[18]。AAV同时易发生严重的肾小管间质损害,主要表现为肾小管空泡变性及萎缩、肾间质炎细胞浸润及纤维化。这些表现包括活动性病变和慢性病变,其中活动性病变经积极治疗后预后较好,可部分逆转病情,如肾小球毛细血管袢纤维素性坏死、细胞性新月体、肾间质炎细胞浸润等。而慢性病变预后较差,包括纤维性新月体、硬化性肾小球、小动脉增厚、肾间质纤维化等[19-20]。肾小球硬化、肾小管间质纤维化和肾小动脉闭塞是反映预后不良的指标[21]。本研究对两组患者特殊肾脏病理表现比较,结果发现肾功能异常组肾脏病理表现为新月体形成、毛细血管袢坏死、肾小球硬化、间质炎细胞浸润、间质纤维化、肾小管萎缩、小动脉管壁增厚的患者比例明显高于肾功能正常组,提示AASV合并肾功能不全时病理改变较重,肾脏活动病变更为显著,可能预后更差。
总之,AAV伴肾功能异常患者的临床表现和病理改变更重,病理类型多样,肾脏活动病变及慢性病变均较为显著。临床上应该更加重视,及早行肾穿刺病理检查,给予积极强化治疗,控制疾病活动和进展,改善患者预后。本研究为单中心、回顾性研究,病例选择受限,还需多中心、大样本、前瞻性研究进行深入探讨。
