大豆卵磷脂与卵黄在山羊精液冷冻过程中的联合作用研究
2020-09-18范文华戴建军张树山孙玲伟吴彩凤张德福
范文华,戴建军,张树山,孙玲伟,吴彩凤,张德福*
(1.上海市农业科学院畜牧兽医研究所,上海 201106;2.上海农业遗传育种重点实验室动物遗传工程研究室,上海 201106;3.上海海洋大学水产与生命学院,上海 201306)
家畜精液冷冻通常以卵黄(EY)作为冷冻保护剂,但EY 成分复杂且安全性颇受质疑[1]。大豆卵磷脂(SL)富含低密度脂蛋白(LDL),可在精子冷冻过程中作为无动物源性冷冻保护剂保护精子膜免受低温损伤,并已得到部分应用[2-3]。如蔡虹[4]在牛精液冷冻中添加3%SL,解冻后活力和畸形率与EY 对照组均无显著性差异;胡传水等[5]以1.5%SL 完全取代20%EY 稀释液,解冻后精子质量与对照组无显著性差异;Forouzanfar 等[6]研究发现使用1%SL 可替代20%EY 冷冻保存绵羊精液。Sun 等研究发现[7],山羊冷冻过程中SL 的最佳添加浓度为2%,目前未见SL 和EY 在精液冷冻过程中联合应用的报道。本实验将EY 和SL 按一定比例混合配制稀释液,解冻后观察精子活率、精子活力、质膜完整率、顶体完整率和线粒体活性,并通过检测抗氧化指标确定EY 和SL 在山羊精液冷冻过程中是否有协同作用。
1 材料与方法
1.1 动物和试剂 除特别说明外,所有试剂均购自Sigma 公司,超氧化物歧化酶(SOD)、活性氧(ROS)、丙二醛(MDA)检测试剂盒购于碧云天公司。采精用的8 头崇明白山羊种公羊来源于上海市农业科学院食草动物综合试验站,
1.2 稀释液的配制 基础稀释液的配制:称取柠檬酸1.825 2 g、葡萄糖0.504 4 g 和 TRIS 3.634 2 g,溶解后加入200 IU/mL 双抗(河北远征药业有限公司)、6 mL甘油,混匀,定容至100 mL。
试验共分5 组,分别在基础稀释液中添加20%EY、2%SL、10%EY+2%SL、20%EY+1%SL、20%EY+2%SL。
1.3 精液采集 山羊精液采用假阴道法采集,经常规检测,精子活率在80%以上的精液方可用于后续试验。
1.4 精液冷冻 将8 头种公羊精液混合,平均分成5 份,按精液∶冷冻稀释液体积比1:3 加入稀释液混匀,移至4℃环境低温平衡2 h。平衡后样品在4℃环境下快速分装为0.25 mL 细管精液,移入液氮面上3 cm,熏蒸15 min 后迅速投入液氮中超低温冷冻保存。
1.5 精液解冻 将液氮中保存的细管取出,投入70℃水浴锅内解冻5 s,按精液:稀释液体积比1:10 稀释后混匀,于37℃水浴锅中孵育10 min。
1.6 精子质量检测
1.6.1 精子活率与活力 使用计算机辅助精液分析仪(迈朗,SJ-TMDI608)测定精子活率和精子活力,每个样品随机选取4 个视野(n ≥200)。
1.6.2 顶体完整率 吉姆萨染色法测定精子顶体完整率[8]。解冻后精液使用预热的无甘油基础稀释液50 倍稀释后涂片,风干。甲醇固定15 min 冲洗干净。使用吉姆萨染色12 h,冲洗干净,风干后镜检,精子顶体结构明显染色,顶体完整、外形正常或顶体轻微膨胀为顶体完整精子,顶体严重膨胀或顶体脱落为顶体畸形精子[9]。1000×显微镜下随机选取4 个视野(n ≥200)观察统计顶体完整率。
1.6.3 质膜完整率 低渗肿胀试验(HOST)测定精子质膜完整性[10]。将10 μL 精液与100 μL 100 mOsm 低渗溶液(0.9 g 果糖和0.49 g 柠檬酸钠溶于100 mL 蒸馏水)混匀,37℃孵育30 min,相差显微镜(×400)下随机观察4 个视野(n ≥200),精子尾部卷曲为质膜完整,无卷曲表明精子质膜不完整,计算出质膜完整精子的百分比。
1.6.4 线粒体活性检测 待测样品稀释至1.5×106/mL,加入10 µL 的罗丹明123(1 µmoL/L)和10 µL 碘化丙啶(1 mg/mL)混合,37 ℃避光孵育30min 后,吸取10 µL 样品制片。在400×倒置荧光显微镜,波长520 nm下随机选取4 个视野(n ≥200)观察,精子呈现红色荧光为死精,精子尾部呈现绿色荧光有线粒体活性[11]。统计各组百分率。
1.6.5 抗氧化指标检测 精子冷冻-解冻后ROS、MDA和SOD 水平分别采用碧云天公司提供的试剂盒检测。
1.7 统计分析 数据用SPSS 22.0 软件进行单因素方差分析(ANOVA),差异显著时采用Duncan´s 方法对各组间平均数进行多重比较,结果表示为平均值±标准误,P<0.05 表示差异显著。
2 结果
2.1 EY 和SL 及其联合添加对山羊冻精质量的影响 由表1 可知,10%EY+2%SL 组解冻后精子质量最高,其精子活率、精子活力、质膜完整率和顶体完整率显著高于20%EY+1%SL 组和20%EY+2%SL 组,与20%EY 对照组和2%SL 组无显著差异。

表1 不同冷冻稀释保护剂对崇明白山羊冻精质量的影响 %
2.2 EY 和SL 及其联合添加对山羊冻精线粒体活性的影响 图1 在3 组联合添加组中,10%EY+2%SL 组解冻后精子的线粒体活性显著高于另外2 组,但与20%EY对照组和2%SL 组无显著差异,20%EY+1%SL 组和20%EY+2%SL组的线粒体活性显著低于20%EY和2%SL组。
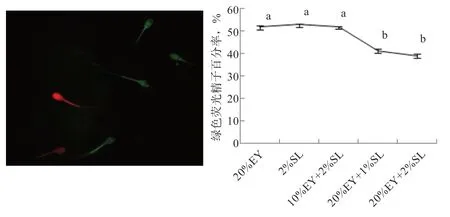
图1 EY 和SL 及其联合添加对精子线粒体活性的影响
2.3 EY 和SL 及其联合添加对山羊冻精抗氧化能力的影响如图2 所示,10%EY+2%SL 组解冻后精子的SOD 值为150.77 U/mL,显著高于20%EY+1%SL 组(102.19 U/mL)和20%EY+2%SL 组(101.17 U/mL),但与20%EY 对照组(151.74 U/mL)和2%SL 对照组(147.18 U/mL)无显著性差异。10%EY+2%SL 组、20%EY 对照组和2%SL对照组的ROS 和 MDA 水平均显著低于20%EY+1%SL和20%EY+2%SL 组。
3 讨 论
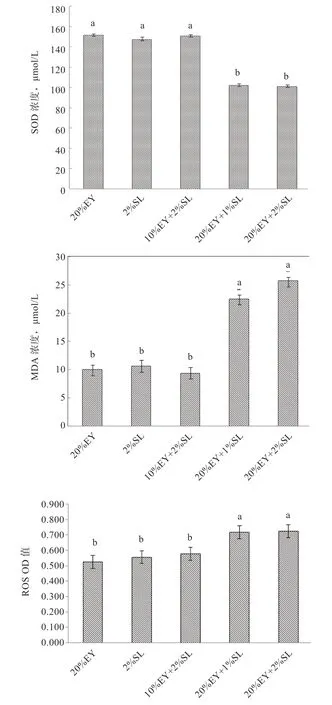
图2 EY 和SL 及其联合添加对山羊冻精抗氧化能力的影响
EY 作为家畜精液冷冻保护剂,易在精液冷冻和后续体外受精过程中带来微生物污染,且山羊精浆中的卵黄凝固酶可将EY 中的卵磷脂水解为脂肪酸和溶血卵磷脂,而后者对山羊精子的活力和顶体产生损害作用[12]。本研究首次在冷冻稀释液中添加SL 以替换或降低EY使用浓度,结果表明冷冻稀释液中使用2% 的 SL 可完全替代EY,取得了与20%EY 组相近的冷冻解冻效果。SL 主要包括磷酯类和非磷脂类物质,磷酯类物质大部分为LDL。研究证实,降温会造成精子质膜上的磷脂发生从液晶态到凝胶态的相位转变,降低精子膜的流动性,导致膜刚性增强,易受冰晶物理伤害,SL 中的LDL 能为受损的精子膜提供外源性磷脂,从而降低精子膜相位转变温度,以便于冷冻过程中精子脱水,提高精子质膜和顶体对冷冻伤害的耐受性,同时也可作为外源性磷脂来替代修补超低温损伤的精子膜磷脂,从而维持质膜的结构和功能,防止精子冷休克[13-15]。另一方面,LDL 可在细胞周围形成保护层,以防止快速降温细胞冰晶的形成,保护精子膜在冷冻-解冻过程中免受机械损伤[16]。本研究也证实了SL 在山羊精液冷冻中具有与EY 相似的冷冻保护效果。
精液冷冻过程中,10%EY+2%SL 组获得了最高冷冻效率,可能与SL 的添加降低EY 使用浓度,减少卵黄凝固酶(EYCE)对精子的毒害作用有关。EYCE 可诱导稀释液中卵黄凝结,催化卵黄脂类物质中脂肪酸的释放,造成精液pH 下降,从而导致孵育后精子死亡。结果表明,与单独添加EY 或SL 相比较,10%EY+2%SL组解冻后精子质膜和顶体完整性提高的主要原因可能是EY 和SL 的联合添加可能会弥补卵磷脂单一来源的局限性,改善冷冻效果。然而,这两种冷冻保护剂之间的相互作用尚不清楚。有研究表明,稀释液中的EY 会加速精子发生获能反应,降低精子存活时间,因此在冷冻过程中,降低稀释液中的EY 浓度,同时利用SL 补充添加冷冻所需的必须成分,可更好地保护精子的顶体[17]。本实验中10%EY+2%SL 联合添加组亦获得了最佳的精子活力、精子活率、质膜完整性和顶体完整性。
本实验未发现EY 和SL 存在协同作用,20%EY+1%SL 组和20%EY+2%SL 组山羊精子解冻后的精子活率、精子活力、质膜完整率、顶体完整率和线粒体活性均显著低于10%EY+1%SL 组,可能是因为高浓度EY 稀释液再联合添加其他来源的卵磷脂将导致稀释液中卵磷脂浓度增加,加大稀释液黏稠度,使精子游动阻力增大,消耗更多ATP。大量ATP 消耗将会使精子提前获能,获能是精子凋亡的诱因之一,同时部分精子提前发生顶体反应,进而丧失受精能力。精子运动所需要的 ATP 大部分来自线粒体,因此精子的运动能力与线粒体活性密切相关。Del 等[18]在绵羊精液冷冻中使用3.5%SL 作为冷冻保护剂,解冻后精子线粒体活性显著降低。SL 超过一定浓度会诱导线粒体跨膜电位降低,引起线粒体膜内外发生生化改变,导致ATP 合成酶等与驱动 ATP 合成有关的大分子物质丢失,从而降低ATP 合成,对精子运动产生不可逆影响。
线粒体活性直接影响精子运动能力,而线粒体损伤亦与精子的氧化应激损伤密切相关。冷冻保存过程中温度的变化会对精子产生物理性、化学性和氧化性损伤。氧化应激可能会导致线粒体功能丧失、DNA 断裂、染色体损伤,从而导致精子运动和受精能力降低、情期妊娠率与产仔率下降、羔羊畸形率增加等现象。精子细胞内线粒体在精子代谢过程中产生大量ROS,活性氧自由基可引起精子膜上脂质过氧化,产生MDA,造成细胞损伤凋亡的同时还能对精子基因组造成伤害[19]。精子内的SOD 在冻精中可有效清除ROS 氧化损伤产生的多种活性氧物质,这些活性氧物质对富含多不饱和脂肪酸的精子细胞产生潜在危害。本实验结果表明,山羊精液冷冻稀释液中联合添加10%EY+2%SL 时的精子SOD 含量显著高于20%EY+1%SL 组和10%EY+2%SL 组,ROS水平显著降低,与2%SL 组和20%EY 组无显著性差异,表明联合添加10%EY+2%SL 在降低氧化损伤效果上与单独添加EY 和SL 冷冻保护剂保持一致,并与精子的运动、质膜与顶体完整性数据相呼应。10%EY 联合添加SL 可部分提高精子抗氧化损伤能力、降低氧化损伤,减少精子细胞膜损伤,提高精子活力。20%EY 联合添加SL 则表现为对精子的促氧化损伤,严重影响冻精质量。
4 结 论
本研究结果表明,在山羊精液冷冻保存中,添加2%SL 对解冻后精液质量没有任何不利影响,可以作为精液冷冻保护剂有效代替EY;联合添加EY 和SL 并无明确的协同作用,20%EY 联合添加SL 甚至会对冻融后精子产生毒害作用。
