可见光催化环丁醇的C-C 断裂胺化反应的研究
2020-09-18吕振波
李 鹏,吕振波,于 芳
(辽宁石油化工大学石油化工学院,辽宁抚顺113001)
含氮化合物作为一种重要的化学物质广泛存在于天然产物中[1],其中重要的一类便是肼类化合物。这类化合物通常作为制备聚合物的引发剂、小分子催化剂、药物和农用化学品的前体。随着各行业对肼类化合物需求的增多,急需开发研究更绿色环保的生产方式。因此,发展温和条件下选择性构造C-N 的策略,一直是合成化学家关注的热点[2⁃4]。
比较常见的肼类含氮化合物可作为ɑ⁃氨基⁃3⁃羟基⁃5⁃甲基⁃4⁃异恶唑丙酸(AMPA)受体的非竞争性拮抗剂Talampanel[5],其已被研究用于治疗多种疾病,可以作为潜在的抗癫痫药物。芳基酰肼衍生物[6]在相关报道中表现出抑制黑色素瘤癌细胞生长的作用。从海洋生物中分离出来的Dinohydrazides A[7],药理研究表明该化合物对人体静脉内皮细胞和哺乳动物癌细胞均表现出中度的生长抑制作用,具有潜在的药物活性。
传统过渡金属参与的胺化偶联反应有一定的实用性,但在实际应用中往往受到高温、强氧化剂、酸性或碱性添加剂等苛刻反应条件的限制[8⁃9]。此外,使用亲核胺的过渡金属介导的胺化仅限于芳胺的合成。经过催化反应所得到的胺化产物可以作为构建复杂有机分子的前体,因而受到大量学者的关注。在许多策略中,烷氧基的β⁃位C-C 断裂已被证明是活化醇类化合物中C-C 的一条有效的途径。
近 年C-N 的 合 成 策 略 一 直 在 不 断 发 展[10⁃11]。伴随着可见光参与催化反应的兴起[12⁃13],可见光催化为实现各种温和条件且选择性较高的以氮原子为中心的自由基反应提供了有力的催化平台[14]。大多数可见光的催化反应是一个不断发生氧化还原循环的过程[15]。光诱导电子转移过程(PET)是根据电子在光催化剂激发态和反应物之间的转移方向进行分类的:在氧化淬灭循环中,催化剂的激发态通过向反应混合物中的底物或氧化剂提供电子而被自然淬灭;在还原淬灭循环中,经光照激发的催化剂通过接受来自体系中的底物或还原剂的电子而被淬灭。随后光催化剂经翻转:包括在氧化循环中生成的处于氧化态催化剂的还原和还原循环中生成还原态光催化剂的氧化。在其中任何一种情况下,外部需要具有氧化或还原活性的试剂使催化剂再生,从而完成循环。这些光催化途径能以可控的方式产生各种氮自由基物种,从而为构建多种功能的含氮化合物提供了新型有效的方法[16]。这些氨基自由基用传统方法难以进行转化。因此产生了许多关于光催化C-N 合成的报道[17⁃18]。
最近的研究表明,光催化氧化可以在温和的反应条件下提高叔醇的β⁃位C-C 断裂反应的效率[19]。但是,迄今为止尚未在仲醇的C-C 断裂及胺化官能化方面取得进展,而仲醇比叔醇更普遍和更容易获得。因此,特别需要一种方法,通过烷氧基自由基β⁃位断裂使醇特别是仲醇的C-C 断裂,探讨胺化官能化的一般性策略。研究设想了一种通用的C-C 活化策略,由简单的铈络合物实现。由于醇具备与金属中心配位的能力,铈络合物可以通过可见光激发,并被氧化成高价态的铈复合物,然后高度氧化的金属铈络合物促进具有挑战性的醇羟基β⁃位C-C 的断裂,从而产生以碳为中心的自由基,产生的自由基中间体与其它含氮化合物相偶联,即可获得重要含氮结构化合物,最终实现环仲烷醇β⁃位的胺化官能团化,为C-N 的构造提供新的合成策略。该方法易于操作,条件温和,属于环境友好型反应,为C-N 的合成提供了新的方法,符合绿色化学的发展要求。
1 实验部分
1.1 试剂与仪器
3⁃羟基环丁烷羧酸甲酯(CAS:4934⁃99⁃0),上海韶远试剂有限公司(Accela);偶氮二甲酸二叔丁基酯(DBAD,CAS:870⁃50⁃8),西格玛奥德里奇(上海)贸易有限公司(Aldrich);三氯化铈(CeCl3·7H2O,CAS:7790⁃86⁃5),梯希爱(上海)化成工业发展有限公司(TCI);四丁基氯化铵(TBACl,CAS:1112⁃67⁃0),安耐吉化学公司(Energy);乙腈(CAS:75⁃05⁃8),百灵威化学科技公司(J & K)。
采用F⁃254 的硅胶板进行薄层色谱法(TLC)分析,显色方式通常有:磷钼酸显色剂、紫外灯照射、碘缸熏蒸、碱性高锰酸钾显色剂等。
旋转蒸发仪(型号N⁃1100),上海爱朗仪器有限公司。1H⁃NMR 和13C⁃NMR 使用德国布鲁克公司Bruker 500 型核磁共振仪。核磁分析数据:化学位移(δ),多重峰裂分(s= 单峰,d= 双重峰,t= 三重峰,q=四重峰,m=多重峰),耦合常数(Hz)。气相色谱(GC)采用安捷伦7890B 型进行分析检测。高分辨质谱(HRMS) 数据通过IonSpec 4.7High ⁃resolution MS 采集获得。紫外⁃可见光吸收实验所用仪器为Agilent Cary 5000 分光光度计。荧光淬灭实验用仪器为Fluorolog⁃3 分光光度计。循环伏安法用CHI600E 电化学工作站。
1.2 实验方法
在反应瓶中分别加入3⁃羟基环丁烷羧酸甲酯(156 mg,1.20 mmol,3.0 当 量),DBAD (92 mg,0.40 mmol, 1.0 当 量),CeCl3•7H2O(0.75 mg,2 μmol,0.005 当 量), TBACl(1.1 mg,4 μmol,0.01 当 量) 和MeCN (4 mL),通入氩气脱气10 min,用封口膜将反应瓶密封,然后用90 W 蓝色LED 灯(距离光源约5 cm)照射。 将8 mL 反应小瓶用小瓶盖正下方的Parafilm 包裹,并放置在搅拌板的中心。两个平行LED 灯(Kessil A 360 W E 系列TUNA 蓝色LED)垂直于反应瓶的侧壁放置,使反应瓶可以同样暴露于LED 灯。在反应过程中,反应瓶上方的夹式风扇始终打开。 注意:顶置风扇是必要的,可以疏散LED 灯产生的热量并稳定反应温度(低于35 ℃)以获得重复性结果。反应结束后将反应混合物真空浓缩。 粗品通过硅胶色谱法快速纯化(质量分数6%~10% 丙酮的己烷溶液),产物为白色固体(100 mg,产 率69%)。 光催 化的C-N 偶联反应 式如式(1)所示。
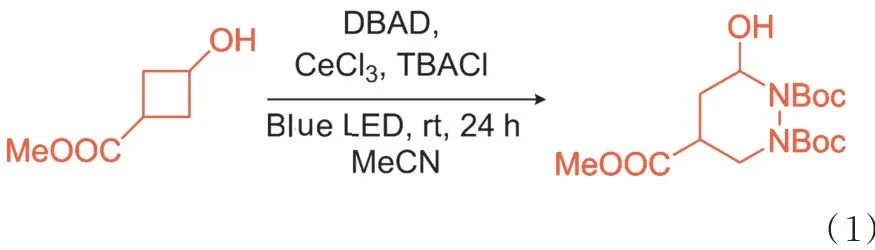
2 结果与讨论
2.1 不同溶剂类型对反应的影响
溶剂对反应的影响主要体现在对底物环状烷醇的溶解性以及在不同浓度时会影响分子间的碰撞几率,从而对实验结果产生影响。选择底物浓度为0.2 mol/L,对常见溶剂进行筛选,结果见表1。
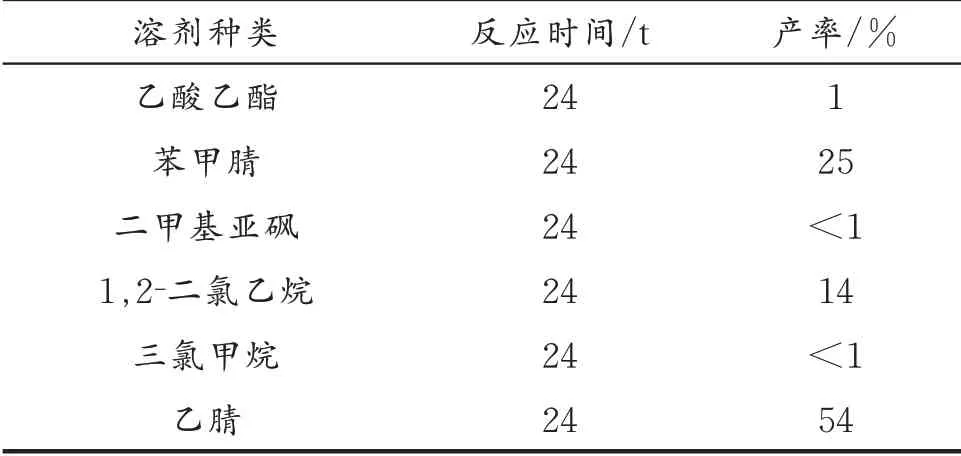
表1 溶剂种类对反应的影响Table 1 Evaluation of solvents on the reaction
由表1 可知,乙腈对反应体系有良好的促进作用。而二甲基亚砜等其他极性大的溶剂,虽然溶解性较好,但反应后经TLC 检测均无明显产物生成。可能原因是,溶剂分子氧上的孤对电子会竞争与金属的配位,从而使催化剂失活,反应难以完成。而使用乙酸乙酯作为溶剂时虽然有产物生成,但产率较低,推测原因为金属催化剂难以充分溶解,导致催化效率降低。
2.2 底物浓度对反应的影响
在最佳溶剂乙腈的作用下,不同浓度的底物对反应的影响是不同的,结果见表2。

表2 底物浓度对反应的影响Table 2 Evaluation of solvent concentration on the reaction
从表2 可以看出,底物醇的浓度由0.02 mol/L增加到0.40 mol/L 的过程中,产品的产率逐渐增加。可认为是较高浓度促进了分子间碰撞,使反应更为完全。
2.3 光照对反应的影响
为了验证此反应途径是由光照激发后进行的,对反应体系中关键条件进行控制,设置一系列对照实验。将对照实验的结果与实验方法所述的结果进行比较,结果见表3。
通过表3 的一系列控制实验表明,对照实验揭示了铈催化剂和光的重要性,因为在没有催化剂或避光的情况下没有观察到胺化产物。此外,在没有光的情况下将反应加热到50 ℃也没有产物形成,还发现反应在痕量水中进行时,反应效率并没有显着降低,这种光催化体系可以允许少量水的存在。需要注意的是反应中有大量自由基的生成,所以反应体系在投料时需要一定的除氧操作。以上结果证明,此反应过程明显是由光照引发的。

表3 标准条件的变化对反应的影响Table 3 The effect of changes in standard conditions on the reaction
考察体系是由光照激发后进行的,并认为体系在避光条件下难以进行。通过保持最优条件一致,进行一组平行反应,对该组反应体系在不同光照时间进行监测。反应在有光照射和无光照射条件下交替进行,并在每次光源变化时,停止一个反应体系进行产率检测,然后将所得产率与开关灯实验反应的时间作图,结果见图1。

图1 开关灯实验Fig.1 Light/dark experiments
由图1 可见,当体系在光照范围时,经过GC 定标后确定体系是有产物生成且产率是稳步上升的。当关闭光源时,体系产率不再发生变化。通过开关灯实验可以证明:反应体系是需要光源来促进反应,直到原料消耗完全为止。
2.4 紫外/可见光吸收光谱与荧光发射光谱
整个光化学的过程是通过分子吸收光子开始的,当分子吸收到适当能量的光照射,分子达到电子激发态。与电子有关的吸收光谱通常在紫外/可见光谱区,可通过紫外/可见分光光度计测量。在不同波段光源的照射下,测量体系的吸收和发射光谱,从而更好地了解体系的性质。体系的紫外/可见光吸收光谱见图2。由图2 可见,对于配制好的铈⁃醇复合物(ABS CeCl3)波长在300~400 nm 仅表现出较弱的吸收。与之形成对比的是,四价铈盐的加入使体系波长在300~470 nm 产生较强且宽的吸收峰,说明体系中四价铈起到主要作用。反应中所使用的市售LED 光源波长在400~500 nm,与体系的吸收波段有重叠,说明采用常用的光源可催化该反应的进行。另测量混合物的荧光发射光谱,发现体系波长在408 nm 处被光照激发时,观察到一个以460 nm 为中心的发射带,发射寿命为16 ns。可以认为在蓝光区域的吸收增强是由氯离子所诱导的,可以促使更有效的光激发,从而产生催化效果。

图2 紫外吸收与荧光发射光谱Fig.2 UV absorption and fluorescence emission spectroscopy
2.5 Stet⁃Vomer 荧光淬灭实验
在紫外吸收光谱实验中,了解到体系的光谱性质,继续在波长408 nm 下光照激发所含CeCl3氯化物⁃醇络合物体系,使用Fluorolog⁃3 发光光谱仪记录体系经照射后的荧光发射强度,并在467 nm 处收集体系逐渐淬灭时的光照强度。实验中,将0.05 mol/L 的CeCl3氯化物⁃醇络合物加入MeCN 溶液中,在螺旋盖石英比色皿中加入适量的DBAD。用氩气流对样品脱气10 min 后,收集样品的发射光谱数据。以初始溶液测得荧光发射强度I0和加入不同浓度的DBAD 后的荧光发射强度I相比较,最终得到了一条淬灭直线,结果见图3。
2.6 反应机理
根据测得的相关实验数据及文献资料,推测可能的反应机理(见图4)。
由图4 可见,首先金属铈与醇羟基在溶液中进行配位,然后氯化铈/醇络合物2⁃1 经LED 蓝光波段的光照射,将产生光激发态络合物2⁃2,经光照激发的CeIII络合物随后将与以氮为中心的自由基中间体2⁃5 进行单电子转移以产生CeIV中间体和产物2⁃3,考虑到此时CeIV较强的氧化性质,预计它可以有效促进具有挑战性的环仲烷醇氧β⁃位的C-C 断裂过程,从而产生以碳为中心的自由基和CeIII配位的羰基2⁃4。 以碳为中心的自由基因其自身的高反应性,很容易被DBAD 所捕获,其中的N-N 双键打开后与碳自由基相偶联,形成了以氮为中心的自由基中间体2⁃5,然后与下一轮循环中生成的2⁃2 进行SET 还原,最后经过氢原子转移生成产物2⁃6,完成整个催化循环过程。
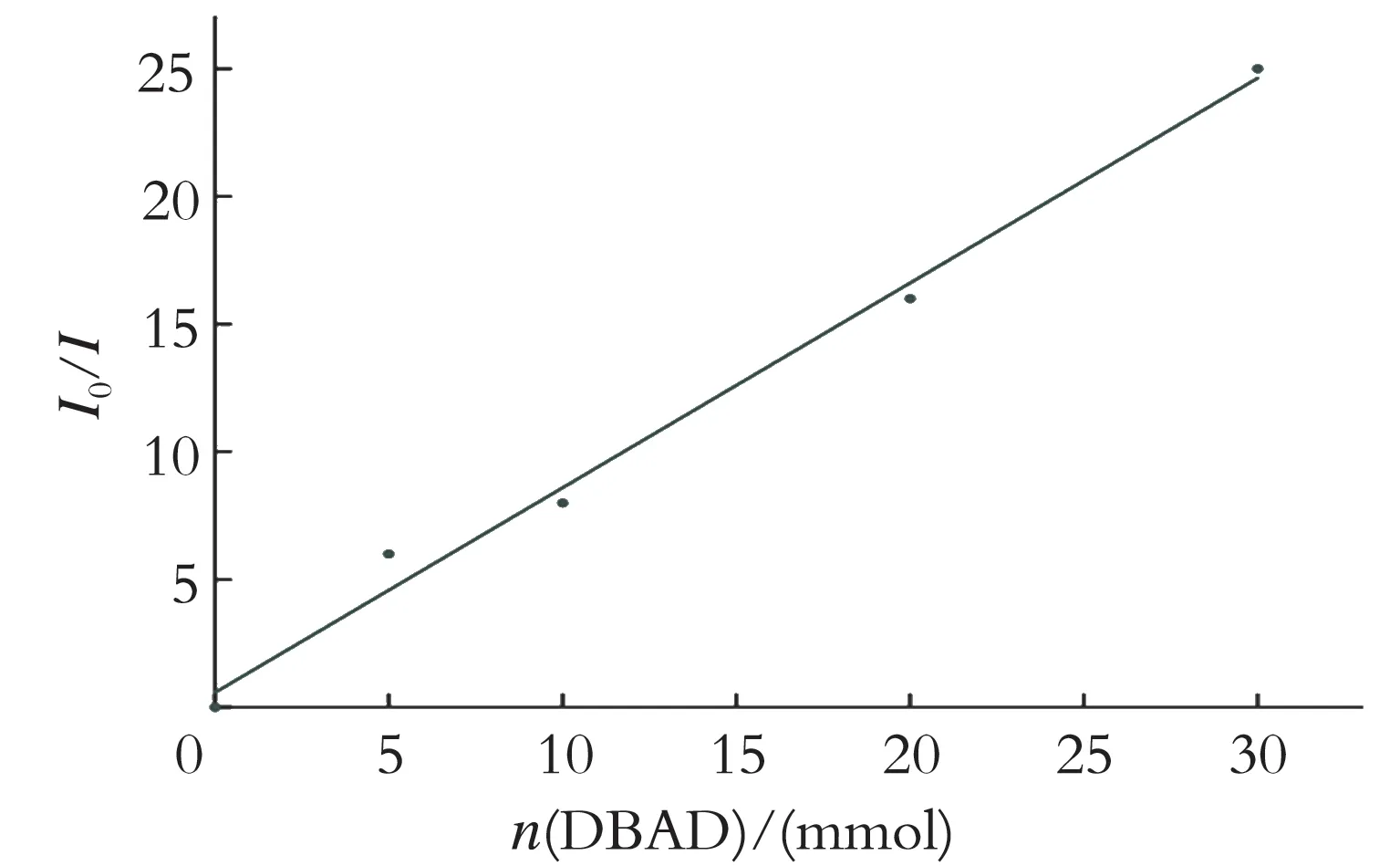
图3 Stern⁃Volmer 淬灭实验Fig.3 Stern⁃Volmer quenching studies

图4 偶联反应的机理Fig.4 Proposed mechanism of coupling reaction
2.7 产物的结构表征
产物是白色固体,1H⁃NMR(500 MHz,CDCl3),δ=5.88(m, 1H,-OH), 4.47~4.27(m, 1H,-CH),3.70~3.68(m, 3H, -CH3), 3.10~3.09(m, 1H, -CH), 2.96~2.79(m, 1H,-CH), 2.19~2.12(m, 1H,-CH), 1.80~1.78(m, 1H, -CH), 1.48~1.46(m,18H, -CH3)。13C ⁃ NMR(125 MHz, CDCl3),δ=173.1、155.2、81.5、75.3、73.8、51.9、47.0、45.1、34.6、34.1、31.7、31.5、28.2、28.1;HRMS(ESI+): C16H28⁃N2O7Na+ [M+Na]+的 计 算 值383.178 9,实 测 值383.177 7。
3 结 论
以可见光催化为核心,设计了利用可见光催化的C-C 断裂与胺化的合成策略,进行了一系列的实验条件筛选,对体系所需要的溶剂、底物浓度等必要条件进行考察,获得最优反应条件。通过市售的LED 光源,在少量金属铈催化剂及添加剂的作用下,常温即可实现C-N 的合成,并实现了六氢哒嗪化合物的合成。进一步丰富了可见光催化的胺化反应,为复杂含氮化合物的制备提供了新的合成方法。
