乌拉特肋脉野豌豆无菌扦插扩繁技术研究
2020-09-18伊风艳展春芳闫晓红王慧敏孙海莲
伊风艳,杨 鼎,展春芳,闫晓红,王慧敏,邱 晓,孙海莲
(1.内蒙古自治区农牧业科学院,呼和浩特 010031;2.中国科学院内蒙古草业研究中心,呼和浩特 010031)
乌拉特肋脉野豌豆(ViciacostataLedeb. cv. Wulate)是豆科野豌豆属多年生草本植物,是从内蒙古乌拉特中旗地区采集,经过引种驯化,选育而成的牧草新品种[1]。其叶量丰富,营养价值高,抗逆性强,在年降雨量为100~250 mm的北方荒漠草原带能够生长,是荒漠草原区旱作人工草地建立、改良荒漠草原天然草场和草原植被恢复的优良种质资源[2,3]。乌拉特肋脉野豌豆属野生种,虽保留了珍贵的野生种质特性,但自身也有一些缺点,如:落粒性强导致种子收获产量低、种源缺乏,种子硬实导致发芽率过低等,限制了肋脉野豌豆在生产中的推广应用[4]。因此,提高肋脉野豌豆种子产量及繁殖系数有着重要的理论价值及现实意义。
无菌扦插扩繁技术是指以带叶芽的无菌茎段为外植体,利用植物组织细胞的分生能力,进行完整植株诱导的一种技术。通过扦插快繁途径,不仅保持了母系的优良性状,而且在短时间内可获得扩繁植株,达到快速增殖的目的[5]。这个过程不经过愈伤组织阶段,培养过程简单,成苗快,遗传性状稳定,适用范围大,对促进良种选育及种苗繁殖推广具有重要意义。因此,本研究以乌拉特肋脉野豌豆无菌苗茎段外植体,对成苗扩繁、生根及移栽技术等方面开展研究,旨在建立肋脉野豌豆无菌扦插扩繁技术,为肋脉野豌豆大批量育苗生产提供参考。
1 材料与方法
1.1 试验材料
供试材料来源于内蒙古农牧业科学院综合试验示范中心原种圃,成熟期采集整理后贮藏于4 ℃备用。
1.2 试验方法
1.2.1培养基
采用固体培养基,基本成分为MS,包含琼脂,蔗糖,激素,pH值为5.90。
1.2.2无菌苗培养
选取饱满有光泽的肋脉野豌豆种子,刀片切割之后,在流水条件下冲洗50 min,滤纸吸干种子表面水分,在超净工作台上用70%酒精处理1 min,无菌水冲洗3次,然后用0.1%氯化汞溶液进行灭菌,灭菌时间设6、8、10、12、14 min共5个处理。在处理过程中不断搅动溶液,使种子表面与灭菌剂充分接触。处理完之后用无菌水冲洗4次后,无菌滤纸吸干种子表面水分,接种到MS和1/2 MS固体培养上,每瓶接种4~6粒,观察无菌苗生长情况。
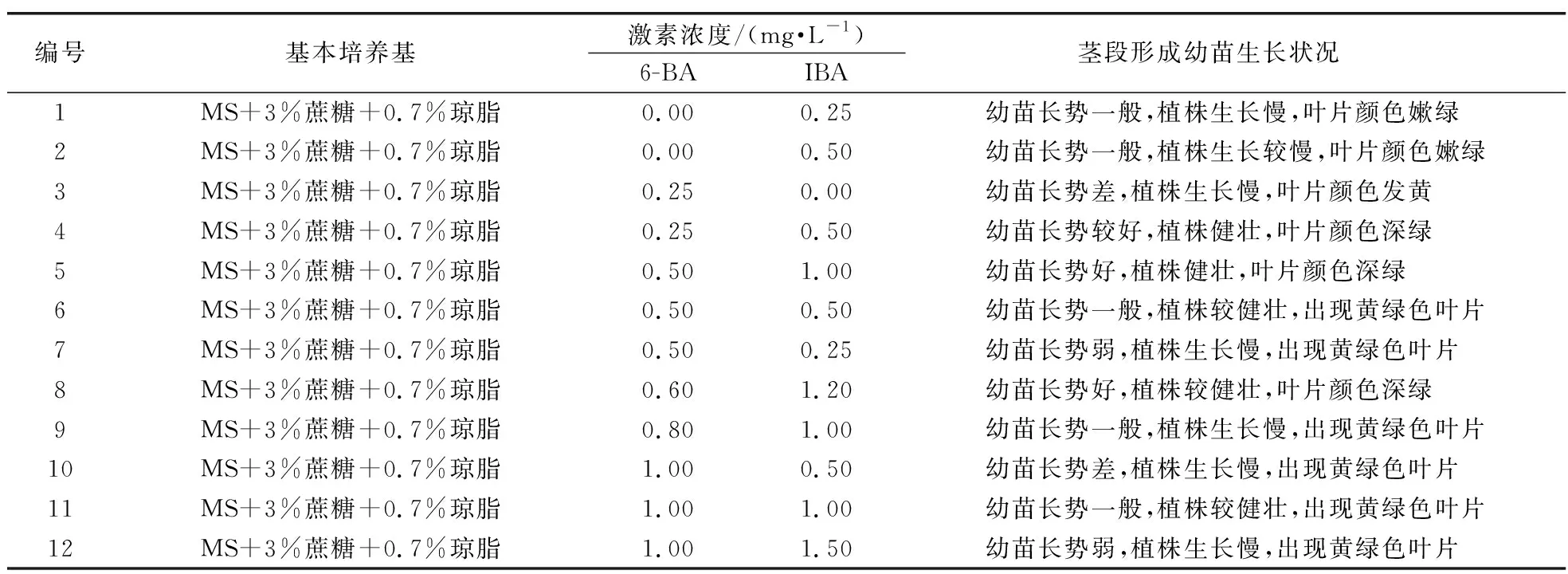
表1 不同激素配比对肋脉野豌豆扦插茎段生长的影响
1.2.3无菌苗初代培养
肋脉野豌豆长至10 cm后,在超净工作台上剪取长1~2 cm带叶腋芽的茎段,扦插到已配置好的含不同质量浓度的6-苄氨基腺嘌呤(0~1 mg·L-1)和吲哚丁酸(0~1.5 mg·L-1)的诱导分化培养基上。接种时基段的生物学上端朝上,生物学下端插入培养基中。每瓶培养基接种4~6个基段,每个处理接种20瓶。接种完毕后将材料放置于(25±1)℃下,光照条件为光/暗(12 h/12 h)的培养箱中培养。
1.2.4无菌苗继代培养
继代培养的目的是扩繁植株,进而获得大量适合生根的无菌苗。初始外植体经过一段时间培养,待长成大于5 cm的健壮小植株后,进行继代培养。继代培养基为初代培养中幼苗分化最佳培养基。
1.2.5完整植株的诱导
在超净工作台上,当分化产生的不定苗至3 cm以上后,接种于配置好的培养基上,进行完整植株的诱导试验。诱导根系培养基包括0~1.4 mg·L-1NAA、质量分数0.7%的琼脂和质量分数3%蔗糖的1/2 MS培养基。每瓶培养基接种4个幼苗,每个处理接种40瓶。接种完毕后将材料放置于(25±1)℃下,光照条件设置为光/暗(12 h/12 h)的培养箱中培养。
1.2.6炼苗及移栽
将已形成完整植株的部分三角瓶封口膜去掉,用镊子轻轻的将瓶底培养基打碎,切记勿伤到根系,向三角瓶中加入无菌水,开口状态下在室内放置2 d后,从瓶中取出幼苗,洗净根部培养基;将开口放置2 d的幼苗和未开口放置的完整无菌苗移栽到沙土∶营养土=2∶1的混合土中,覆上遮阴网,保湿保温9~12 d,待幼苗缓苗后,去掉遮阴网,保持适当湿度,2周后分别统计幼苗移栽成活率。
1.3 统计分析
无菌苗培养20 d后进行根系诱导培养,40 d后统计生根率。统计结果采用Excel、SAS软件进行数据整理与分析,生根率和移栽成活率按以下公式计算:
生根率(%)=(生根苗数/处理总苗数)×100%;
移栽成活率(%)=(成活的分化苗数/总分化苗数)×100%。
2 结果与分析
2.1 无菌苗培养条件分析
无菌苗的培养是试验顺利开展的关键。肋脉野豌豆种子灭菌试验的结果表明,当HgCl2氯化汞浓度为0.1%,消毒时间设置为6 min,接种培养基后,种子在培养一段时间后开始滋生细菌,消毒8 min后,种子在萌发过程中未出现细菌,效果较好,但消毒时间达10 min以上,虽然无细菌滋生,但对种子产生一定的毒害作用,部分种子不能萌发。研究中发现,基本培养基的含量对种子的萌发和幼苗生长没有明显的影响。
2.2 不同激素浓度对肋脉野豌豆无菌扦插扩繁成苗诱导效果分析
肋脉野豌豆带叶腋芽的茎段扦插在含不同生长调节物质浓度组合的培养基一定时间后,均能形成幼苗,但幼苗生长状况差异显著。观察中发现,低浓度的6-BA配合比其浓度高的IBA,茎段形成的幼苗生长快,且幼苗较健壮,叶片无玻璃化现象,随着6-BA浓度的增加,幼苗长势减弱,尤其是在高浓度的6-BA和低浓度的IBA激素配比下的培养基中,幼苗长势差,叶片发黄且产生玻璃化现象。综合以上结果,选择0.5 mg·L-16-BA+1 mg·L-1IBA作为肋脉野豌豆无菌苗扩繁培养基的激素配比。

表2 肋脉野豌豆完整植株诱导效果

注:a为肋脉野豌豆无菌苗;b为茎段扦插;c为分化苗;d为生根苗;e为花盆移栽苗;f为大田移栽苗。图1 肋脉野豌豆无菌扩繁成苗过程
2.3 肋脉野豌豆无菌扦插扩繁根系诱导效果分析
将继代增殖后长度大于3 cm的幼苗置于含不同NAA激素浓度的培养基中,培养25 d后部分幼苗逐渐长出少量的根系,培养约40 d后,大部分幼苗已形成完整植株(图1 d)。NAA浓度对肋脉野豌豆无菌苗生根的影响见表2。观察中发现,低浓度的NAA对根系诱导效果不显著,且无菌苗长势较差或一般,部分未生根幼苗出现萎蔫甚至死亡。随着NAA浓度的增加,根系诱导率显著提高,幼苗长势良好。当NAA质量浓度达到0.8 mg·L-1时,无菌苗生根率可达68%,且幼苗生长健壮,未出现黄化现象,但浓度继续升高,幼苗生长状况则变差,生根率降低,生根受到抑制,说明低浓度和高浓度的NAA均不利于肋脉野豌豆无菌苗根系的诱导。因此,肋脉野豌豆无菌苗最适根系诱导培养基为1/2 MS+0.8 mg·L-1NAA+3%蔗糖+0.7%琼脂。
2.4 肋脉野豌豆炼苗移栽效果
试验表明,肋脉野豌豆无菌生根苗直接进行移栽,幼苗成活率较低,多数幼苗慢慢会出现枯萎现象,根系极易发霉腐烂。而出瓶前在室内开瓶驯化2 d后移栽,其移栽成活率较高,达80%以上,这可能是开口驯化减少了幼苗接触外界污染的面积,在驯化过程中对外界污染形成了一定的抵抗力,而直接移栽幼苗直接接触外界污染,对污染的抵抗力较低,故影响了移栽成活率。因此,开口驯化2 d,移栽到基质为沙土∶营养土=2∶1的塑料盆中,有效控制温度、光照及空气湿度,保湿保温9~12 d,幼苗成活率较好。
3 讨 论
无菌外植体的获得是组织培养成功的第一步,外植体的接种成功与否,主要取决于消毒方式[6]。目前,NaClO或HgCl2等药剂在对植物体消毒处理上利用的比较广泛[7-9]。但不同的植物及外植体因生长状态及生存环境不同,对药剂处理的敏感性不同,因此药剂处理时间和处理浓度的控制尤为重要。本研究中,肋脉野豌豆种子经70%的酒精进行前处理后,在0.1%的HgCl2溶液中消毒8~10 min,种子萌发效果较好,且无细菌滋生,处理6 min,培养一定时间后部分种子表面开始滋生细菌,进而整个培养基被全部感染,而培养时间过长,发现种子萌发率明显降低,推测可能是处理时间过长对种子内部组织造成严重损伤,进而导致种子丧失活力,不能萌发。
生长调节剂是植物离体培养中器官发生和增殖的主要影响因素,虽用量甚微,但在植物组织培养中起着重要的调节作用[10,11]。本试验选用6-BA和IBA组合对肋脉野豌豆茎段进行芽增殖诱导,各处理均能使茎段芽增殖,但芽生长势却明显不同。高浓度6-BA下,茎段虽然能够分化出幼苗,但幼苗长势差,尤其是配合低浓度的IBA,幼苗易形成玻璃化,而低浓度的6-BA配合较高浓度的IBA茎段芽的增殖快且植株表现良好,无玻璃化现象。说明低浓度的6-BA能减少玻璃化现象的发生。这与韩淑兰等[12]的结论相符。
组培苗的生根培养是组织培养中的重要环节,是快速繁殖组培的有力保证。目前,关于组培苗生根国内外学者也做了大量的研究[13-15]。组培中根系的发育过程需要外源激素和培养条件等环境因素的共同作用[16],且不同的培养基,组培苗的生根存在一定的差异[17]。外源激素中生长素是促进组培苗生根的主要激素,能调节细胞分裂周期实现细胞的有序分裂,与根原基的发端密切相关[18,19]。研究表明,外源激素的配比及浓度对无菌苗生根起到关键作用[20,21]。本研究中,选择大部分的生根实验中采用1/2 MS培养基[6,22],添加不同浓度的NAA诱导根系形成。结果表明,低浓度的NAA对生根均具有一定的促进作用,但促进作用不明显,随着NAA浓度的升高,根系诱导率明显增加,当NAA浓度达到0.8%时,根系诱导率达68%,且根系较健壮,幼苗长势良好,随着NAA浓度的继续增加,根系诱导率呈下降趋势,由此说明NAA浓度过高或过低均不利于肋脉野豌豆无菌苗根系的诱导形成。
组培苗成功移栽是组培的最后一个环节,也是关系成败的重要环节之一,移栽不当组培苗容易染菌,直接影响组培苗的成活率。本研究发现,炼苗对肋脉野豌豆组培苗移栽成活率的影响较大,未经过炼苗的肋脉野豌豆移栽成活率仅为24.57%,而经过2 d炼苗,成活率可达80%以上,且移栽后的幼苗生命力旺盛,长势良好。
