油菜FBA基因克隆、表达分析及其与抗旱性的关系
2020-09-17谢小玉何巧丽张小短马仲炼
谢小玉,何巧丽,侯 爽,张小短,马仲炼
西南大学农学与生物科技学院, 重庆 400715
季节性干旱是油菜生产的主要自然灾害之一,尤其春旱使我国长江中下游地区的油菜平均减产20%以上[1]。研究表明,干旱胁迫下油菜的净光合速率(the net photosynthetic rate,Pn)降低[2],随干旱胁迫时间的延长,下降幅度不断增加,下降幅度与油菜抗旱性有关[3]。油菜产量与蕾苔期叶片净光合速率抗旱系数呈极显著正相关[4]。要提高油菜的抗旱性,就需提高干旱胁迫下油菜的光合效率。果糖- 1,6-二磷酸醛缩酶(fructose-1,6-bisphosphate aldolase,FBA)既参与了糖酵解和糖异生过程,同时又参与了磷酸戊糖途径和卡尔文循环[5-6],对细胞生命活动起着至关重要的作用。对油菜的研究发现FBA基因参与干旱胁迫应答。通过对FBA基因的克隆、表达分析及干旱胁迫下基因表达量与净光合速率、产量等之间的关系分析,对于揭示FBA基因在油菜抗旱中的作用及对油菜抗旱性鉴定和抗旱性改良具有重要意义。
前人研究表明,在自然界中存在两类FBA,有不依赖金属离子的第Ⅰ类酶和依赖金属离子的第Ⅱ类酶[7]。高等植物中的FBA均为I型,又存在2种亚型,即胞质型FBA和质体型FBA[8]。前者存在于细胞质基质中,参与糖酵解和糖异生途径,催化果糖- 1,6-二磷酸的裂解[9-10];后者分布于叶绿体中,参与卡尔文循环中1,5-二磷酸核酮糖的再生[11-12]。近几年研究表明,植物的果糖- 1,6-二磷酸醛缩酶不仅参与了很多的生理和生化过程[13- 15],还参与了植物对高温[16]、低温[8]、干旱[17]、盐[10,18]、镉[19]、硼[20]等多种胁迫的响应和信号传导过程。Lu 等[8]发现盐胁迫下拟南芥的FBA基因家族成员中的AtFBA3、AtFBA4、AtFBA6 和AtFBA8 表达量均上调;Fan 等[10]研究表明海马齿的FBA基因在盐胁迫后强烈表达,超表达后可以明显提高植株的耐盐性;胡杨细胞质中的果糖- 1,6-二磷酸醛缩酶通过促进糖酵解和有氧呼吸途径提高植物对盐胁迫的适应性[21]。Larkindale等[22]研究表明37℃的高温显著诱导拟南芥AtFBA6基因的大量积累。孙胜楠等[23]研究表明,FBA活性与基因表达均受高温诱导,诱导效应与温度升高幅度和高温持续时间有关。通过表型分析及基因芯片检测发现,在拟南芥低温致死的突变体中,FBA基因的表达量发生了明显的上调[24]。干旱胁迫下,拟南芥的AtFBA1,6,8表达量上调8倍以上[25];陈娜[26]等的研究也表明,FBA基因可能参与花生对高盐和干旱胁迫的适应性调控。目前研究者们已克隆出了紫花苜蓿[27]、番茄[16]等多种植物的FBA基因序列,Uematsu等[12]通过将拟南芥的质体FBA基因在烟草中进行异源表达,使转基因烟草的光合速率增加,促进了转基因烟草的生长和生物量的积累。但至今未见关于油菜FBA基因研究的报道。
本研究通过对前期构建的基于干旱胁迫下甘蓝型油菜 SSH文库[28]的测序分析,发现FBA基因参与干旱胁迫应答。在此基础上,采用RACE方法对基因进行全长克隆、测序和生物信息学分析;利用实时荧光定量PCR(RT-qPCR)测定FBA基因表达量,分析表达量与干旱胁迫下油菜光合指标、酶活性、产量等之间的关系,明确FBA基因与油菜抗旱性的关系,为油菜FBA基因功能研究以及利用FBA基因改良作物抗旱性提供参考。
1 材料和方法
1.1 材料与试验处理
供试材料为经鉴定抗旱能力强的甘蓝型油菜94005(由重庆市油菜工程研究中心提供)。挑选籽粒饱满、大小均一的油菜种子,用15%的次氯酸钠消毒20 min,然后用无菌水清洗5次,播种于室内以蛭石和草炭(1∶1)为基质的塑料营养钵中,在室温下培养至幼苗四叶一心时将其移栽到遮雨人工网室内的盆钵中(盆高40 cm,直径30 cm,盆中所用基质为草炭土、自然土壤和蛭石按1∶3:1比例混合而成的混合物,基质提前用多菌灵和敌百虫杀菌灭虫,每盆装基质15.0 kg,使其达9成满,施氮磷钾复合肥30 g),每盆定植2 株,期间进行正常的田间管理。
油菜生长至初花期,选择长势良好且生长一致的植株进行干旱处理,分为5组:正常供水(control, CK)、轻度干旱(lightly drought, LD)、中度干旱(moderate drought, MD)、重度干旱(severe drought, SD)和极度干旱(extreme drought, ED),其土壤相对含水量分别为65%—75%、50%—55%、40%—45%、20%—30%、10%—15%。每个处理种植8盆,共16株。自然干旱至设定土壤相对含水量标准范围,每天8:00和18:00采用称重法补水控水,处理期间除盆内土壤含水量差异外其他管理一致,土壤相对含水量达到干旱胁迫条件时持续7d取样测定,之后复水使土壤含水量恢复到对照水平,并正常水分管理培养至成熟期测定产量。
1.2 试验方法
1.2.1抑制消减杂交(Suppression subtractive hybridization, SSH)文库构建
对干旱胁迫的植株分别在第1天、第3天、第5天和第7天 9:00—9:30 采集对照和处理顶部完全展开的第1叶混合,液氮速冻,-80℃保存。进行RNA的提取及mRNA的纯化,抑制性消减杂交,SSH-cDNA文库构建以及差异表达序列测序和生物信息学分析[30]。
1.2.2光合参数的测定
用美国LI-COR公司生产的LI- 6400光合仪,在干旱胁迫的第7天(晴天)10:00点左右,对对照和处理植株的顶部外部向阳完全展开的长势一致的第2—3片叶测定净光合速率(Net photosynthetic rate,Pn)、气孔导度(Stomatal conductance,Gs)、胞间CO2浓度(Intercellular CO2concentration,Ci)、蒸腾速率(Transpiration rate,Tr),采用LI- 6400-02B红蓝光光源,设定光强为1600 μmol m-2s-1,温度为25℃,大气CO2浓度(Ca)为400 μmol/mol,空气相对湿度为50%—70%;计算水分利用率(Water use efficiency, WUE),水分利用率(WUE)=光合速率(Pn)/蒸腾速率(Tr)。采用轮回测定的方法,每个处理测定3株。
1.2.3FBA酶活性的测定
剪取测定完光合参数的叶片,-20℃保存,采用上海优选生物科技有限公司的植物果糖- 1,6-二磷酸醛缩酶试剂盒(微量法)测定FBA的活性,所有操作步骤均按照试剂盒说明书进行。
1.2.4FBA基因表达量的测定
剪取测定完光合参数的叶片,液氮速冻,-80℃保存,采用天根公司的RNA prep pure植物总RNA提取试剂盒提取总RNA,利用1.0%琼脂糖凝胶电泳检测提取的总RNA的完整性,用紫外分光光度计测定纯度。使用TAKARA公司的PrimerScript® RT reagent Kit With gDNA Eraser试剂盒进行RNA的纯化和反转录合成cDNA, 根据SSH文库中FBA基因的 EST(表达序列标签,Expressed sequence tag) 序列,利用Vector NTI软件和primer premier 5.0软件设计引物,正向引物为5′-TACCTGGCATCAAAGTCGACAA- 3′,反向引物5′-TCG TAGTACTTCTTGCAACGCT- 3′。以ACT7和UBC12为候选内参基因,通过基因表达稳定性的分析[29],以ACT7为内参基因,正向引物TGGGTTTGCTGGTGACGAT,反向引物TGCCTAGGACGACCAACA ATACT。使用BIO-RAD公司的iTaq TM Universal SYBR® Green Supermix试剂盒进行实时荧光定量PCR(RT-qPCR)扩增。PCR程序为:95℃ 3min,95℃ 10 s,60℃ 30 s,72℃ 30 s,45个循环;72℃ 10 min。每个样品4个重复,采用2-ΔΔCt计算基因表达量[30]。
1.2.5FBA基因的全长克隆
采用Clontech 公司的SMARTerTMRACE cDNA Amplification Kit试剂盒获得基因的3′端序列。以RACE-Ready c DNA为模板,在试剂盒提供的通用引物UPM及基因特异性引物GSP引导下,用Advantage 2 Polymerase Mix催化合成相关基因的cDNA末端。引物序列为:FBA- 1: AGGAAGGAGGAGTCTTACCT GGCATCA、FBA- 2: TCGACAAGGGCACCGTTTCTCTACC,第一轮PCR扩增,反应条件:94℃ 3 min;94℃ 30 sec,68℃ 30 sec,72℃ 3 min,25循环;72℃ 10 min;再进行第二轮PCR扩增,反应条件:94℃ 3 min;94℃ 30 sec,68℃ 30 sec,72℃ 3 min,25循环;72℃ 10 min;PCR扩增产物经1%琼脂糖凝胶电泳检测后,按TIANGEN普通琼脂糖凝胶DNA回收试剂盒说明书进行凝胶回收,回收纯化后的PCR产物送上海生工测序。
1.2.6测序结果的生物信息学分析
采用NCBI网站(http://www.ncbi.nlm. nih.gov/)上的 BLAST 工具对所测得的序列进行基因序列的相似性及同源性查找,并利用这些序列进行基因同源性的比较,用ORF Finder(http://www.ncbi.nlm.nih.gov/) 在线分析全长序列的开放阅读框(Open reading frame, ORF),利用 DNAMAN 软件将基因的 ORF序列翻译成氨基酸,利用Protparam (http://web.expasy.org/protparam/)预测蛋白的理化性质,利用 PSORT II Prediction(http://psort.hgc.jp/form.html)进行亚细胞定位预测;采用PredictProtein (http://www.predictprotein.org/)预测蛋白的二级结构,运用 SWISS-MODEL对氨基酸序列进行蛋白质三级结构预测分析,用Raswin 视图软件得到该蛋白质三维结构。用Vector NTI Advance11.5程序进行序列比对分析,用MEGA5.2.2软件构建进化树,在SOPMA和SWISS MODEL网站上进行蛋白质结构分析。
2 结果与分析
2.1 SSH分析发现FBA基因与抗旱有关
通过对干旱诱导的SSH文库中646个经PCR鉴定的阳性克隆测序,获得639个单一的EST,经过聚类、拼接和去除冗余,获得重叠群(contigs)89条,单拷贝序列 (singleton)97条。对测序获得的186条unigene进行Blastn和Blastx数据库的序列比对,发现其中166条具有同源基因,20条没有匹配项。具有同源基因的EST中154条与已知功能的蛋白有同源性,其中果糖- 1, 6-二磷酸醛缩酶基因11条,占具有同源性基因的6.63%。表1列出了部分ESTs。
2.2 FBA基因的克隆与序列分析2.2.1 FBA基因的RACE克隆
在已获得的保守区基础上,以3′RACE的cDNA为模板,经2轮PCR之后扩增出大小约900bp的单一DNA片段。将第二轮PCR产物进行电泳并对目的条带进行切胶回收纯化测序,测序结果提交Genebank,命名为BnFBA1,基因登录号为 MH316131。经过软件分析,确认此片段大小为975 bp,与保守区序列有368 bp的重叠片段,是油菜FBA的mRNA3′端序列。
2.2.2FBA基因的序列分析
(1) 油菜BnFBA1基因编码产物的基本性质分析
用DNAMAN V6将测序结果与已知FBA序列进行拼接,得到FBA全长序列1440bp,预测基因的ORF位于60—1170区域(共1107bp),编码369个氨基酸。
经ProtParam分析,FBA蛋白序列分子量为38.51 KDa,等电点6.92,酸性氨基酸残基(Asp+Glu)总数为70个,碱性氨基酸残基(Arg+Lys)总数为47个,原子总数为5445,分子式为C1705H2738N466O526S10,半衰期为30h,稳定系数29.51,是稳定蛋白。 较高含量的氨基酸有Ala(丙氨酸,10.6%),Leu(亮氨酸,10.1%),不含Pyl(苯丙氨酸)和Sec(丝氨酸)。亚细胞定位分析表明该蛋白是细胞质蛋白。

表1 油菜叶片干旱胁迫下诱导表达的部分基因
(2) 油菜BnFBA1蛋白高级结构的预测
BnFBA1基因编码的蛋白的二级结构预测结果(图1)表明,该基因编码的氨基酸序列由43.85%的α螺旋(alpha helix) 、31.28%的无规卷曲(random coil) 、17.60% 的延伸链(extended strand)、7.26%的β转角(beta turn)构成。

图1 BnFBA1蛋白二级结构预测Fig.1 The predicted secondary structure of BnFBA1 protein蓝色:α螺旋; 紫色:无规则卷曲; 红色:延伸链; 绿色:β转角
BnFBA1蛋白的三级结构预测(图2)模型中清晰地看到α螺旋和β片层结构,与二级结构预测结果基本一致。
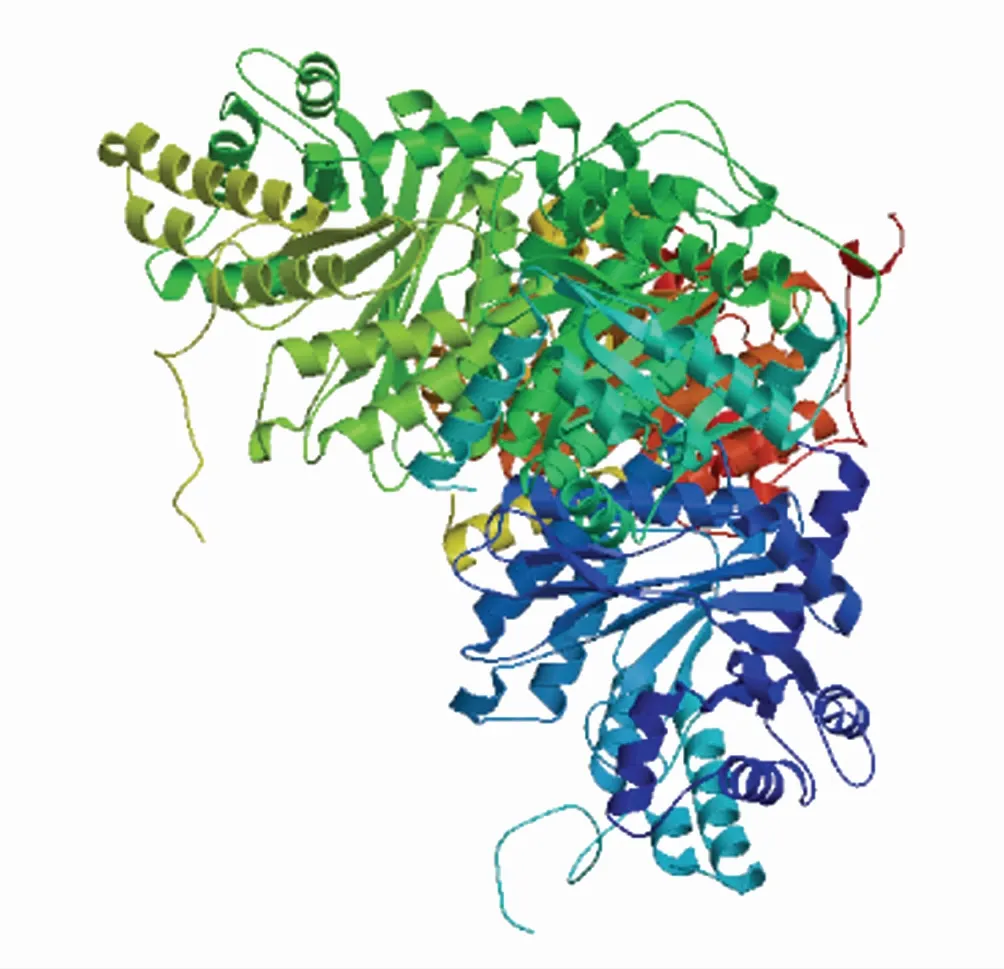
图2 BnFBA1蛋白三级结构预测模型Fig.2 Predicted 3-D dimensional structure of BnFBA1 protein
(3) 不同物种间BnFBA1基因编码蛋白质同源性分析
多重序列比对分析显示甘蓝型油菜94005的BnFBA1与拟南芥、花生、野生大豆、苜蓿等7种植物的细胞质FBA有69.8%的总体同源性(图3);从构建的系统进化树(图4)可看出,甘蓝型油菜94005的细胞质FBA与拟南芥的细胞质FBA同源性最高。
2.3 FBA的表达分析及其与抗旱性关系2.3.1 干旱对油菜叶片FBA表达量的影响
所有提取的叶片总RNA通过1.0%琼脂糖凝胶电泳检测后的结果表明18S与28S条带清晰、明亮,28S条带比18S条带更亮,两者之比大于1。经核酸蛋白检测仪检测,提取的总RNA的OD260/OD280值均在2.0—2.2之间,表明提取的总RNA完整、质量高、纯度好,达到了反转录和RT-qPCR的要求(图5)。
实时荧光定量PCR结果(表2)表明,在干旱胁迫下,FBA基因的表达量随着干旱胁迫程度的增加而增加,其中轻度、中度、重度和极度干旱下上升幅度分别为1.73%,3.97%,6.48%,7.23%。
2.3.2FBA的表达与抗旱性的关系
(1)干旱胁迫下油菜产量、光合特性及FBA活性的变化
表3表明,随着干旱胁迫的加剧,油菜产量、叶片Pn、Gs以及Tr下降幅度加大。在轻度、中度、重度和极度干旱胁迫下,产量分别较对照降低40.78%、45.55%、53.69%、62.90%,Pn分别较对照降低17.96%、45.42%、65.43%、82.71%,Gs分别较对照降低34.02%、65.98%、83.50%、84.87%,Tr分别较对照降低26.55%、47.57%、78.13%、80.54%。

表2 干旱胁迫下BnFBA1基因的表达情况
FBA活性随着干旱胁迫的增加而增加,轻度、中度、重度和极度干旱胁迫下,分别比对照高18.45%、31.69%、32.35%、35.66%。而Ci随着干旱胁迫的加剧降低,到重度干旱下达到最低,而极度干旱下又上升; WUE随着干旱胁迫的加剧不断上升,到重度干旱胁迫下达到最大,极度干旱胁迫下又下降。

表3 干旱胁迫对油菜产量、光合特性及FBA活性的影响

图4 油菜BnFBA1的系统进化树 Fig.4 Phylogenetic relationship of amino acid sequences between BnFBA1 and other species

图5 总RNA电泳图Fig.5 Electrophoresis profile of total RNA M代表标记,1/2/3/4/5代表CK/LD/MD/SD/ED/,6/7/8/9/10为重复;CK:正常供水Control; LD:轻度干旱Llightly drought; MD:中度干旱Mmoderate drought; SD:重度干旱Severe drought; ED:极度干旱Extreme drought
(2)干旱胁迫下FBA基因表达量、酶活性和油菜产量等指标的关系
用SPSS 17.0软件分析干旱胁迫处理下油菜FBA基因的表达量与酶活性、产量、光合参数的相关性(表4)表明,FBA表达量与FBA活性呈显著正相关,与Pn、Gs、Tr呈极显著负相关,与产量呈显著负相关。FBA活性与干旱胁迫下Pn呈显著负相关,与产量、Gs、Tr呈极显著负相关。
3 讨论
3.1 FBA基因与油菜抗旱性密切相关
FBA作为一类重要的糖代谢酶,处于6C糖可逆地转化为3C糖的关键部位,越来越多的证据表明这一家族在许多代谢和发育过程中扮演着重要的作用[31]。近年来,FBA相继在拟南芥[8]、番茄[16]、黄瓜[31]等不同的物种中展开了研究,发现FBA基因除了受光照、温度、盐等非生物因素的胁迫外,还参与了植物的干旱调控[8,17]。本研究从干旱胁迫下的SSH文库分析发现FBA参与油菜对干旱胁迫的应答;干旱胁迫下,油菜BnFBA1基因表达量和酶活性增加,这与拟南芥的研究结果相同[25]。这说明FBA是干旱胁迫响应基因。
干旱胁迫导致油菜叶片Gs、Tr、Pn和产量下降;在轻度(Lightly drought, LD)、中度(Moderate drought, MD)和重度(Severe drought, SD)胁迫下,Ci下降、WUE提高,而在极度干旱(Extreme drought, ED)下,Ci上升、WUE下降,可能是由于干旱胁迫下果糖- 1,6-二磷酸醛缩酶参与糖酵解,分解葡萄糖,使细胞内糖分降低,水势升高,气孔关闭;而在极度干旱(ED)下由于气孔关闭时间较长,Ci升高,细胞内pH值降低,水势降低,WUE下降,Pn下降,果糖- 1,6-二磷酸醛缩酶参与糖酵解并合成甘油来调节细胞内渗透压以提高油菜抗旱性。
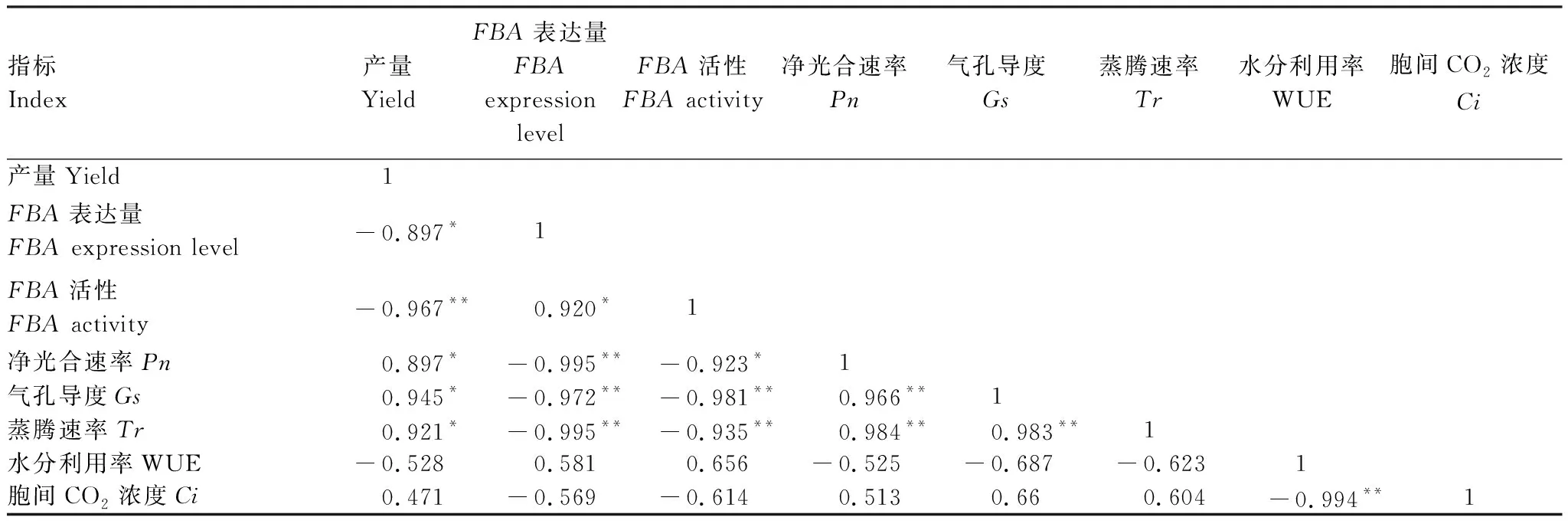
表4 油菜产量、基因表达量、酶活性、净光合速率的相关性
3.2 克隆的油菜BnFBA1基因属于胞质型FBA
干旱处理小麦7d后,包括果糖- 1,6-二磷酸醛缩酶在内的一系列参与卡尔文循环的酶基因表达协同下调[32]。而本研究表明,干旱胁迫下BnFBA1基因表达上调,FBA基因表达量、FBA酶活性与油菜叶片Pn、产量呈显著负相关。对成功克隆的BnFBA1同源的氨基酸序列对比显示甘蓝型油菜94005的FBA与拟南芥、花生、大豆、苜蓿等7种植物的细胞质FBA有69.8%的总体同源性;与拟南芥的细胞质FBA同源性最高。这表明FBA在进化过程中保证了足够的遗传稳定性,克隆的BnFBA1基因属于胞质型FBA,这与亚细胞定位预测结果一致。
3.3 需进一步研究的问题
前人研究表明,FBA基因一方面改变植物糖类物质的代谢,另一方面可调节植物的生殖生长[25],本研究中干旱胁迫下油菜产量降低是否是由于FBA促进生殖生长提前而导致产量下降,还需进一步研究。同时,后期实验进一步发掘更多的FBA基因,进一步分析蛋白二级、三级结构与抗旱性的关系,深入研究胞质型FBA调控糖代谢和生殖生长的过程及该基因家族在油菜干旱胁迫下的调节机制。
4 结论
从油菜中成功克隆获得1条FBA基因,该基因与油菜抗旱性密切相关,属于胞质型FBA。
