低盐处理对长牡蛎胚胎发育及氧化应激、能量供应和渗透调节相关酶的影响*
2020-09-17李阳春王昭萍马培振张学开崔玉婷
李阳春,王昭萍,马培振,张学开,范 超,崔玉婷
(海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003)
盐度是影响海洋生物生长存活的重要环境因子,作为具有渗透生理适应性的生物,贝类对盐度变化的适应范围很广[1]。然而,盐度的骤变仍会对贝类产生多方面的不利影响,例如,妨碍其正常的摄食、呼吸,影响心跳、鳃纤毛运动,导致其血淋巴钠离子浓度降低、免疫功能受到抑制等,最终使得贝类生长缓慢、死亡率升高[2-6]。
贝类增养殖在国内外水产养殖业中都占有重要地位,三倍体贝类以其生长快、个体大、糖原含量高、繁殖季节肥满度高、死亡率低[7]等优点,具有极高的生产推广价值。近年来,低盐诱导三倍体的方法由于具有诱导率高、操作简便、无毒无害、成本低廉等优点,已经在长牡蛎(Crassostreagigas)[7-8]、栉孔扇贝(Chlamysfarreri)[9]、海湾扇贝(Argopectenirradians)[10]、皱纹盘鲍(Haliotisdiscushannai)[11]等多种贝类中开展了研究。低盐诱导已被证明会显著降低受精卵的卵裂率和孵化率[7],然而其对贝类胚胎发育速度及发育过程中生理生化水平的影响尚未见报道。
牡蛎作为重要的海产经济贝类类群,其总产量和单位面积产量在诸多贝类类群中均居首位(1)FAO Yearbook.Fishery and Aquaculture Statistics 2016.accessed 14 October 2018.http://www.fao.org/fishery/publications/yearbooks/en。本实验选取长牡蛎为研究对象,探究了低渗诱导过程对其胚胎发育和发育初期部分酶活力的影响。由于能量代谢、抗氧化、渗透调节方面的改变都可能影响受精卵染色体的正确分离与细胞的正常分裂,因此本实验结果也能为进一步探究低盐诱导贝类三倍体的分子机理提供基础资料。
1 材料和方法
1.1 材料
实验用2龄亲贝(壳长8~15 cm)采自烟台海益苗业有限公司,挑选外壳无损伤、活力好的个体,洗刷干净待用。
1.2 方法
1.2.1 精卵获取及受精 实验用海水为过滤自然海水(盐度32,水温23~25℃),器械在操作前均用淡水清洗,严格防止精卵污染。亲贝开壳后用牙签挑取适量性腺镜检,区分雌雄。挤压雌性亲贝性腺取卵,卵液用200目筛绢过滤去除残余组织,后用500目筛绢过滤冲洗2~3遍,浸泡50 min促熟,镜检,选取发育程度较好的卵子(卵内物质致密、卵子形状近圆)混合,调整卵子密度为7 000~8 000个/mL[12]。受精前解剖取精子,300目筛绢过滤,浸泡10 min左右,挑选精子活力高的精液,以卵子∶精子=1∶(5~6)的比例进行受精。精卵混合5~10 min后,用1 000目筛绢洗卵,去除多余精子,镜检观察极体出现情况。
1.2.2 低盐诱导处理及胚胎发育观察 根据之前研究的结果,本研究采用的诱导时间为15 min;诱导时机为40%~50%受精卵出现第一极体[7-8],处理盐度的范围为4~18,每2个盐度设立一个梯度。低盐处理后转入过滤自然海水(20 L小桶)中继续培养,期间保持充气,定期搅桶避免沉底,孵化期间定时取样观察胚胎发育情况,直至发育到D形幼虫。发育时期判断标准:80%幼虫到达该时期为标志,每次观察至少3个视野,每个视野幼虫个数50左右。
1.2.3 酶活测定 由于盐度8为低盐诱导长牡蛎三倍体的最佳盐度[7-8],因此本研究也选择盐度8作为处理盐度。测定的四种指标分别为:丙酮酸激酶(Pyruvate kinase,PK)、Na+-K+-ATP酶、谷草转氨酶(Glutamic oxalacetic transaminase,GOT)和总抗氧化能力(Total- antioxidant capacity,T-AOC)。受精卵在经低盐诱导15 min后,处理组及对照组均平均分为两份,一份立即离心取样,另一份转入自然海水中恢复1.5 h,再过滤离心取样。实验所用测定试剂盒分别为:Bradford蛋白浓度测定试剂盒(去垢剂兼容型,碧云天,P0006C),丙酮酸激酶(微量法,索莱宝,BC0545),Na+-K+-ATP酶活性检测试剂盒(微量法,索莱宝,BC0065),谷草转氨酶(GOT)活性检测试剂盒(微量法,索莱宝,BC1565)。具体测定方法参照说明书进行,测定原理及酶活单位U的定义(按蛋白浓度计算)为:
(1)PK:可以催化磷酸烯醇式丙酮酸和ADP生成ATP和丙酮酸,乳酸脱氢酶进一步催化 NADH和丙酮酸生成乳酸和 NAD+,在340 nm下测定NADH下降速率,即可反映PK活性;定义每10 mg组织蛋白每分钟消耗1 nmol NADH 定义为一个酶活力单位。
(2)Na+-K+-ATPase:该酶能够分解ATP生成ADP及无机磷,因此可以通过测定无机磷的量来确定ATP酶活性。定义每小时每毫克组织蛋白中Na+-K+-ATP酶分解ATP产生1 μmol无机磷的量为一个酶活力单位。
(3)T-AOC:酸性条件下,物质还原Fe3+-三吡啶三吖嗪(Fe3+-TPTZ)产生蓝色的Fe2+-TPTZ的能力反映了其总抗氧化能力。样品的抗氧化能力以达到同样吸光度变化值(△A)所需的标准离子浓度表示。
(4)GOT:该酶可以催化天门冬氨酸和α-酮戊二酸的转氨基反应,生成草酰乙酸和谷氨酸,草酰乙酸脱羧生成丙酮酸,丙酮酸可与 2,4-二硝基苯肼反应生成 2,4-二硝基苯腙,在碱性环境显棕红色,可以间接地代表GOT的活性。定义每小时每毫克组织蛋白催化产生1 μmol丙酮酸的量为一个GOT活力单位。
蛋白浓度测定标准曲线为:
Abs = 0.032 2+0.587 8×Conc(浓度单位为mg/mL,R2=0.992 7)。
测定仪器:酶标仪(MultiskanTMFC,Thermo ScientificTM,USA)。
1.2.2与1.2.3中的实验均包含三个生物学重复,每个生物学重复包含三个技术重复。
1.2.4 数据分析 采用SPSS 19.0软件进行数据处理,配对样本T检验常用来推断同一受试对象接受两种不同的处理或某一指标在两种不同情况下总体的均值是否存在显著差异[13],因此本研究采用配对样本T检验作为分析方法,差异显著性阈值为0.05,数据以平均值±标准误(Mean±SE)表示。
2 结果
2.1 低盐诱导对长牡蛎胚胎发育的影响
受精卵经低盐诱导之后培育1 d,发育情况见表1。由表1中结果可得,本实验中牡蛎的发育较快,对照组19 h左右即到达D形幼虫期,而一般情况下(水温20~23 ℃)到达D形的时间普遍为23~24 h[14],这可能是由于本实验的孵化水温较高(24~25 ℃)所致。同时,不同低盐处理对受精卵胚胎发育不同时期的影响也不同:(1)二细胞期,所有组别的发育速度无显著差异;(2)四细胞和囊胚期,不同处理盐度发育速度出现明显断层:32、18、16>14、12、10、8 >6、4,说明盐度18和16处理对受精卵发育没有显著抑制作用,盐度8~14对受精卵发育的阻碍作用效果类似,且并未造成发育严重滞后(仅延缓0.5 h左右),而盐度4和6对受精卵发育的阻碍作用较为严重,滞后时间达到1 h左右;(3)原肠胚和D形幼虫期,发育速度的大小为:32、18、16>14、12 >10、8>6>4,这与之前研究所得出的孵化率趋势相吻合[7-8],4组D形幼虫期比对照组延缓了4 h以上,且孵化率极低(<10%),说明较低盐度的处理会对受精卵的孵化造成严重的阻碍。

表1 不同诱导盐度下长牡蛎的胚胎发育Table 1 Embryonic development under different inducing salinities
2.2 低盐处理对长牡蛎胚胎发育初期能量代谢、抗氧化及渗透调节的影响
2.2.1 低盐处理15 min及恢复1.5 h后各种酶活性的改变 本实验通过对低盐诱导15 min后处理组和对照组之间的酶活水平进行比较,反映了低盐处理对受精卵的即时影响;同时,由发育数据可看出,四细胞期(大约为处理完转入自然海水恢复1.5 h左右),各组发育速度虽无显著差异,但盐度4~12的处理组已经开始表现出一定的发育迟缓,因此,本实验还选择通过检测此时期组间的酶活水平,来探究是否由于酶活变化导致此时期发育的迟缓,结果如图1所示。
图1中可看出,处理15 min后,PK和Na+-K+-ATP酶活性显著降低,而T-AOC显著增加(且达到极显著水平),GOT 无明显改变;恢复1.5 h之后,除T-AOC外,所有酶的酶活水平在处理组和对照组之间皆无显著差异,说明经过一段时间的恢复,酶活水平也已基本恢复到正常的水平。对于T-AOC,处理组与对照组间虽存在差异,但并未到达极显著水平,且两组间T-AOC水平均值较为相近(S和CK组分别为:0.863±0.049、0.976±0.037),这说明处理组T-AOC水平在1.5 h的恢复过程中发生了回落,逐渐接近对照组水平。
2.2.2 同种酶在处理组、对照组中不同发育时期的活性 为探究受精卵能量代谢、渗透调节及抗氧化能力与胚胎发育时期的关系,本实验分别比较了处理组和对照组中,上述4种酶的活性在处理15 min及恢复1.5 h后是否有显著差异,结果见表2。从表2中可看出,所有指标在CK-15 min组和CK-1.5 h组间均无显著差异(P>0.05),说明在对照组中这4种酶的酶活水平一直保持稳定;而S-15 min组和S-1.5 h组中,Na+-K+-ATP酶水平显著上升(P=0.032),PK与T-AOC水平改变虽未达到显著水平,但十分接近显著性水平阈值(P值分别为0.057,0.055)说明在受精2h后,这3种酶的活性与处理15 min时相比发生了显著的改变,且都基本恢复到与对照组类似的水平,说明在自然海水中恢复1.5 h后,上述4种酶的活性与对照组间水平基本相当,这与2.2.1中得到的结果是一致的。从而说明,恢复1.5 h之后,酶活水平并不是造成受精卵发育迟缓的主要原因。

(S代表低盐处理组,CK代表对照组;15 min代表处理后立即测定,1.5 h代表恢复后测定;S与CK同一时期的同种酶之间具有相同字母的差异不显著(P>0.05),具有不同字母者差异显著(P>0.05),*表示差异极显著(P<0.01)。S refers to the treatment group,CK refers to the control group.15 min means to measure the enzyme activities right after hypotonic treatment;1.5 h means to measure after recovering in normal sea water.Different letters indicate significant differences in certain enzyme activities between S and CK groups at 15 min and 1.5h respectively (P>0.05),* indicates the very significant difference (P<0.01).)图1 处理15 min及恢复1.5 h酶活水平的比较Fig.1 Enzyme activities after hypotonic treatment for 15 min and recovery for 1.5 h
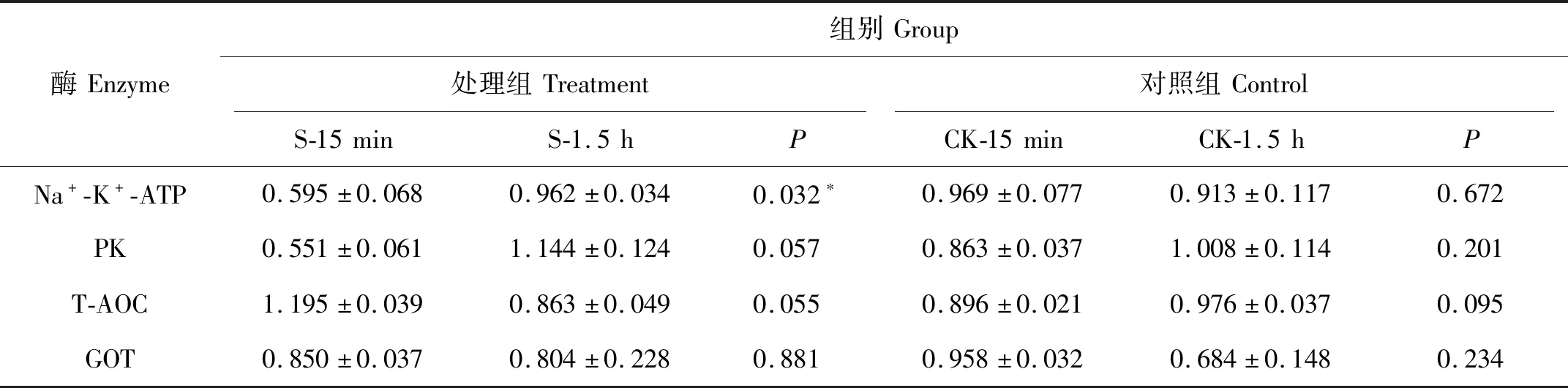
表2 处理组和对照组组内的配对样本T检验Table 2 Pared-sample T test between the control and treatment group
3 讨论
3.1 低盐诱导对牡蛎胚胎发育的影响
盐度是影响贝类生长发育的重要环境因素之一。本研究证明,对释放了第一极体的长牡蛎受精卵用盐度8处理15 min,在诱导其产生多倍体的同时还会导致其胚胎发育明显受阻。孟乾等[15]认为长牡蛎“海大1号”胚胎发育的最适环境盐度为30,二者的研究都表明,盐度偏离最适值时,孵化速度都会明显减慢,伴随着孵化率的降低和畸形率的升高。同时,孟乾等[15]的研究还显示环境盐度10以下牡蛎受精卵即无法孵化,而本研究中盐度为4仍有极少量幼虫孵化,这可能是因为孵化期间高、低盐的刺激对牡蛎胚胎发育的阻碍是持续性的,而本实验仅在减数第二次分裂时期对幼虫进行了短暂时间(15 min)的低盐处理,并未进行长时间胁迫,因此对受精卵孵化产生的影响有限。此外,陈洪发等[8]的研究表明,亲贝的培育盐度,以及诱导完成后至孵化出D形幼虫这一阶段的环境盐度对于三倍体的诱导效果也有显著影响:培育盐度为26、30、34和38时,诱导最佳盐度为8;而环境盐度为22时,最适诱导盐度为6;同时,环境盐度过高(盐度为38)时,卵裂率和孵化率均显著下降,提示在不同盐度的养殖海区开展低盐诱导牡蛎三倍体工作时,应充分考虑海区盐度对三倍体诱导效果的影响。
3.2 低盐诱导对胚胎发育初期能量供应、氧化应激和渗透调节的影响
低盐条件下,为满足个体的渗透调节需要及细胞稳态的维持,贝类的能量需求通常会增加[1,16];渗透压的急剧下降还会诱发活性氧的瞬间增加,引起抗氧化酶活性的改变[17]。丙酮酸激酶(Pyruvate kinase,PK) 可以催化糖酵解过程中的最后一步反应,是糖酵解过程中的主要限速酶之一[18];谷草转氨酶(Glutamic oxalacetic transaminase,GOT)可以催化可逆转氨基反应,是氨基酸代谢的重要酶[19];Na+-K+-ATP酶(又称钠钾泵,Sodium potassium pump)能够利用ATP水解供能调控Na+和K+的跨膜转运,维持胞浆离子浓度,在渗透调节中发挥重要作用[20];而总抗氧化能力(Total antioxidant capacity,T-AOC)试剂盒则是测定细胞中各种抗氧化物质和抗氧化酶等构成的总抗氧化水平,可以反映出受精卵的氧化应激情况。
本实验中,低盐诱导15 min后,处理组中丙酮酸激酶的活性有显著降低,说明低渗条件下贝类的能量供应(尤其是糖酵解产生ATP的过程)受到了一定抑制;而GOT 无显著变化则说明此时段GOT相关的氨基酸代谢没有受到显著影响,并未由于葡萄糖代谢供能受阻转而提高氨基酸代谢供能水平。同时,总抗氧化能力(T-AOC)水平有显著增加,间接反映了低盐环境对贝类产生的氧化胁迫。减数分裂期间纺锤体的组装、染色体的分离及收缩环的形成都很容易受到外界环境改变(如ATP合成受阻等)的影响,导致分裂异常从而产生多倍体[21-24],因此,受精卵能量代谢的不足及氧化损伤可能是低盐处理产生三倍体的原因之一。
低渗环境中细胞内的Na+会发生外流,为维持细胞渗透平衡,通常需要Na+-K+-ATP酶的作用以促进Na+的主动吸收,因此该酶活性往往会升高[25-27];然而前人研究也报道了其活性在低渗条件下的多种变化趋势,与物种及其所处的温、盐环境都密切相关。田相利等的研究表明,半滑舌鳎鳃丝Na+-K+-ATP酶活性随盐度的升高而升高[28];在华贵栉孔扇贝幼贝中开展的研究结果显示,Na+-K+-ATP酶的活性随着盐度的升高先升后降[29];而在黑鲷和褐牙鲆幼鱼中开展的研究则表明,盐度变化对其Na+-K+-ATP酶活性的影响并不显著[30-31]。对于牡蛎受精卵来说,其细胞膜在低渗条件下会受到直接的破坏,可能导致膜上Na+-K+-ATP酶活性的降低[29];同时,牡蛎在胚胎发育初期缺乏复杂的渗透调节系统,这也可能是其Na+-K+-ATP酶活性在渗透胁迫条件下不升反降的原因之一。
转入自然海水恢复1.5 h后,这3种酶的水平基本恢复了正常,说明短暂的低渗处理对受精卵能量代谢、氧化应激和渗透调节的影响是暂时性的,它可能是诱导三倍体产生的原因,但不一定是后期胚胎发育受阻的主要因素。本课题组近期的研究显示(未发表),低盐处理会对受精卵DNA造成难以修复的损伤,使其复制和转录过程中产生严重的错误,这可能是导致胚胎发育畸形和速度减慢的原因之一。
此外,当渗透压降低时,仅依靠糖代谢往往难以满足急剧增加的能量需求,海洋生物倾向于提高蛋白质和脂质的分解以提供额外的能量[32-33]。同时,通过脱氨基作用可以减少细胞内游离氨基酸的含量,降低体内的渗透压,从而应对外界的低盐环境[34]。谷草转氨酶(GOT)可以催化脱氨基作用,是促进氨基酸分解和蛋白质的供能的关键酶之一。本实验中,GOT的含量一直都未发生显著改变,说明此时段氨基酸的代谢水平并没有受到葡萄糖代谢供能受阻的影响,细胞也并未通过增加氨基酸代谢来降低胞内渗透压,以维持与外界的渗透平衡。考虑到受精卵作为一个单细胞个体,并不具备多细胞贝类成体复杂的渗透调节系统,同时短时间的低盐处理(15 min)可能也不足以给受精卵提供足够的时间对外界环境改变做出相应的响应[35],因此在氨基酸代谢方面并没有显著的应激反应。当然,仅检测GOT一个酶的水平并不能说明氨基酸代谢一定没有发生改变,更全面的分析还有待进一步探究。
4 结语
本研究观察了低盐诱导对长牡蛎三倍体胚胎发育的影响,及其抗氧化和能量代谢相关酶活性的改变。结果表明,低盐诱导会导致牡蛎胚胎发育严重迟缓,到达D形幼虫的时间最多延缓了4 h以上;同时,低盐处理可能会导致牡蛎受精卵受到严重的氧化胁迫、糖代谢供能被抑制、渗透调节受阻,这可能是导致牡蛎受精卵染色体异常分离从而产生三倍体的原因之一。本研究结果为进一步探究低渗诱导贝类三倍体的机理提供了重要的理论基础和技术支持。
