春夏季黄东海溶解态丙烯酸的分布研究*
2020-09-17谢丽君刘春颖马乾耀杨桂朋
谢丽君,吴 茜,刘春颖,马乾耀,杨桂朋
(中国海洋大学海洋化学理论与工程技术教育部重点实验室,化学化工学院,山东 青岛 266100)
丙烯酸(Acrylic Acid,AA)是一种短链有机酸,除陆源输入外,海洋中生源AA是由β-二甲基巯基丙酸内盐(DMSP,分子式 (CH3)2SCH2COOH)裂解产生的[1-2]。DMSP是海洋中一种重要的有机硫化合物,具有调节渗透压、抗氧化和冷冻保护的功能,是海洋中浮游植物和细菌的重要碳源和硫源。DMSP由微藻、大藻、珊瑚和异养细菌产生[3],并受浮游动物摄食、病毒感染及细胞衰老等过程的调控[4-6]。总DMSP(DMSPt)包括颗粒态DMSP(DMSPp)和溶解态DMSP(DMSPd),主要通过两种途径裂解,第一种涉及去甲基化过程,通过DMSP去甲基酶来产生甲基硫醇盐(3-methiolpropionate,MMPA),然后将MMPA转化为甲硫醇和AA[7-9]。第二种是在细菌及藻体内的DMSP裂解酶的催化作用下将DMSP裂解为AA及等摩尔的二甲基硫(Dimethylsulfide,DMS)[10]。
目前国际上已对DMSP的裂解产物DMS进行了广泛的研究,但是对DMSP的另一裂解产物AA的来源、分布及迁移转化的研究较少。到目前为止,对AA的研究主要集中于其在海洋生态系统中的作用,例如当有毒藻类产生的AA达到一定浓度时,对水生生物具有急性毒性[1]。水体中AA的去除主要有两种机制:微生物降解[11]和光化学降解[12]。AA对于细菌的生长具有两重性,它是细菌的主要碳源之一[13-14],但AA浓度较高时又可抑制海洋中细菌的生长[15-16]。Yang等[17]报道了夏季南极沿海棕囊藻爆发期间溶解态AA(AAd)的浓度(0.001~0.510 μmol·L-1),其含量与藻细胞密度呈现显著的相关性。Gibson等[18]12月在南极沿岸测定的表层海水中AAd浓度高达1.2 μmol·L-1,而11和1月则低于10 nmol·L-1。
黄海、东海均为西北太平洋的边缘海,其大陆架面积约占该海区的70%,是世界上最重要的大陆架海区之一,也是中国近海的代表性海域[19-20]。黄海和东海以长江口北岸的启东角与韩国济州岛西南角之间的连线为界,该海区水文条件复杂,高温、高盐和低营养的黑潮水会通过水团交换影响AAd的分布[21-22];黄海北部有多条河流注入,受人为活动影响显著,且存在温差大、盐差小的黄海冷水团,是研究AAd受陆源输入影响的理想海域;另外,长江携带大量的淡水、悬浮泥沙、营养盐和污染物汇入黄东海,为AAd的生物生产提供了条件[23],因此,本文将黄东海作为一个整体来研究AAd的浓度分布及影响因素。Wu等[22]研究了夏、冬季长江口和东海AAd的浓度分布及其降解规律,发现夏季东海海水中AAd浓度与叶绿素a(Chl-a) 和DMSPd浓度呈正相关性。Liu等[24]探讨了秋季黄渤海AAd、DMS和DMSP的浓度分布及影响因素,发现该海域表层海水中AAd浓度与DMSPd、Chl-a浓度均呈显著正相关性。除了上述研究,黄东海海域AAd其它方面的研究鲜有报道。因此,本文对春、夏季黄东海表层海水中AAd的水平分布,长江口和黄海冷水团区域AAd的垂直分布进行研究,结合溶解有机碳(DOC)等参数来探讨沉积物间隙水中AAd的分布特征,并探究了海水-沉积物界面对AA的贡献,以深入地认识AA在海洋生态系统中的作用和地位,本研究对于进一步认识海洋硫循环具有重要意义[25]。
1 材料及方法
1.1 采样站位
分别于2017年3月17日~4月10日(春季)和2018年6月25日~7月12日(夏季)对黄东海海域的AAd、DOC、Chl-a、细菌丰度、DMS及DMSP进行观测。春、夏季航次分设57和66个站位,取各站位(见图1(a)、(b))表层的水样研究AAd的水平分布,选取B、P两个断面来分析AAd的垂直分布,春季航次在E2站位作连续观测。用24 L的Niskin采水器收集水样,温度和盐度由Seabird 911 plus CTD传感器现场测定,AAd水样用孔径为0.2 μm的重力滤器过滤,将滤液转移至带有Teflon内衬盖的40 mL玻璃瓶中于4 ℃下避光保存。使用箱式采泥器采集表层沉积物样品(见图1(c)、(d)),将Rhizon土壤水分采样器的一侧插入沉积物中,另一侧连接注射器针头并插入至真空采血管来收集间隙水,用孔径为0.2 μm的聚醚砜滤器过滤装于上述玻璃瓶中,间隙水中AAd样品的保存方法与海水中一致,DOC样品冷冻保存,上岸后1个月内完成样品测定。
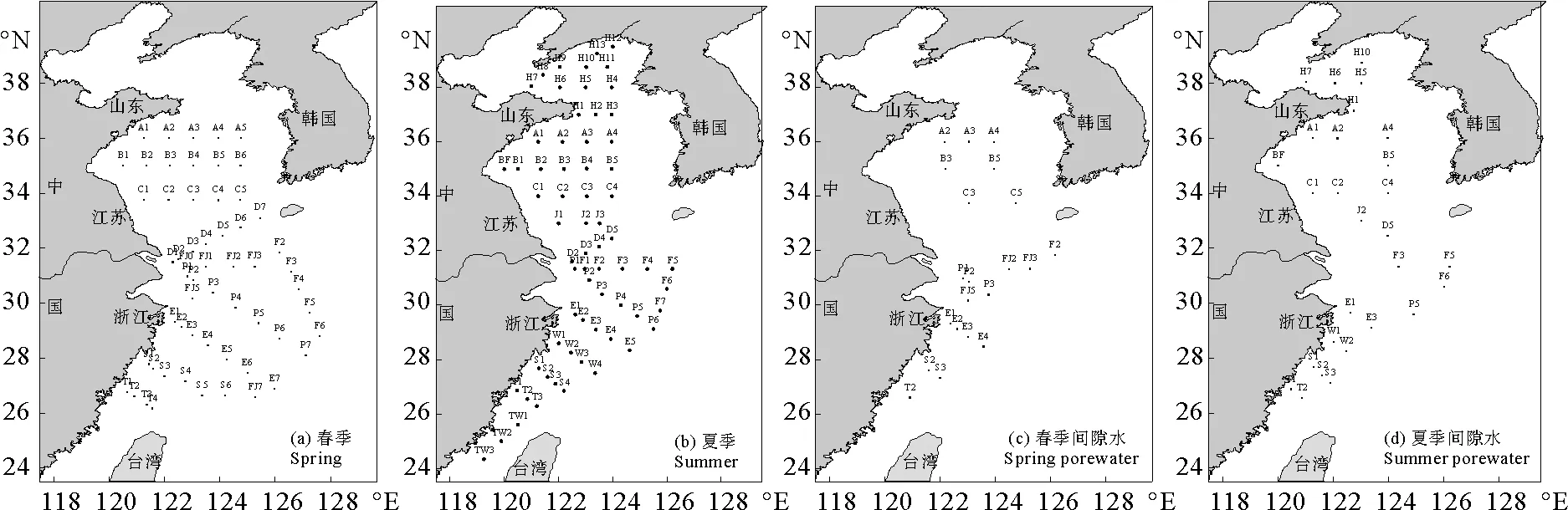
图1 黄东海采样站位Fig.1 Location of sampling stations in the Yellow Sea and the East China Sea
1.2 测定方法
AAd的测定:用L-2000高效液相色谱仪(日立,日本)测定[18],流动相为0.35%的磷酸溶液和甲醇,流速为0.5 mL· min-1,经柱温为40 ℃的Agilent SB-AQ-C18分离柱,用波长为210 nm的紫外检测器进行检测。检出限为4 nmol·L-1,精密度为1.3%~1.6%[26]。采用外标法测定海水中AAd的浓度,用人工海水将AA原液配制成一系列标准溶液,按照上述方法测定标准峰面积,绘制工作曲线。由于间隙水中AAd浓度远高于海水,用Milli Q水稀释50倍后再重复上述操作(Milli Q水中AAd浓度低于检出限)。
DOC的测定:在TOC-VCPH总有机碳分析仪(岛津,日本)上测定不同浓度梯度的邻苯二甲酸氢钾溶液,以此为标准来测定水样中DOC的浓度。精密度为0.005 mg·L-1,相对标准偏差小于±2%[27]。
Chl-a的测定:用Whatman GF/F滤膜过滤500 mL水样,将滤膜用铝箔包裹,冷冻保存。返回实验室后,在4 ℃下用10 mL 90%的丙酮避光萃取24 h,离心获取上清液,用F-4500荧光光度计(日立,日本)测定[28]。
细菌丰度的测定:采用DAPI直接计数法来测定细菌的丰度[29]。加入2 mL样品及1 mL DAPI工作液于滤器(具有0.2 μmWhatman GF/F玻璃纤维滤膜)中,黑暗条件下染色10 min,滤去溶液,将滤膜制片,在荧光显微镜蓝光道、油镜条件下,随机选取10个视野,计算具有细菌形态且呈亮绿色的细胞数。
DMS和DMSP的测定:将2 mL水样注入体积为10 mL的血清瓶并加盖密封,用高纯氮气对海水进行吹扫,吹出的DMS经干燥管,富集于装有液氮的捕集管中。经加热解析,载气(氮气)将捕集管中的DMS气体携带进入岛津GC-2014气相色谱仪,经火焰光度检测器进行检测。色谱柱选用(3m×3mm)10% DEGS/60~80目ChromosorbW-AW DMCS玻璃填充柱,柱温设为70 ℃。该法检出限为0.15 ng S,相对标准偏差小于5%[30]。DMS 样品采用外标法定量,用无水乙醇将优级纯DMS配制成一系列标准溶液,测定标准样品的峰面积,绘制工作曲线。对DMSP进行碱解,生成等摩尔的DMS,按照上述方法间接求得DMSP的浓度。
数据分析:采用SPSS 16.0软件对两组数据进行相关性分析(p<0.05即可证明两组数据存在相关性),通过T检验判定两组数据是否存在显著性差异(p<0.05即可证明两组数据存在显著性差异)[31]。
2 结果与讨论
2.1 2017年春季黄东海AAd的研究
2.1.1 表层海水中AAd的水平分布 2017年研究海区春季表层海水温度在6.9~24.5 ℃之间(见图2),盐度介于25.8~34.9,受高温高盐的黑潮影响,温度和盐度由东南向西北逐渐减小。Chl-a作为衡量浮游植物生物量的指标,其浓度范围是0.07~8.80 μg·L-1,近岸总体高于远海。细菌丰度在(0.12~13.57)×108cells·L-1之间,整体上南黄海细菌丰度不高。
2017年黄东海表层海水中AAd的浓度为4.15~65.89(平均:(13.94±9.89)nmol·L-1),远低于王莉莉[32]报道的2011年春季胶州湾AAd含量(平均:150 nmol·L-1)。这是由于工业废水和生活污水的排放,较多的陆源AAd输入胶州湾,而研究海区受人为活动影响程度相对较小,因此AAd含量较低。Sicre等[33]也发现化工厂排放的含有AAd的有机污染物,能随河水流入海洋,成为海洋中AAd的重要来源。黄东海AAd的分布特点为近岸浓度高于远海,这是由于远海Chl-a浓度低,即浮游植物量少,产生较少的AAd;同时,远海细菌丰度较高,对AAd存在明显的消耗;此外,陆源输入对近岸影响更为明显[32],这些原因都造成了近岸海水的AAd浓度高于远海。AAd浓度最高值出现在福建省宁德以东海域,与沿岸流携带的丰富营养盐促进了藻类生长有关。调查海区内AAd浓度呈现南北高,中间低的趋势(见图2(e)红线为分界线,蓝线为黄东海分界线),南北部AAd与Chl-a缺乏相关性,但AAd浓度/盐度均与盐度呈负相关(r=-0.660,n=12,p=0.019),说明AAd高值与陆源输入有关,而中部海域受春季长江冲淡水影响相比于夏季程度较小,Chl-a含量较低,同时细菌丰度较高,AAd产生量少且细菌消耗多,使该海区AAd浓度相对较小。AAd与DMSPd存在正相关性(r=0.306,n=47,p=0.037),这与AAd是DMSP的裂解产物有关,该结果与黄渤海表层海水中AAd的研究结果一致[34]。国际上使用DMS/Chl-a表征单位生物量释放DMS的情况[35],因此采用AAd/Chl-a评估藻类生产AAd的能力,其比值为1.09~299.52(平均:(40.99±49.06)mmol·g-1),AAd/Chl-a与Chl-a表现为负相关性(r=-0.355,n=47,p=0.014),表明浮游植物量低的海域,AAd高产藻的比例较高。
图2 2017年春季黄东海表层海水中温度(a)、盐度(b)、Chl-a浓度(c)、细菌丰度(d)、AAd浓度(e)和AAd/Chl-a(f)的水平分布Fig.2 Horizontal distributions of temperature(a),salinity (b),concentrations of Chl-a(c),bacterial abundance (d),concentration of AAd (e) and AAd/Chl-a (f) in the surface seawater of the Yellow Sea and the East China Sea during spring,2017
2.1.2 研究海域AAd的周日变化 由2017年春季航次E2站位的连续观测可知,AAd的浓度范围是4.72~29.42 nmol·L-1(见图3)。从早上6点至12点,由于光合作用逐渐增强,使得AAd浓度在12点时出现一个峰值。12点至14点光化学氧化作用较强,AAd浓度降低,随后浓度上升,在18点出现最大值,与刘龙等[36]报道的东海DMSP浓度最高值出现在下午时刻相一致,该时段浮游动物摄食活动增强[37],致使藻细胞破裂释放较多的DMSP并进一步产生较多的AAd,同时AAd的光化学氧化作用较弱,其降解速率降低。16点至20点AAd与细菌丰度变化规律一致,由于细菌可释放DMSP裂解酶,DMSP裂解量增大,AAd的含量相应增多。10点至22点,AAd的浓度变化趋势与Chl-a存在正相关性(r= 0.851,n=7,p=0.015),说明该时间段内AAd浓度主要受浮游植物量的影响。
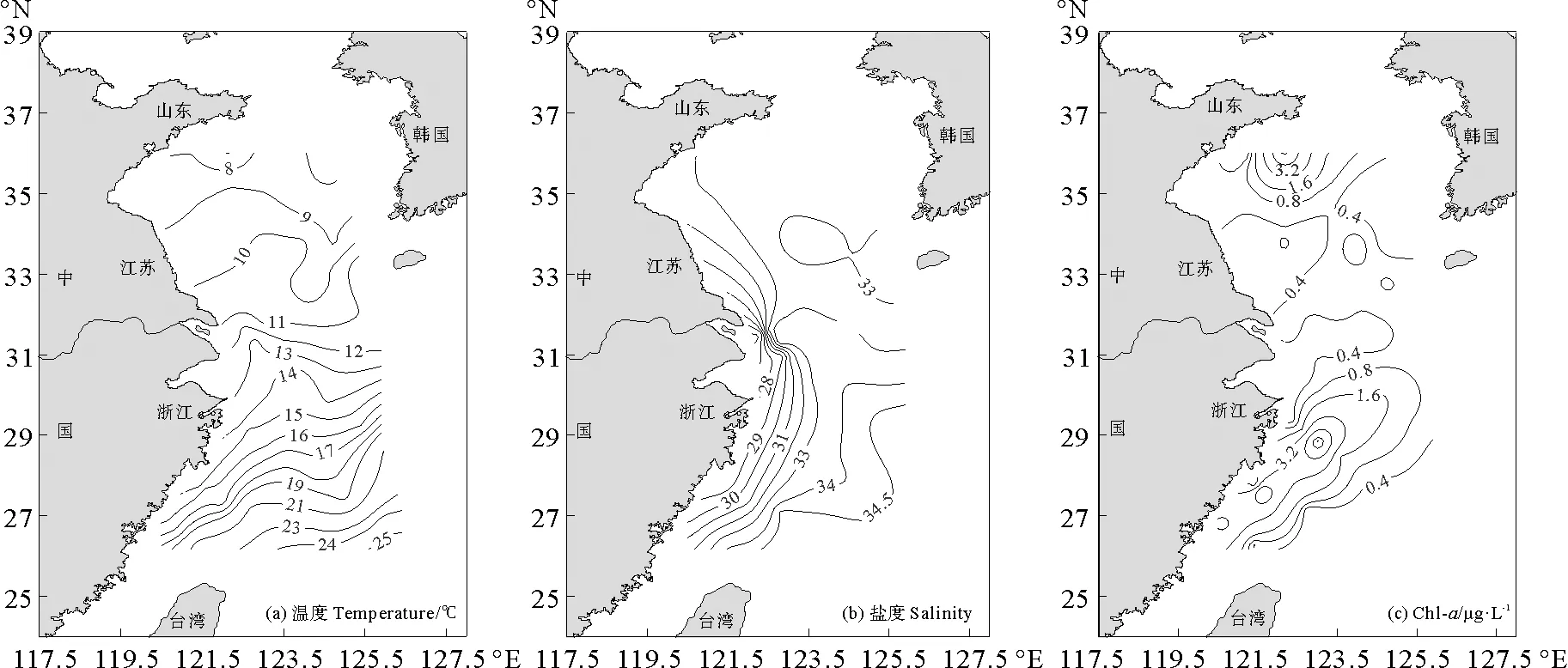
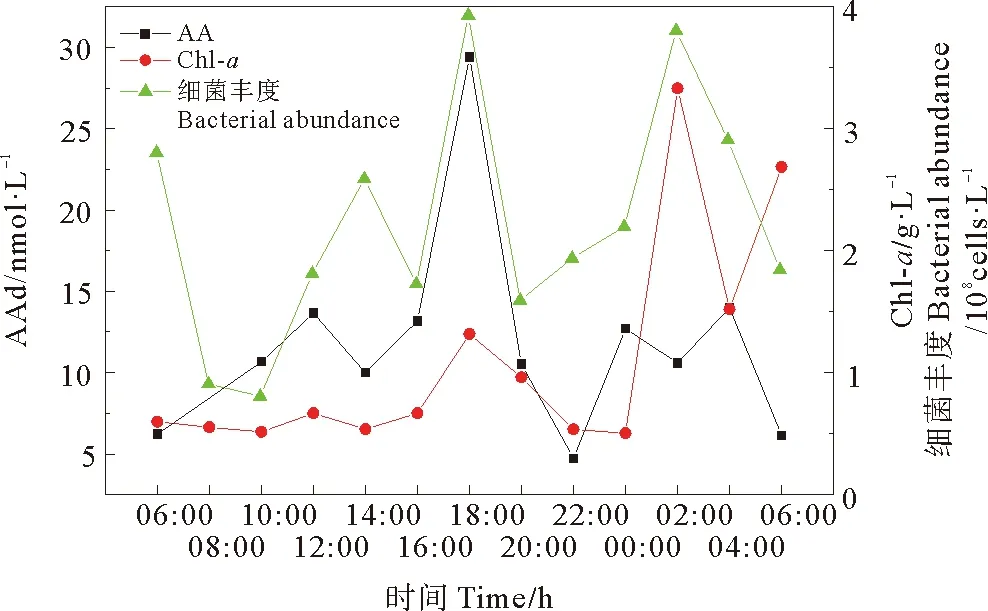
图3 春季东海E2站位Chl-a浓度、细菌丰度和AAd浓度的周日变化Fig.3 Diurnal variations of concentration of Chl-a,bacterial abundance and concentration of AAd at station E2 in the East China Sea during spring
2.1.3 垂直分布 B断面处于低温、温差大、盐差小的南黄海冷水团区域,被陆地三面包围,该海域生产力水平较高,是受人为活动影响较大的海域[38]。春季该断面温度和盐度垂直混合十分均匀,说明春季B断面并未出现南黄海冷水团,温度和盐度均在离岸较近和较远的站位出现低值,而两者之间的站位较高(见图4)。Chl-a含量近岸高于远海,人类活动使近岸海水中含有丰富的营养盐,促进藻类的生长,导致Chl-a含量升高。该断面表层水中细菌丰度高于底层。B3站位有一股底层水向上涌流,底层水细菌丰度最低。

图4 春季黄东海B断面温度(a)、盐度(b)、Chl-a浓度(c)、细菌丰度(d)、AAd浓度(e)和AAd/Chl-a (f)的垂直分布Fig.4 Vertical distributions of temperature (a),salinity (b),concentration of Chl-a(c),bacterial abundance (d),concentration of AAd (e) and AAd/Chl-a (f) in transect B of the Yellow Sea and the East China Sea during spring
B断面AAd浓度介于4.23~20.22 nmol·L-1,在中部海域及远离陆地的B6站位Chl-a含量较低,却出现AAd浓度高值,说明该海域的藻类具有较高的AAd产生能力,该结果与田伟等[39]报道的冷水团区域优势藻种为甲藻(AA高产藻)相一致。研究区域海水中AAd含量与DMSPd含量存在相关性(r=0.500,n=20,p=0.034),这与AAd是DMSP的裂解产物有关。
P断面位于长江口附近,春季该断面温度和盐度不存在分层现象(见图5),受长江冲淡水影响,该断面盐度由长江口向外逐渐增大。该断面Chl-a浓度表层高于底层,在P4站位表层出现最大值。细菌丰度分布特点与Chl-a相似,最大值站位与Chl-a一致。
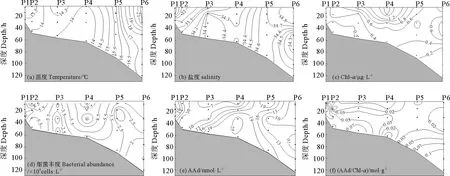
图5 春季黄东海P断面温度(a)、盐度(b)、Chl-a浓度(c)、细菌丰度(d)、AAd浓度(e)和AAd/Chl-a (f)的垂直分布Fig.5 Vertical distributions of temperature (a),salinity (b),concentration of Chl-a(c),bacterial abundance (d),concentration of AAd (e) and AAd/Chl-a (f) in transect P of the Yellow Sea and the East China Sea during spring
AAd浓度范围为4.15~29.72 nmol·L-1,最高值略高于B断面。P4站位的0~20 m层Chl-a浓度较高,而AAd值较低,这与该海域的主要藻种有关。研究表明,长江口各季节优势藻种均为AA低产藻,以硅藻为主[40]。P6站位受黑潮的影响,低营养盐的黑潮水会限制藻类的生长,使得叶绿素含量低,从而造成AAd浓度低。AAd与DMS(P)之间无明显相关性,且AAd浓度/盐度与盐度存在负相关性(r=-0.511,n=22,p=0.015),表明陆源输入比DMSP的裂解对AAd浓度的影响更为显著。AAd/Chl-a比值与Chl-a浓度分布呈相反的趋势,说明藻生产AAd的能力与浮游生物量并不一致。
2.2 2018年夏季黄东海AAd的研究
2.2.1 表层AAd的水平分布 2018年夏季黄东海表层水温度在15.5~28.2 ℃之间(见图6),呈现出近岸低远海高的趋势。盐度介于23.6~34.2,长江口附近盐度较低,与夏季长江冲淡水有关。Chl-a含量介于0.12~8.22 (平均:(1.16±1.49)mg·L-1),由于温度、光强适宜藻类生长,使研究海区夏季表层水Chl-a含量略高于春季((1.12±1.89) mg·L-1),东海海域两季节Chl-a分布趋势相似。细菌丰度在(0.57~42.38)×108cells·L-1之间,在闽浙沿岸海域丰度较高。
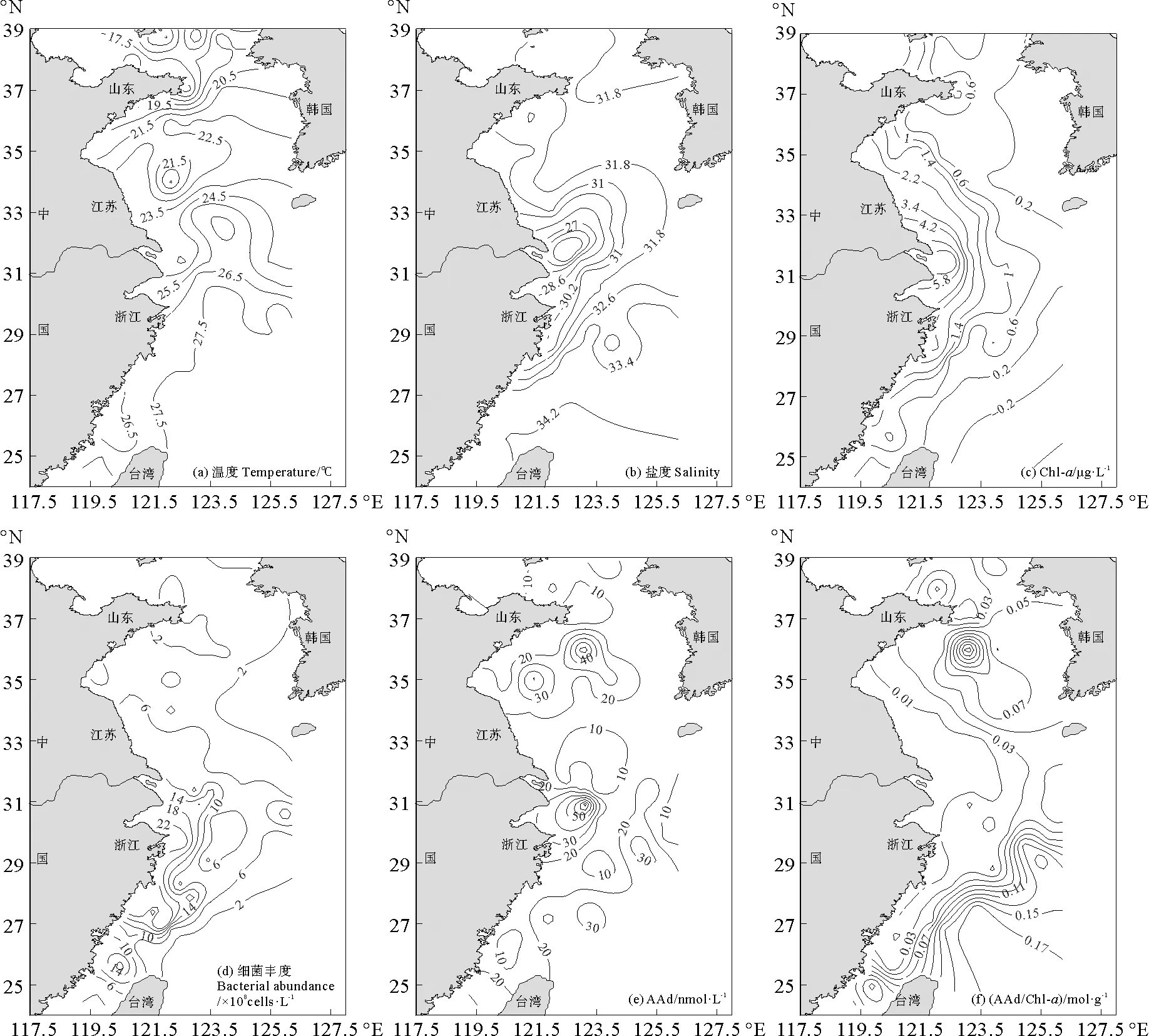
图6 2018年夏季黄东海表层海水中温度(a)、盐度(b)、Chl-a浓度(c)、细菌丰度(d)、AAd浓度(e)和AAd/Chl-a (f)的水平分布Fig.6 Horizontal distributions of temperature (a),salinity (b),concentration of Chl-a(c),bacterial abundance (d),concentration of AAd (e) and AAd/Chl-a (f) in the surface seawater of the Yellow Sea and the East China Sea during summer,2018
2018年研究海区表层水AAd浓度为4.12~86.97(平均:(18.89±15.23)nmol·L-1),该结果与Wu等[23]对东海表层海水的研究所得结果大体一致,但远高于Tyssebotn等[41]测定的秋季墨西哥湾AAd (0.8~2.1 nmol·L-1)浓度。Tyssebotn的样品储存方法与本论文方法存在差异,他们于-20 ℃冷冻保存或收集样品后直接测定,研究表明,冷冻会使DMSP分解产生AA[26],但墨西哥湾DMSP浓度低于本研究海区,且温度相对较高,光化学降解更为显著,限制了AAd的释放[41]。北黄海样品AAd浓度普遍低于平均值,而南黄海样品AAd浓度最高可达69 nmol·L-1,南黄海AAd浓度/盐度与盐度存在正相关(r= 0.651 8,n=13,p=0.016),表明AA的含量与陆源输入无关,该海区的AAd分布为生源控制。AAd浓度远高于DMSPd和DMS,进一步证明了去甲基化过程是DMSP的主要裂解途径,且DMSPp的降解是AAd的重要来源。AAd/Chl-a可用来评估藻类生产AAd的能力,该比值介于0.66~215.83(平均:(40.05±53.65) mmol·g-1),呈现出近岸低外海高的趋势。东海其他海域AAd及Chl-a浓度略低于长江口,而AAd/Chl-a值则明显高于长江口。尽管东海的优势藻种为AAd高产藻甲藻[42],但浮游植物量相对较低,限制了AAd浓度的增多,而长江口受长江冲淡水及黄海暖流形成的上升流的影响,出现AAd浓度高值,这与Wu等[22]研究的夏季东海及冬季长江口相关结果一致。
2.2.2 垂直分布 夏季B断面位置与春季B断面相似,都处于南黄海冷水团区域。受夏季黄海冷水团的影响,温度和盐度出现分层现象(见图7),盐度由表层至底层逐渐增大,温度则呈现逐渐减小的趋势。近岸海域Chl-a含量偏高,与春季分布一致。细菌丰度近岸高于远海,在水深20~30 m处含量较高。B3~B5站位细菌丰度由表层至底层逐渐降低,这与李洪波等[43]的研究结果一致。
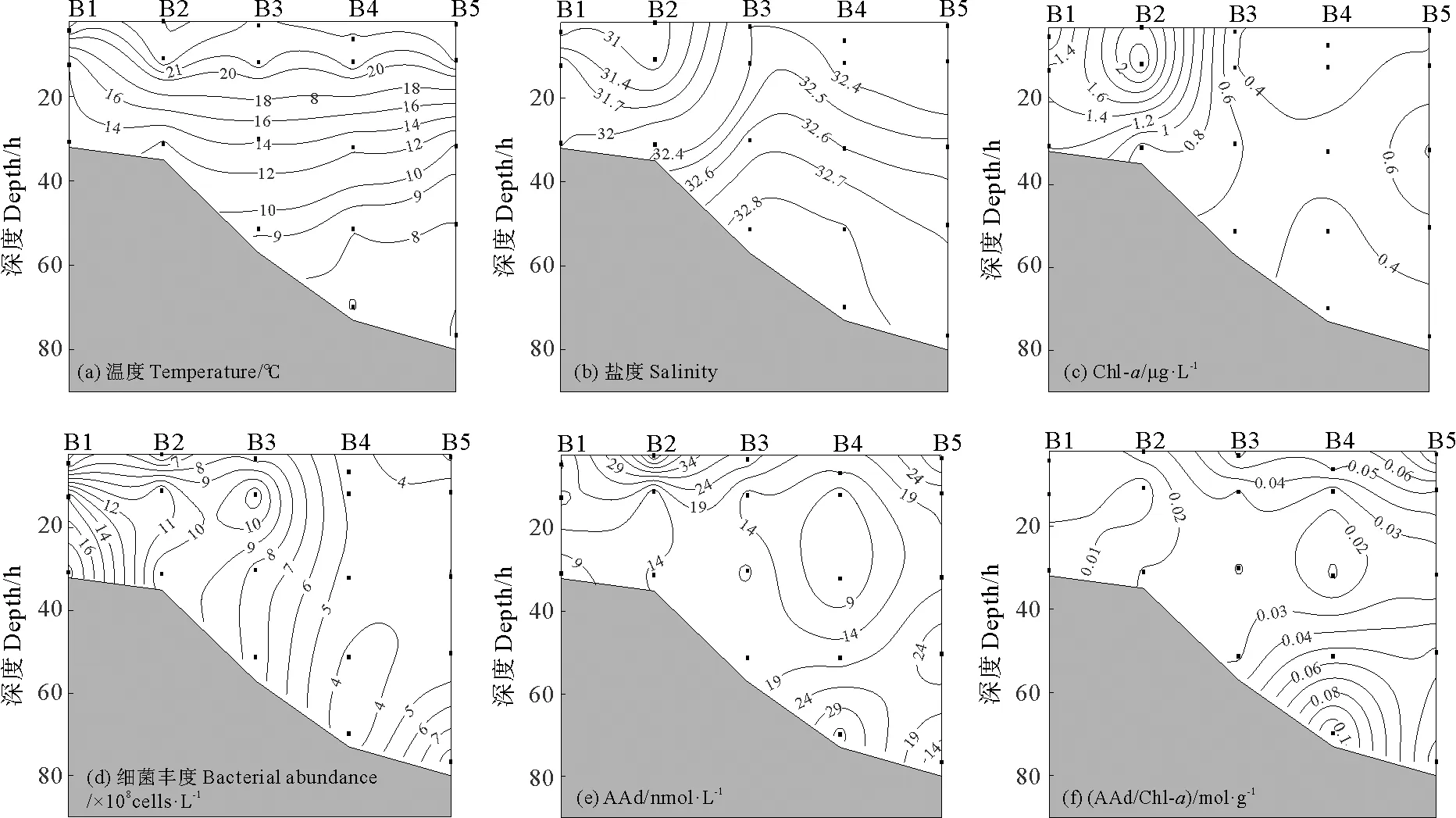
图7 夏季黄东海B断面温度(a)、盐度(b)、Chl-a浓度(c)、细菌丰度(d)、AAd浓度(e)和AAd/Chl-a (f)的垂直分布Fig.7 Vertical distributions of temperature (a),salinity (b),concentration of Chl-a(c),bacterial abundance (d),concentration of AAd (e) and AAd/Chl-a (f) in transect B of the Yellow Sea and the East China Sea during summer
夏季B断面AAd浓度在4.12~35.64 nmol·L-1之间,B2站位表层水Chl-a含量较高,较高的浮游植物量产生大量的AAd,且细菌丰度低,AAd的消耗较少,同时表层浮游动物摄食使藻类释放较多DMSP,使该站位AAd浓度较高。B4站位底层海水中也出现AAd浓度高值,较低的细菌丰度消耗较少的AAd,同时该海域的低温能够促进DMSP的释放[44],裂解从而产生更多AAd。此外,Wu等[22]建立了由温盐预测AAd和DMS(P)浓度的线性回归模型,表明温度对它们在海洋中的分布起了重要作用。AAd和其他参数不存在显著相关性,与其复杂的来源及降解途径有关,该结果与刘春颖等[38]的研究一致。
夏季P断面温度与盐度出现分层现象,长江口近岸温度和盐度相对较低,由近岸向外海逐渐升高,Chl-a的分布与春季明显不同,近岸高于远海,最大值出现在距长江口最近的P1站位表层,与夏季河水径流量大,携带较多的营养盐有关[45]。细菌丰度与Chl-a分布呈现出相反的趋势,在远海P5站位出现最大值。
夏季P断面AAd浓度介于5.78~86.97 nmol·L-1,最高值是春季P断面最高值的三倍左右,出现在P2站位表层水中,该海区Chl-a含量较低,较低的浮游植物量限制了AA的产生,而AAd浓度/盐度与盐度存在负相关性(r=-0.433,n=25,p=0.031),说明夏季长江冲淡水影响明显,该处输入了大量的陆源AAd。在P3站位底层,由于长江冲淡水携带的大量泥沙与海水的混合过程降低了海水的透明度,导致该海域光合作用不充分,不利于藻类的生长,DMSP的产生量下降使AAd含量偏低。该断面AAd与细菌丰度存在正相关(r=0.414,n=25,p=0.039),因为温度适宜细菌生长,产生更多DMSP裂解酶,从而提高了AAd的产生量。AAd、AAd/Chl-a与Chl-a分布规律相似,均呈现表层高底层低的趋势(见图8)。Wu等[22]研究了夏季长江口AAd的浓度范围为10.12~163.97 nmol·L-1,高值站位与本文相似,出现在中层和底层,是台湾暖流所带来的富营养所致[46]。
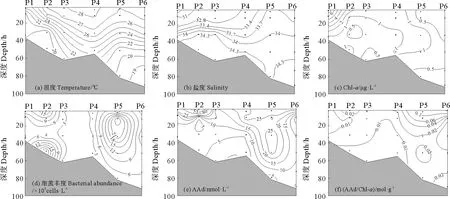
图8 夏季黄东海P断面温度(a)、盐度(b)、Chl-a浓度(c)、细菌丰度(d)、AAd浓度 (e)和AAd/Chl-a (f)的垂直分布Fig.8 Vertical distributions of temperature (a),salinity (b),concentration of Chl-a(c),bacterial abundance(d),concentration of AAd (e) and AAd/Chl-a (f) in transect P of the Yellow Sea and the East China Sea during summer
2.3 春夏两季节表层海水中AAd分布对比
研究区域夏季表层海水中AAd的平均浓度高于春季(见表1)(p<0.05),这是由于夏季细菌丰度较高(p<0.05),可释放更多的DMSP裂解酶,以提高DMSP的降解量[47]。由DMSP的降解途径可知,AAd/(DMSP+AAd)可用来描述海水中DMSP的降解比例,春季DMSP的降解比例为30%,夏季为26%,这与Gibson等[18]在南极浮游植物水华期间测得的DMSP降解率35%相差不大。DMS/AA可代表DMSP的酶解途径占两种降解途径的比例,从DMS/AAd值(夏季(0.64±0.88),春季(0.78±0.81))来看,AAd与DMS含量并无悬殊差异,该结果与Yang[17]等的报道一致,南极海域藻华时期 AA 和 DMS 含量相当。DMSP的两种裂解方式中,主要裂解过程产生AA,虽DMS的光化学去除及生物摄取率均高于AAd,但AAd占AA比重为40%~59%,DMS几乎全为溶解态[41],因此,AAd和DMS含量相当。两季节AAd/Chl-a平均值(春季(40.99±49.06) mmol·g-1,夏季(40.05±53.65) mmol·g-1)高于Gibson等[18]报道的南极海域藻华时的32.8 mmol·g-1,虽然南极优势藻种为AA高产藻甲藻,可能本研究海区受陆源输入的影响导致AAd/Chl-a平均值较大。

表1 春夏季表层AAd (平均浓度)及其他参数的对比Table 1 Comparisons of AAd (mean values) and other parameters in spring and summer
2.4 间隙水中AAd的分布
春季黄东海沉积物间隙水中AAd的浓度为30.89~131.57(平均:(86.21±30.61)μmol·L-1),夏季为5.75~84.86(平均:(38.78±31.73)μmol·L-1),从图9中可以看出,春季沉积物间隙水AAd浓度高值出现在南黄海,夏季则为浙江沿岸。春夏季沉积物间隙水中AAd的浓度比海水AAd高出至少三个数量级,该结果与Vairavamurthy等[48]的研究结果一致。Slezak等[1]发现在海水长期培养(24~110 h)的过程中,当AAd浓度>10 μmol·L-1时,细菌的新陈代谢会受到抑制,这可能是间隙水中细菌对AAd(细菌的碳源)的摄取减少所致。虽AA与DMS均为DMSP的裂解产物,但春季AAd与DMS存在负相关性(r= -0.611,n=21,p=0.003),且间隙水中AAd浓度高于刘龙[35]报道的东海间隙水中的DMSPd浓度15.14~58.22(平均:27.63)nmol·L-1,说明DMSPd裂解只是产生AA的途径之一,AA还有其他的产生途径。Zhuang等[49]发现,固相沉积物中DMSPt含量比间隙水中的DMSPd高出至少3个数量级,表明沉积物颗粒中的DMSP可裂解为AAd,与高浓度的AAd一致。由表2和3可知,间隙水中的AAd含量远大于底层海水,这可能会导致沉积物间隙水中的AAd输出到海水中,成为海水中AAd的一个源。

表2 春季间隙水及底层海水AAd浓度对比Table 2 Comparisons of AAd concentrations between porewater and bottom seawater in spring

图9 黄东海间隙水中AAd与DOC的分布Fig.9 Distributions of AAd and DOC in porewater of the Yellow Sea and the East China Sea
DOC是表征水体中生物活动水平和有机物含量的重要参数,其含量与海底海流、生物活动及地质类型有关[50]。春夏季间隙水中DOC的浓度为3.59~7.67和3.79~11.82 mg·L-1,高值区均出现在长江口邻近海域。AAd可以看做DOC的一部分,虽AAd浓度与DOC并无显著相关性,时空分布也不一致,但高浓度AAd与DOC均出现在生产力高的海域。由于间隙水中的所测量参数较少,AAd的影响因素需进一步探讨。

表3 夏季间隙水及底层海水AAd浓度对比Table 3 Comparisons of AAd concentrations between porewater and bottom seawater in summer
3 结语
黄东海表层海水中AAd分布存在明显的季节性差异,夏季AAd在南黄海出现浓度高值,春季则在福建省宁德以东海域出现高值,与Chl-a分布不完全一致。研究海域AAd的来源与去除受浮游植物、水文过程、细菌活动、光化学作用等因素的综合作用。从DMS/AAd值(夏季(0.64±0.88),春季(0.78±0.81))来看,AAd与DMS含量并无悬殊差异,与二者复杂的来源及去除有关。春季表层海水及B断面AAd与DMSPd呈正相关性,这与AAd是DMSP的裂解产物有关,两季节长江口AAd的垂直分布受陆源输入的影响显著。AAd周日的浓度变化范围是4.72~29.42 nmol·L-1,总体与Chl-a变化一致;在18点出现最大值,与细菌丰度一致。沉积物间隙水中AAd的浓度比底层海水高出至少三个数量级,表明沉积物间隙水是底层海水中AAd的一个源。间隙水中AAd分布与DMSPd和DOC的分布并无显著相关性,春季AAd与DMS存在负相关性。目前对于AAd的研究较少,其分布特点、影响因素以及迁移转化过程需进一步探讨。
致谢:感谢“东方红2号”船长和船员在现场调查期间提供的帮助。本文所参考的Chl-a和细菌丰度数据分别由厦门大学的高亚辉老师和中国海洋大学的张晓华老师所提供,特致谢忱。
