前列腺特异性膜抗原在非小细胞肺癌细胞和肿瘤新生血管内皮细胞中的表达及其临床意义
2020-09-16刘传新王海龙吴秀琼刘斐烨
刘传新,王海龙,吴秀琼,刘斐烨
(1.南方医科大学中西医结合医院肿瘤中心,广东 广州 510315;2.天津市中医药研究院附属医院肿瘤科,天津 300120)
最新统计数据表明,肺癌在癌症相关死亡中仍占第一位[1],寻找新的诊断治疗靶点可能为研究新的治疗方案提供方向。前列腺特异性膜抗原(Prostate-specific membrane antigen,PSMA)是一种定位于11p11-p12的II型跨膜糖蛋白[2],正常情况下,在前列腺、肾脏、小肠、神经胶质细胞和唾液腺均有低水平表达[3]。PSMA在大部分前列腺癌细胞中呈过表达,且与肿瘤分期和病理分级有关[4]。近年来有研究显示,PET/CT在甲状腺癌、肾癌、胃肠间质细胞瘤、肝癌、胰腺神经内分泌肿瘤等实体瘤中也能检测到PSMA摄取[5]。有文献提及68GA-PSMA PET/CT能检测到肺癌及其转移部位中的PSMA摄取[6-7],但PSMA在肺癌组织中的表达及与临床特征的关联国内尚无报道。
新生血管是恶性肿瘤的一个重要标志,抗血管靶向治疗作为一种新的靶向治疗方法近年来越来越受关注。有研究显示,PSMA在胃癌、结直肠癌、肾癌、胶质细胞瘤等的肿瘤新生血管内皮细胞(Neovascular Endothelial Cells,NEC)中有表达[8-10],提示PSMA可能是一个有前景的抗肿瘤血管生成治疗靶点。PSMA在肺癌组织肿瘤细胞和NECs中的表达情况仍不明确。
本研究中,用免疫组织化学法检测了PSMA在非小细胞肺癌(Non Small Cell Lung Cancer, NSCLC)组织中的表达,并且分析其与年龄、性别、临床分期、病理类型、原发灶大小以及淋巴结转移等临床特征的关联,初步探讨PSMA在NSCLC中的表达及可能的作用。
1 资料与方法
1.1组织标本:本研究共纳入南方医科大学中西医结合医院病理科2013年1月~2018年1月间行外科手术切除的159例NSCLC组织及42例对照癌旁肺组织标本,均由病理确诊,其中包括鳞癌57例,腺癌55例,大细胞癌47例。本次研究经过本院医学伦理委员会同意。
1.2免疫组织化学法检测:PSMA鼠抗人抗体、CD31鼠抗人抗体购自Abcam公司或Proteintech公司,羊抗鼠HRP-IgG抗体、DAB显色试剂盒购自北京中山金桥生物技术有限公司。所有标本经甲醛固定后脱水、浸蜡、包埋后切成4μm厚的切片,随后进行烤片、脱蜡。梯度酒精水化后,加柠檬酸抗原修复液在120℃下抗原修复。随后在H2O2中孵育10 min,PBS冲洗3次,5 min/次。加入PSMA单克隆抗体或CD31单克隆抗体,4℃过夜后PBS冲洗3次,室温下加入羊抗鼠HRP-IgG抗体孵育40 min后,PBS冲洗3次,滴加新鲜配制的DAB显色试剂。显色3~5 min后,自来水冲洗终止显色,苏木素复染。酒精脱水干燥,二甲苯透明,中性树胶封固。
以CD31作为参照确认PSMA在NECs中的表达。PSMA阳性的前列腺癌组织标本作为阳性对照,PBS缓冲液代替一抗作为阴性对照。对于PSMA阳性的NSCLC组织标本,再以另一PSMA单克隆抗体进行复检,以验证实验结果的可靠性。
免疫组化的结果判定分为两种:阴性(免疫组化在细胞上没有任何染色),阳性(任何细胞上有确定的免疫组化染色,无论染色的强度如何)。
1.3统计学分析:实验数据采用SPSS17.0(SPSS 17.0, Chicago, IL, USA)统计学软件分析。PSMA与年龄、性别、分期、肿瘤大小、淋巴结状态和病理类型的关系采用χ2检验来分析。P<0.05被认为差异有统计学意义。
2 结果
159例NSCLC组织中,111例肿瘤组织的NECs表达PSMA,阳性率为69.81%,87例肿瘤组织的肿瘤细胞表达PSMA,阳性率为54.72%,71例呈NECs和肿瘤细胞双阳性表达(44.65%),40例仅在NECs呈表达阳性(25.16%),16例仅在肿瘤细胞中呈表达阳性(10.06%)。所有癌旁肺组织的实质细胞及血管内皮细胞中均未见PSMA表达。
肿瘤组织NECs的PSMA表达与临床分期呈显著相关。98例Ⅰ期和Ⅱ期患者中76例NECs表达PSMA(77.60%),61例Ⅲ期和Ⅳ期患者中35例表达PSMA(57.40%)。Ⅰ期和Ⅱ期患者的阳性率要明显高于Ⅲ期和Ⅳ期的患者(P=0.007)。肿瘤细胞的PSMA表达与临床分期未见明显相关(表1,P=0.268)。
此外,如表1所示,NSCLC肿瘤细胞的PSMA表达与年龄显著相关。年龄≥60岁的患者细胞表达PSMA的比例明显多于年龄≥60岁的患者(66.20% vs 45.50% ,P=0.009)。而NECs的PSMA表达则与年龄无显著关联(P=0.113)。无论是肿瘤细胞或NECs,PSMA阳性率与患者性别、肿瘤大小、淋巴结状态及病理类型均无明显关联。见表1。
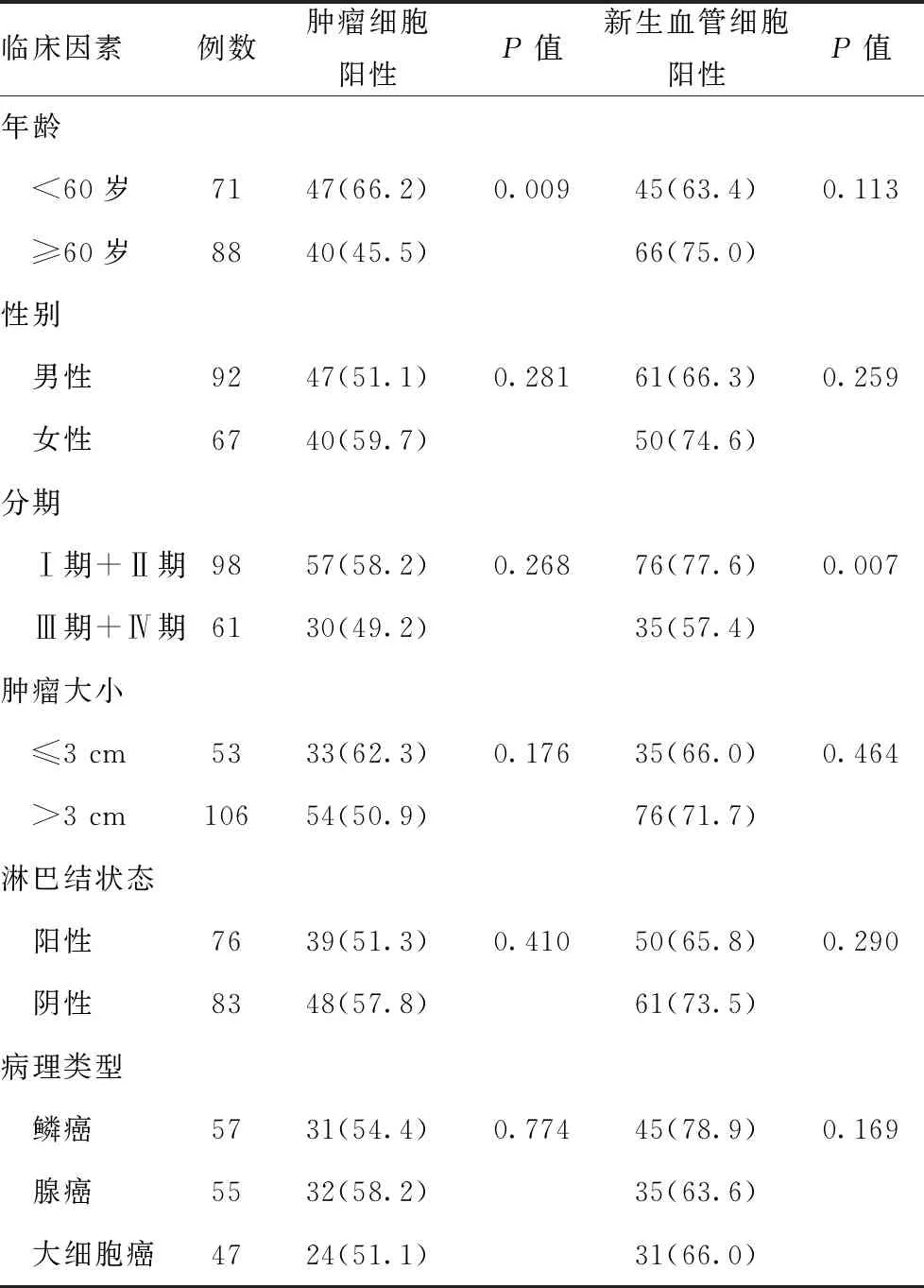
表1 PSMA 在非小细胞肺癌组织中的表达[例(%)]
3 讨论
PSMA首次发现于1987年,在LNCaP前列腺癌细胞株中获取[2]。最初的研究发现,PSMA在正常前列腺组织中呈低表达,在前列腺癌中呈高表达,并随着正常前列腺细胞向高级别前列腺上皮内瘤变、前列腺癌进展的过程表达升高[11],与Gleason评分、PSA水平有显著关联[12],因此曾被认为是前列腺特异性表达的抗原。而进一步的实验提示,PSMA mRNA和蛋白在多种肿瘤中均有表达,包括胰腺癌、乳腺癌、肾癌等,证明PSMA并不是只在前列腺癌中特异性表达[13]。Chang等的研究发现,PSMA mRNA和蛋白在多种其他实体瘤的NECs上也有表达[14]。但PSMA并非在所有肿瘤的NECs上都表达,其在子宫内膜癌肿瘤细胞的表达要高于NECs[15]。笔者的研究首次发现,PSMA蛋白在肿瘤组织中表达阳性率比癌旁肺组织高,提示PSMA在NSCLC中也可能是一个辅助诊断标志,支持Lars Henning Schmidt等人之前的研究[16]结论。但是,笔者收集的标本中PSMA在NSCLC肿瘤细胞的表达率(53.46%)要高于前述研究中的6%,可能与实验抗体不同、选择人群不同有关,具体的机制原因值得进一步研究。
PSMA的表达模式较为特殊,VEGF、endoglin和整合素等常见的血管靶点在正常组织和肿瘤组织的新生血管上均有表达,而PSMA则特异性表达于NECs,在正常组织的血管内皮细胞鲜有表达。这种在NECs表达的特异性可能与肿瘤新生血管的高度异型性相关。血管生成源自于内皮细胞的激活[17],NECs上具有可以选择性激活PSMA转录的转录增强区域,但是在正常血管上不具有这种区域[18]。因此,PSMA更容易在NECs中被激活和特异性表达[19]。本研究再次证明,PSMA在NSCLC组织的NECs上特异性地表达,且在肿瘤细胞本身也有表达,提示PSMA有可能作为肺癌抗肿瘤新生血管治疗的一个全新靶点,且可以同时针对肿瘤细胞和NECs发挥作用。
早期研究已经发现,PSMA表达与肿瘤分期和病理分级有关。PSMA mRNA在I期子宫内膜癌中较其他分期升高,其表达降低低提示无疾病进展期更短[15]。膀胱癌中PSMA mRNA与病理分级呈正相关,而PSMA mRNA表达降低也提示更高的2年生存率[20]。本文研究进一步显示,肿瘤NECs中的PSMA表达是与NSCLC肿瘤分期有关的因素,早期患者NECs的PSMA阳性率要明显高于晚期患者,这一结论与软组织肿瘤及前述NSCLC研究中数据类似[16, 21]。引起这一现象的原因可能是由于肿瘤早期快速增殖造成肿瘤内部的缺氧[16]或肿瘤早期阶段比晚期阶段具有更多的新生血管。
此外,NSCLC肿瘤细胞本身的PSMA表达阳性率与年龄相关,<60岁的患者阳性率要明显高于≥60岁的患者,可能由于年龄越小细胞代谢越旺盛,提示PSMA在NSCLC肿瘤细胞自身生长过程可能也发挥一定作用。无论是肿瘤细胞还是NECs的PSMA表达与患者性别、NSCLC的原发灶大小、淋巴结转移状态及病理分级均无明显的相关性,其原因有待于今后进一步研究。
综上所述,本研究对PSMA在NSCLC组织中的表达和分布进行了检测和初步分析,发现PSMA在NSCLC的肿瘤细胞和NECs中均有表达,在对照的癌旁组织实质细胞和血管内皮细胞中均不表达,且NECs中的PSMA表达水平与患者临床分期显著相关,提示PSMA可能是NSCLC的一个诊断标志和血管生成有关的治疗靶点,其具体的作用和机制值得进一步探索和分析。
