曲妥珠单抗联合新辅助化疗治疗Her-2阳性乳腺癌的临床效果分析
2020-09-16张雪娣牛红卫张秀娟
张雪娣 ,牛红卫 ,张秀娟
(1.鹤壁市人民医院药学部, 河南 鹤壁 458030;2.鹤壁市人民医院肿瘤内科)
乳腺癌为一种临床常见的妇科恶性肿瘤,其发病率逐年升高,而人类表皮生长因子受体2(Human epidermal growth factor receptor-2,Her-2)阳性为较高恶性程度乳腺癌的标志之一,严重影响患者的预后[1]。TAC方案化疗为新辅助化疗的一种,其可有效杀灭肿瘤细胞,被广泛运用于临床术前化疗或较晚期乳腺癌的治疗中,但其也会伤害机体正常细胞,致患者免疫功能低下[2]。而曲妥珠单抗可以Her-2为靶点,具体作用于肿瘤细胞的部分位点[2],故其在新辅助化疗的基础上可能会减少对机体正常细胞的损伤进而更有效的改善患者的免疫功能等。本文观察了曲妥珠单抗联合新辅助化疗治疗Her-2阳性乳腺癌的效果。报告如下。
1 对象与方法
1.1对象 本研究已经过医院伦理委员的同意,且所有患者及其家属均签署知情同意书。选取2018年2月至2019年2月于我院治疗的Her-2阳性乳腺癌患者104例,按简单随机化法分为对照组和观察组,每组52例。其中对照组平均年龄(49.84±6.25)岁;肿瘤分期:Ⅱ期8例,ⅢA期25例,ⅢB期19例;癌症类型:浸润性小叶癌13例,浸润性导管癌28例,混合型11例;文化程度:中学以下36例,中学及以上16例。观察组平均年龄(51.05±5.21)岁;肿瘤分期:Ⅱ期10例,ⅢA期26例,ⅢB期16例;癌症类型:浸润性小叶癌14例,浸润性导管癌29例,混合型9例;文化程度:中学以下32例,中学及以上20例。两组以上一般资料比较差异无统计学意义(P>0.05),有可比性。
1.2纳入和排除标准 纳入标准:经病理检查提示为乳腺癌;经免疫化学染色法检查示Her-2阳性;临床分期为Ⅱ期至Ⅲ期者;神志清楚,可正常沟通者。排除标准:严重心、肾等其他重要脏器功能损坏者;哺乳期或妊娠期妇女;对研究使用药物过敏者;严重精神障碍者。
1.34治疗方法 (1)对照组:行TAC方案化疗。具体:多西他赛注射液75 mg/m2静滴,每三周一次;注射用多柔比星50 mg/m2静滴,每三周一次;注射用环磷酰胺500 mg/m2,每三周一次。(2)观察组:在对照组的基础上行曲妥珠单抗(美国基因科技公司,国药准字S20060026,440 mg/支)静滴。具体:首次剂量4 mg/kg,后持续剂量2 mg/kg,每周一次。21 d为一个周期,两组均连续治疗六个周期。
1.4观察指标与评价标准 观察比较两组治疗后临床效果、免疫功能、肿瘤标志物及不良反应的情况。(1)临床效果划分标准[3]:完全缓解:患者病变完全消失且持续稳定超过1个月;部分缓解:肿瘤最大直径缩小大于等于50 %且持续超过1个月;稳定:肿瘤最大直径缩小小于50 %,增大小于25 %;进展:肿瘤最大直径增大大于等于25 %,或有新的病灶出现。(2)采用流式细胞术对两组的免疫功能进行比较,包括CD3+、CD4+、CD8+。③采用化学发光法对两组的肿瘤标志物进行比较,包括CEA、CA153及TPS。

2 结果
2.1两组临床效果的比较 观察组临床效果优于对照组,两组比较有统计学意义(P<0.05)。见表1。

表1 两组临床效果的比较[n( %)]
2.2两组免疫功能的比较 治疗后观察组CD3+、CD4+及CD4+/CD8+水平高于对照组,CD8+水平低于对照组,两组比较有统计学意义(P<0.05)。见表2。

表2 两组免疫功能的比较
2.3两组肿瘤标志物的比较 治疗后观察组CEA、CA153及TPS水平均低于对照组,两组比较有统计学意义(P<0.05)。见表3。
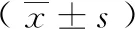
表3 两组肿瘤标志物的比较
2.4两组不良反应的比较 两组不良反应比较无统计学意义(P>0.05)。见表4。

表4 两组不良反应发生率的比较[n( %)]
3 讨论
Her-2阳性乳腺癌患者可有恶性程度较高、预后不良等特征,且乳腺癌患者中约20 %~30 %表现为Her-2阳性[2],严重影响患者的生命健康。新辅助化疗可有效降低肿瘤细胞的侵袭能力,缩小肿瘤直径,并可及早杀死转移细胞,但其也会对正常细胞产生一些伤害,故对患者的免疫功能产生一定影响。而曲妥珠单抗为Her-2的单克隆抗体,其通过将自己特异性地附着到Her-2上的方式,达到阻断肿瘤细胞的生长的目的,故其可能对改善患者免疫功能水平的效果更好。因此,本院在TAC方案化疗的基础上加用曲妥珠单抗治疗,并研究其联合治疗的效果和对肿瘤标志物、免疫功能等的影响。
曲妥珠单抗为一种重组人源化的单克隆抗体,可特异性地作用于Her-2的细胞外部位,从而改善Her-2阳性乳腺癌患者的预后。其主要机制为阻断由Her-2介导的传导通路,使Her-2受体蛋白发生裂解,从而有效降低机体细胞膜Her-2的蛋白浓度,抑制血管的生成,杀灭肿瘤细胞,进而达到抑制肿瘤细胞增殖,促进患者预后的目的[4]。
本研究示,观察组临床疗效优于对照组(P<0.05),说明与单独TAC化疗相比,曲妥珠单抗联合治疗的效果更高。分析原因为TAC中多西他赛、多柔比星及环磷酰胺分别通过对肿瘤细胞的有丝分裂和肿瘤细胞内RNA、DNA合成及功能的抑制作用,有效抑制肿瘤细胞的生长,曲妥珠单抗在此基础上可有效抑制Her-2过度表达的肿瘤细胞的增生,进一步加强了抗肿瘤的效果[5]。
乳腺癌的发生发展与机体免疫功能密切关联,尤其是机体的细胞免疫,当机体受肿瘤细胞侵袭时可抑制其免疫功能,使CD8+水平上升,而CD3+、CD4+及CD4+/CD8+水平下降。本研究示,治疗后观察组CD3+、CD4+及CD4+/CD8+水平高于对照组,CD8+水平低于对照组(P<0.05),说明与单独TAC化疗相比,曲妥珠单抗联合治疗可有效改善患者的免疫功能。分析原因为TAC化疗时不仅可杀死癌细胞,还一定程度上损伤了机体的正常细胞,在治疗的同时也一定程度上影响了患者的免疫功能,而曲妥珠单抗治疗时以Her-2为靶点,可特异性地作用于癌细胞的一些位点,减少对机体正常细胞的伤害,从而有效改善患者的免疫功能[6]。
肿瘤标志物为诊断肿瘤、判断肿瘤恶性程度和评估肿瘤预后的重要标志物,CEA为癌胚抗原,是一种肿瘤的广谱标志物;CA153为糖类抗原153,可在乳腺癌中呈现高表达;TPS为组织多肽特异性抗原,可在癌细胞活跃期呈现高表达。本研究示,治疗后观察组CEA、CA153及TPS水平均低于对照组(P<0.05),说明与单独TAC化疗相比,曲妥珠单抗联合治疗能有效降低肿瘤标志物的水平。分析原因为TAC化疗可有效抑制肿瘤细胞的增殖,降低其活性,从而降低肿瘤标志物的水平,曲妥珠单抗在其基础上可有效发挥裂解Her-2受体蛋白,降低机体细胞膜Her-2蛋白浓度的作用,从而进一步降低机体肿瘤标志物的水平[7]。此外,两组不良反应比较无统计学意义(P>0.05),说明曲妥珠联合治疗不增加不良反应的发生,其可能原因是因为联合用药时,曲妥珠单抗对TAC化疗方案中药物药代动力学影响不大,故不增加不良反应的发生[8]。
综上所述,曲妥珠单抗联合新辅助化疗治疗Her-2阳性乳腺癌患者的效果好,且能有效改善患者的免疫功能,降低肿瘤标志物的水平,且不增加不良反应的发生,值得临床推广。
