碳酸锂在氯化钠溶液中溶解度的测定
2020-09-15戈海文王怀有
戈海文, 王怀有, 王 敏
(1. 中国科学院青海盐湖研究所, 中国科学院盐湖资源综合高效利用重点实验室, 青海 西宁 810008; 2. 青海省盐湖资源化学重点实验室, 青海 西宁 810008)
1 前 言
锂及其化合物在锂离子电池[1-2]、航空航天[3]、核电站[4-5]、石油化工[6]、玻璃陶瓷[7]等众多领域得到成功应用,被誉为“推动世界进步的能源金属”,是国民经济和国防建设中具有重要意义的战略资源。全球蕴含较为丰富的锂资源,主要分布于澳洲、北美洲、南美洲、亚洲以及非洲,主要分为花岗伟晶岩型和盐湖型2 种。中国是锂资源的第2 大国,锂资源主要集中于西北地区(西藏、青海和新疆),盐湖锂资源占总储量80%左右,主要分布在青藏高原[9]。固体锂矿因成分和杂质的不同,提锂工艺不同,主要包括:硫酸法、石灰石烧结法、硫酸盐法和纯碱压煮法[9]。以盐湖卤水为原料提锂的方法众多,主要有5种:沉淀法、锻烧浸取法、选择性半透膜法、吸附法和溶剂萃取法。以锂矿石和盐湖卤水为原料提锂均需得到富含锂离子的溶液,要进一步加入纯碱碳化沉淀出初级碳酸锂产品。因此,碳化沉锂是锂产业链中承前启后的一个关键步骤,但是针对碳化沉锂体系缺乏系统研究。孙玉柱等[10-13]研究了碳酸锂反应结晶动力学以及在纯水中的溶解过程。宋昌斌等[14]研究了Li2CO3在水中的溶解度和超溶解度,并对溶解过程进行热力学分析。王怀有等[15]研究了Li2CO3在混合LiCl-NaCl-KCl-Na2SO4溶液中的溶解度和超溶解度,并讨论了不同盐对Li2CO3介稳区的影响。碳化沉锂体系将形成碳酸锂和氯化钠溶液体系,因此,针对碳酸锂在NaCl-H2O 体系中溶解度的研究对锂收率极其重要,尚未发现对碳酸锂在不同浓度的氯化钠溶液中溶解度的系统研究。
本文研究了在温度278.15~358.15 K 内Li2CO3在不同浓度的NaCl 溶液中的溶解度,并利用Debye-Hückel 延展式和Apelblat 方程关联实验数据;采用热力学模型对溶解度数据进行计算得到热力学参数,以期从实验和理论上系统考察Li2CO3在NaCl 溶液中的溶解行为,为碳化沉锂工艺提供基础数据。
2 实验材料和方法
2.1 实验试剂和仪器
2.1.1 主要仪器
HXC-500-8A 型磁力搅拌恒温槽(控温精度±0.05 K,北京惠城佳仪);恒温水浴槽(控温精度±0.03 K VIVO RT4,德国优莱博公司);自动电子分析天平(BT224S,赛多利斯科学仪器有限公司);超纯水机(UPT,四川优普仪器设备有限公司)。
2.1.2 主要药品试剂
Li2CO3(麦克林)和NaCl(国药集团化学试剂公司)均为分析纯,Li2CO3140 ℃烘干,NaCl 重结晶备用。实验过程中所用水均为二次去离子水(DDW),去离子水电导率小于1×104S·m-1,pH=6.60。
2.2 实验方法
实验采用等温溶解平衡法。配制了不同质量摩尔浓度的NaCl 溶液,加入过量的Li2CO3(5 g),将所配溶液置入硬质塑料瓶中,再置于磁力搅拌恒温槽中,不断搅拌以达到平衡。5 d 后连续2 d 取瓶内上层清液,对其进行化学分析,若液相组成无变化,则视为溶解反应达到平衡状态。
3 实验结果与讨论
3.1 溶解度数据
实验测定温度在278.15~358.15 K 时,Li2CO3在质量摩尔浓度0~4 mol·kg-1NaCl 溶液中的溶解度以及液相密度数据,列于表1 中。表中m(NaCl)为质量摩尔浓度, m(Li2CO3)为溶解度,ρ 为液相密度。
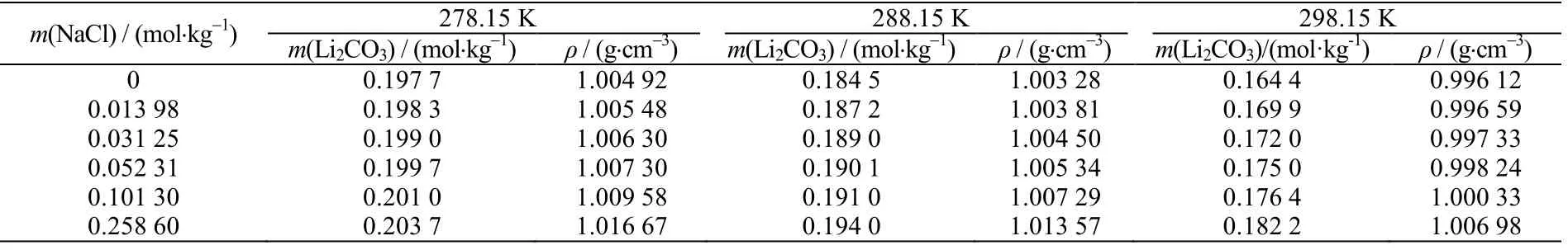
表1 278.15-358.15 K 内Li2CO3 在NaCl 溶液中溶解度以及密度 Table 1 Solubility and density of lithium carbonate in sodium chloride solution at 278.15-358.15 K
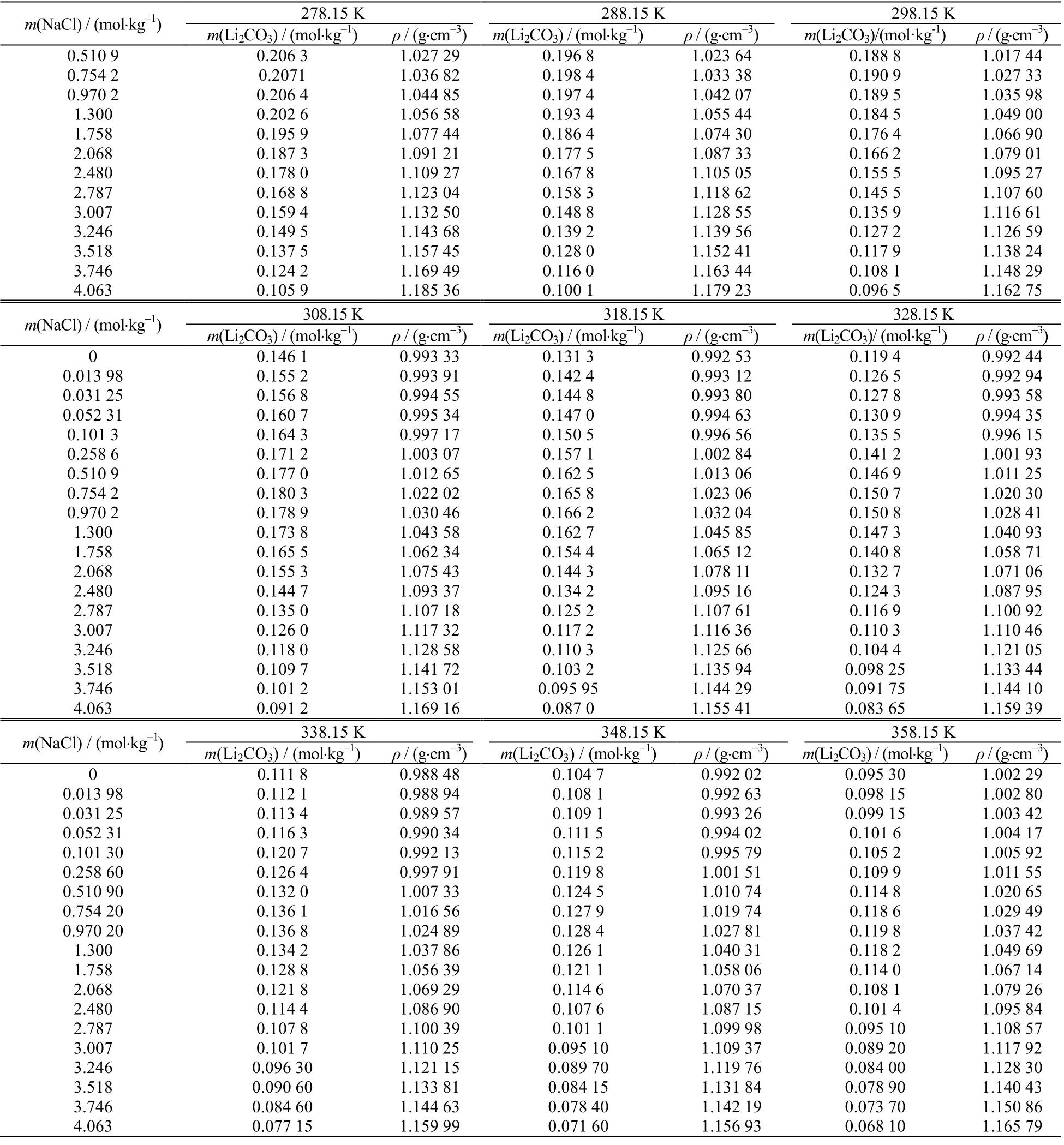
be continued
为了解Li2CO3在不同浓度NaCl 溶液中的溶解度,绘制Li2CO3溶解度与NaCl 浓度的关系图,如图1 所示为不同温度下碳酸锂在氯化钠溶液中的溶解度,从图1 中可以看出,Li2CO3溶解度随NaCl 浓度增大先增大后减小,Li2CO3在 NaCl 溶液中的溶解度在m(NaCl)=1 mol·kg-1时出现最大值,在m(NaCl)< 1 mol·kg-1时,NaCl 对Li2CO3盐效应主要表现为盐溶作用,特别是在极稀溶液中(小于0.1 mol·kg-1);而当m(NaCl)>1 mol·kg-1时,Li2CO3溶解度随着NaCl 的浓度增加缓慢降低,NaCl 对Li2CO3溶解表现为盐析作用,这说明在实际沉锂反应中产生的NaCl 能够影响Li2CO3收率。在同浓度NaCl 溶液中,Li2CO3溶解度随温度升高明显降低,这与Li2CO3在纯水溶解度一致。

图1 不同温度下碳酸锂在氯化钠溶液中的溶解度 Fig.1 Solubility of lithium carbonate in sodium chloride solution at different temperatures
3.2 溶解度数据的关联
3.2.1 E-DH 模型
在同一温度下,Li2CO3在NaCl 溶液中溶解受到盐效应的影响,溶解度可以用溶度积常数表示,而盐效应作用的本质是溶液离子强度会对Li2CO3中Li+和 CO32-的活度系数产生影响。根据溶度积规则,当Li2CO3溶解平衡时,用溶度积常数表示即


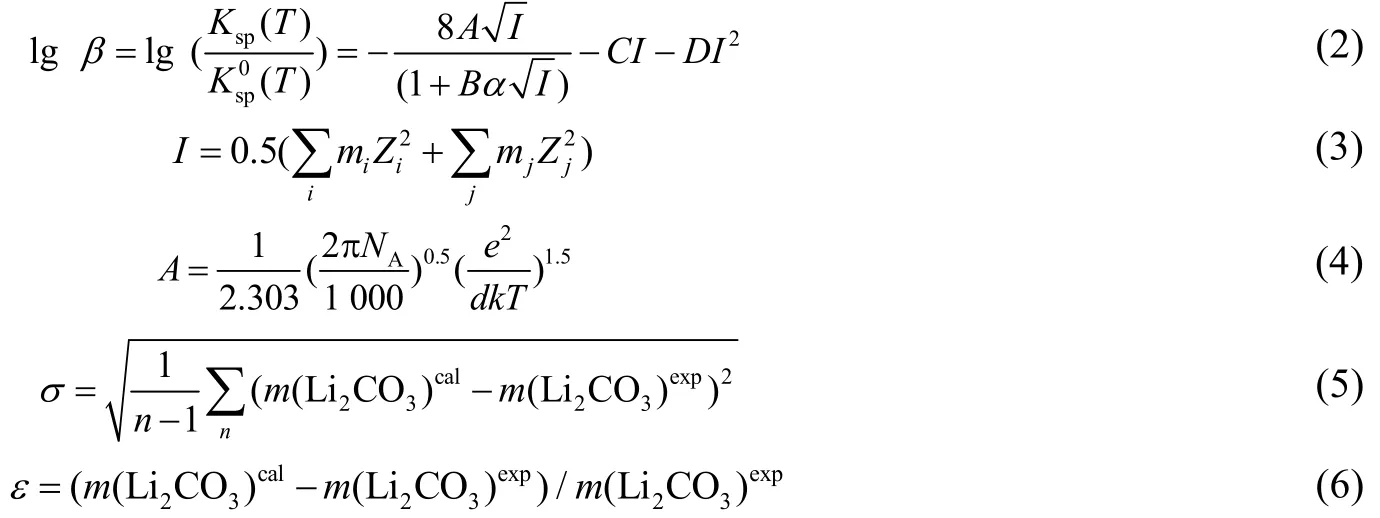
式中:β 为不同温度溶度积系数;Ksp0(T)为Li2CO3在纯水中的浓度积,(mol·kg-1)3;I 为溶解平衡时溶液的离子强度,mol·kg-1;A 为Debye-Hückel 极限斜率,将A 在不同温度下列于表2 中计算;NA为阿伏伽德罗常数;e 为电子电荷量,C;d 为介质的相对介电常数;k 为Boltzmann 常数;Bα 作为理论项(长程力作用项)模型参数;C、D 为短程力修正项模型参数;m(Li2CO3)cal为Li2CO3质量摩尔浓度计算值,mol·kg-1;m(Li2CO3)exp为Li2CO3质量摩尔浓度实验值,mol·kg-1。
根据溶解度模型方程(式(2)),分别针对不同温度溶度积系数β 值进行多元拟合计算,获得Li2CO3在NaCl 溶液中的不同温度下的参数,将计算得到的参数列于表2 中。采用标准偏差σ(式(5))衡量溶解度模型参数拟合的准确度,计算标准偏差也列于表2 中。
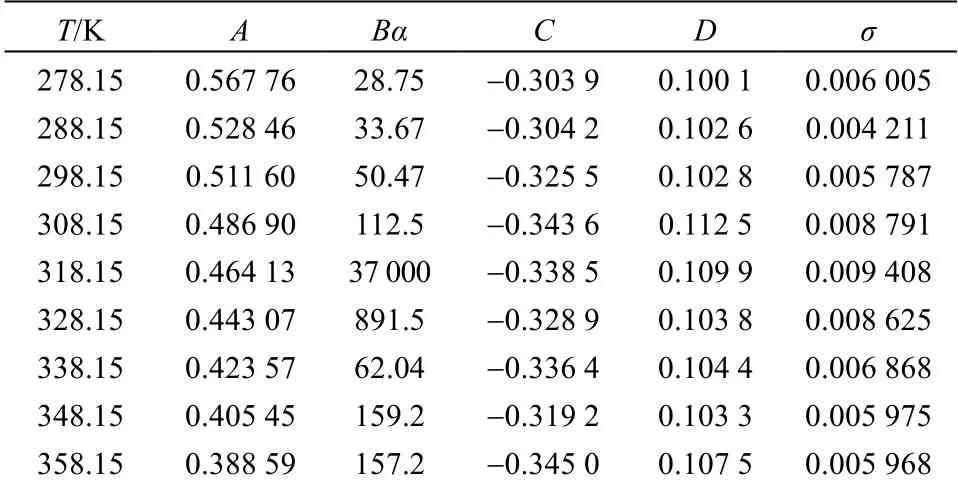
表2 不同温度下的Debye-Hückel延展模型参数和标准偏差 Table 2 Model parameters and standard deviation values of extended Debye-Hückel model at different temperatures
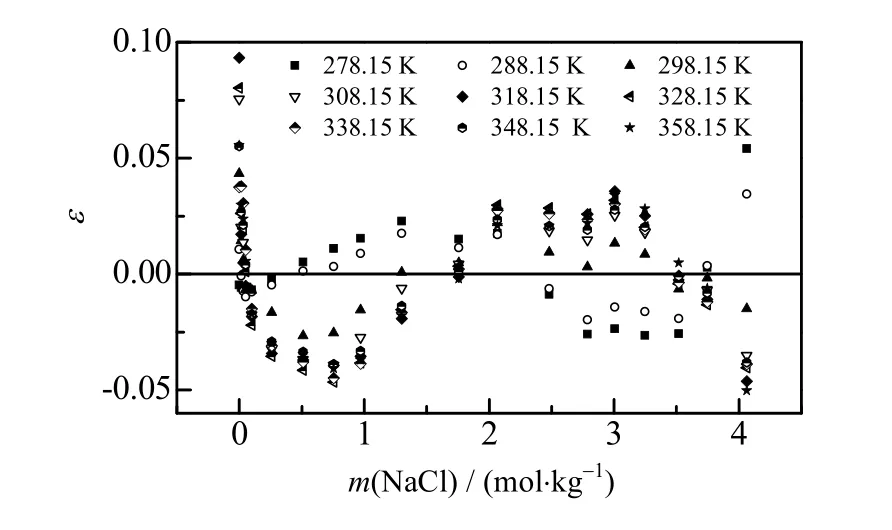
图2 E-DH模型计算值与实验值的相对偏差 Fig.2 Relative deviation between calculated data from E-DH equation and experimental results
采用相对偏差ε(式(6))考察溶解度E-DH 模型计算的准确度,将不同浓度的NaCl 溶液中Li2CO3溶解度计算的相对偏差绘制于图2,绝大部分Li2CO3溶解度实验值与计算值的相对偏差在 ±0.05 之内,表明E-DH 模型可准确地表达Li2CO3再不同浓度NaCl 溶液中溶解行为。
3.2.2 Apelblat 方程
Li2CO3在水中的溶解度用摩尔分数 x 表示,如式(7)

式中:mi分别为Li2CO3、NaCl 和H2O 的质量,g;Mi分别为Li2CO3、NaCl 和H2O 的摩尔质量,g·mol-1。
Apelblat 方程[18]假定溶液的焓变为温度的线性函数,并依据Clausius-Clapeyron 方程导出表述固液平衡状态的简化方程(式8):

根据Apelblat 方程,分别针对不同NaCl浓度Li2CO3饱和摩尔分数进行多元拟合,并将得到的参数和计算标准偏差σ 列于表3 中。采用相对偏差ε(式(6))考察Apelblat 方程溶解度模型计算的准确度,将不同浓度的NaCl 溶液中Li2CO3溶解度计算相对偏差绘制于如图3所示,由图3 可知,所有Li2CO3溶解度实验值与计算值的相对偏差在±0.05,表明Apelblat方程可准确地表达Li2CO3在不同浓度NaCl 溶液中溶解行为。
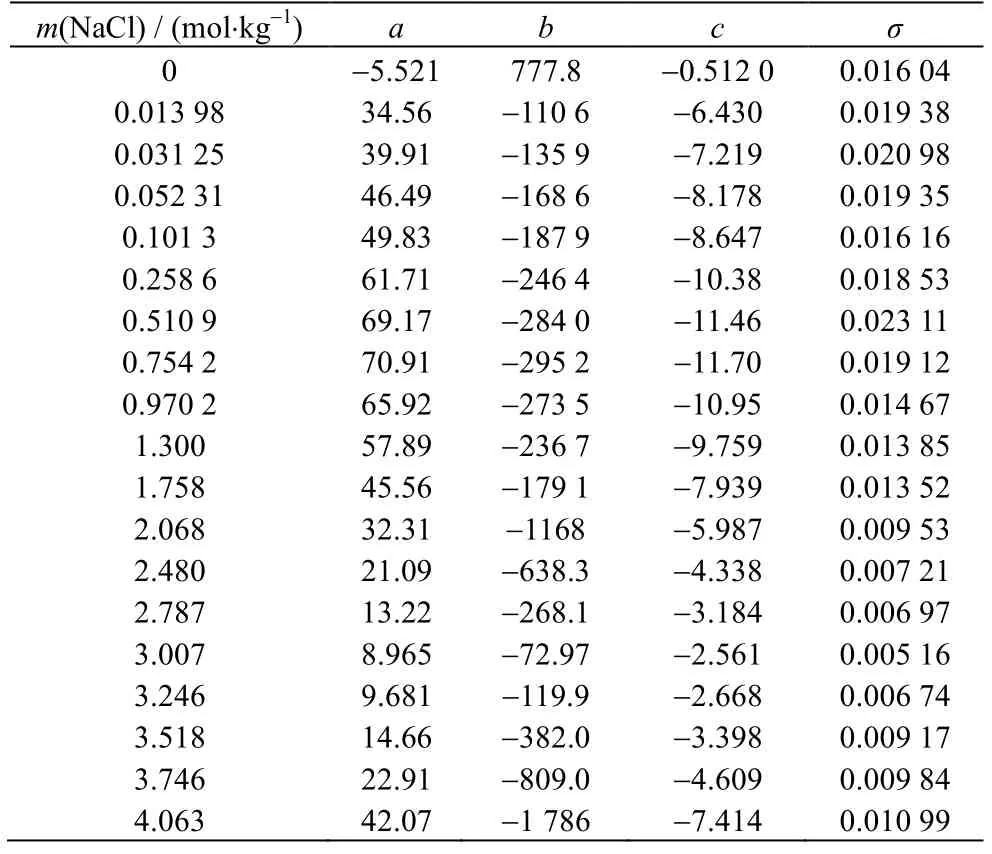
表3 不同NaCl 浓度下的Apelblat 方程参数 Table 3 Apelblat equation parameters under different NaCl concentrations
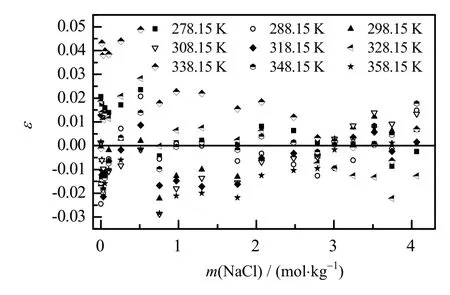
图3 Apelblat方程计算值与实验值的相对偏差 Fig.3 Relative deviation between calculated data from Apelblat equation and experimental results
3.3 溶解热力学
Van’t Hoff方程是活度系数方程的简化形式,在溶液中溶质摩尔分数的对数值和绝对温度的倒数呈现线性相关的关系[19],方程如式(9)。
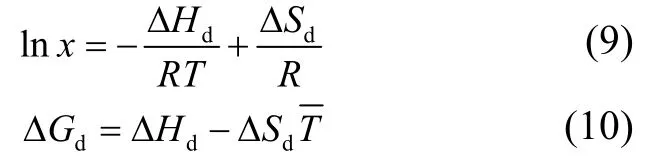
式中:R为通用气体状态常数,8.314 J·mol-1·K-1;ΔHd为溶解焓,J·mol-1;ΔSd为溶解熵,J·mol-1·K-1;ΔGd为溶解吉布斯自由能变,J·mol-1;T¯为体系的平均温度,K。
根据热力学原理,在实验温度范围内,认为溶液的ΔSd和ΔHd是不随温度变化的常数,根据式(9)和(10)计算出在不同NaCl 溶液中Li2CO3溶解反应ΔSd和ΔHd,根据实验平均温度计算溶解过程中的吉布斯自由能的变化值ΔGd。
如图4(a)所示为在不同浓度的NaCl 溶液中,Li2CO3溶解过程的摩尔焓变,从图4(a)中可以得出,ΔHd<0,说明溶解过程为放热过程,升高温度可以显著降低Li2CO3的溶解度。在浓度小于1 mol·kg-1NaCl溶液中几乎不存在离子缔合情况,Na+和Cl-均以自由水合离子形式存在,当浓度大于1 mol·kg-1NaCl 溶液中开始出现溶剂分割离子对(SIP)和接触离子对(CIP),随着浓度增加,溶剂分割离子对比例降低接触离子对增加,而当NaCl 浓度大于3 mol·kg-1时溶液中几乎只存在接触离子对[20]。Li2CO3在不同浓度的NaCl 溶液中溶解过程,当NaCl 浓度小于1 mol·kg-1和大于3 mol·kg-1时Li2CO3溶解焓随着NaCl 浓度增加而增加,Li+和CO32-离子水化需要与Na+和Cl-水合离子争夺水分子。在低浓度的NaCl 溶液中,由于存在大量的自由水,Li+离子和CO32-离子的水化只需要破坏溶液中水分子之间的氢键,形成离子水合结构。随着NaCl 溶液浓度增加,溶液中存在Na+和Cl-离子水合结构以及CIP,在形成新的Li+和CO32-离子水合结构过程中需要破坏离子水合结构或Na+-Cl-接触离子对水合结构,因此NaCl浓度的增加将降低Li2CO3溶解的放热量。当1 mol·kg-1< m(NaCl) <3 mol·kg-1时,Li+和CO32-离子水化过程,溶液中存在SIP 和CIP 动态平衡,表现为Li2CO3溶解焓不随NaCl 溶液浓度变化。
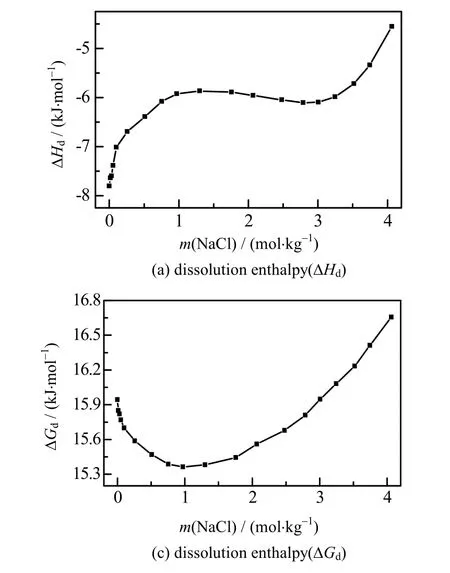
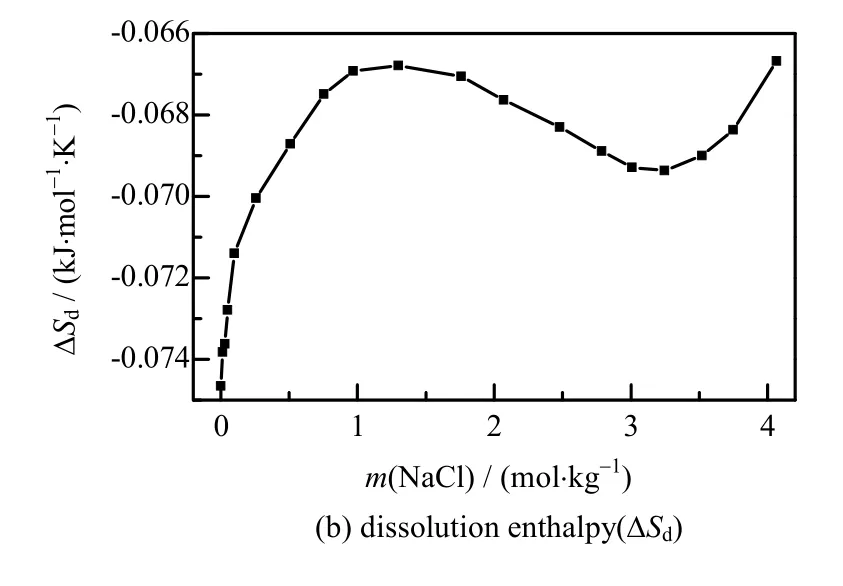
图4 Li2CO3 溶解热力学参数与NaCl 质量摩尔浓度关系图 Fig.4 Profiles of thermodynamic parameters of Li2CO3 as a function of NaCl concentrations
图4(b)为Li2CO3溶解过程的摩尔熵变随着NaCl 溶液浓度变化。离子晶体升华熵变(ΔsubSθm)是正值。但是气态正、负离子形成水合离子的过程中,由于水化作用,极性水分子在正、负离子的周围有规则地取向,其有序程度增加,混乱程度减小,即水化熵变(ΔhSθm)为负值,溶解过程熵变取决于两项之和ΔsSmθ=ΔsubSθm+ΔhSθm。由图4(b)可知,ΔSd<0,由于Li+具有强烈的水合作用,在Li2CO3溶解过程离子水化作用占据主要的作用。Li2CO3溶解熵变随着NaCl 浓度增加整体升高,在高浓度区NaCl 溶液水分子水合离子和离子对;在1 mol·kg-1<m(NaCl)l<3 mol·kg-1时Li2CO3溶解熵出现降低,Li2CO3溶解使得溶液中SIP 向规则度更高的CIP 转化。
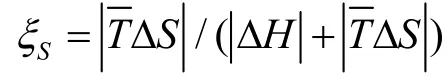
3.4 溶解过程密度研究
溶解平衡体系密度测定结果见表1。采用适用于多种盐卤溶液经验密度方程Connaughton[21]方程对密度数据进行拟合关联:
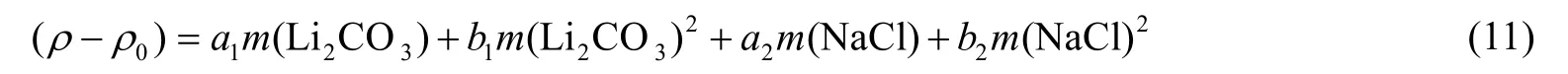
式中:a1、b1、a2和b2为经验系数,ρ0为同温度下溶剂水的密度[22]。将Connaughton 方程不同温度下Li2CO3-NaCl-H2O 体系拟合参数列于表4。根据式(5)计算拟合的标准偏差偏差σ 列于表3,计算标准偏差σ< 7×10-4,因此Connaughton 方程在实验浓度范围内能够准确表达Li2CO3在NaCl 溶液中溶解体系密度。
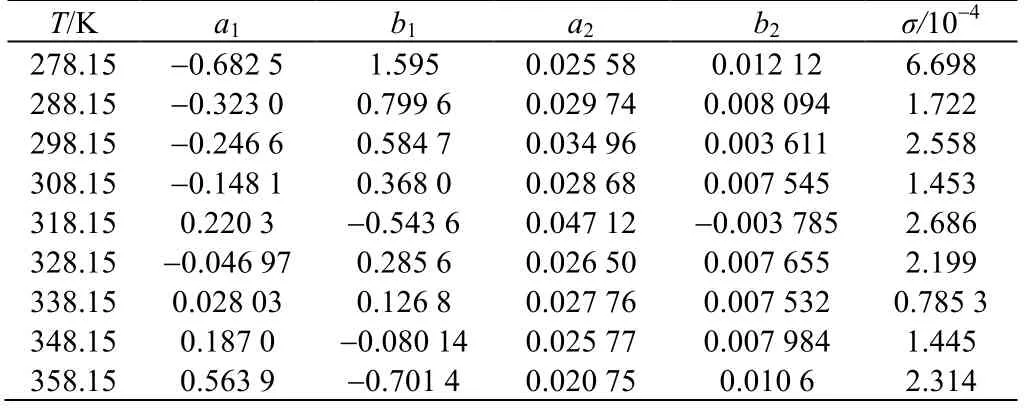
表4 不同温度下的Connaughton 方程参数和标准偏差 Table 4 Model parameters and standard deviation values of Connaughton equation at different temperatures
4 结 论
采用等温溶解平衡法开展Li2CO3在NaCl 溶液中(278.15~358.15 K)的溶解平衡实验研究,测定平衡体系中Li2CO3溶解度和溶液密度,得到以下结论:
(1) Li2CO3溶解度随NaCl 浓度增大先增大后减小,Li2CO3在NaCl 溶液中的溶解度在m(NaCl)=1 mol·kg-1出现最大值,在m(NaCl)< 1 mol·kg-1时,NaCl 对Li2CO3盐效应主要表现为盐溶作用;而当m(NaCl)> 1 mol·kg-1时,Li2CO3溶解度随着NaCl 的浓度增加缓慢降低,NaCl 对Li2CO3溶解表现为盐析效应;
利用E-DH 方程和Apelblat 方程分别对Li2CO3溶解度实验数据进行关联,计算Li2CO3溶解度相对偏差均在±0.05,表明E-DH 和Apelblat 溶解度模型方程均可较好地表述Li2CO3在NaCl 溶液中的溶解度性质。
(2) 通过溶解热力学计算,得到Li2CO3在NaCl 中的溶解焓ΔHd、熵ΔSd和吉布斯自由能变ΔGd,结果表明溶解过程为放热、熵减的非自发过程,溶解焓ΔHd、熵ΔSd随着NaCl 浓度增大而增大,吉布斯自由能变ΔGd在NaCl 浓度1 mol·kg−1出现最小值,且溶解过程为熵控制过程。
(3) 利用Connaughton 方程对液相密度数据进行关联,标准偏差小于7×10-4,Connaughton 方程能够准确表达NaCl 溶液中Li2CO3饱和溶液密度。
