北葶苈子炮制前后对H2 O2 诱导的H9c2 心肌细胞损伤保护作用
2020-09-15王慧慧杨方方冯卫生郑晓珂
王慧慧 张 莉 杨方方 冯卫生 郑晓珂
(河南中医药大学, 河南郑州450046)
北葶苈子,又称苦葶苈子,十字花科独行菜属植物独行菜Lepidium apetalumWilld.的干燥成熟种子,主产于河北、辽宁、内蒙古等地区[1]。北葶苈子始载于《神农本草经》,作为一味传统中药,其在中医临床中常用于泻肺平喘、利水消肿。现代研究已证明北葶苈子具有强心、调血脂、利尿、止咳等功效[2]。已有文献报道,葶苈子可显著增强犬的心肌收缩力,增强正性肌力作用,增加心脏输出量,减轻心脏负荷,可作为临床治疗心衰的有效药物[3⁃6]。本实验室前期研究[7]也证实了葶苈子能够有效改善阿霉素诱导的慢性心衰大鼠的心脏功能。由于在临床心血管疾病治疗中,葶苈子生品与炮制品均有大量使用,本课题组在后续研究中,将北葶苈子生品与炮制品的化学成分进行对比,发现北葶苈子清炒炮制后多种化学成分发生了改变,脂肪油含有量降低[8]。经过进一步研究,发现北葶苈子经过炮制后,对心肌细胞保护作用增强。本研究探讨北葶苈子炮制品与生品水提取物对H2O2诱导H9c2 心肌细胞损伤的影响。
1 材料
1.1 细胞株 H9c2 大鼠心肌细胞购自中科院上海细胞库。
1.2 药物与试剂 北葶苈子采自河南南阳,经河南中医药大学陈随清教授和董诚明教授鉴定为十字花科植物独行菜Lepidium apetalumWilld.的干燥成熟种子。DMEM 培养基(美国Gibco 公司,批号1833721);胎牛血清(杭州四季青生物工程研究所,批号17030506);H2O2溶液(天津恒兴化学试剂制造有限公司,批号20170410);普罗布考(美国Sigma 公司,货号P9672);AnnexinV⁃FITC/PI 凋亡检测试剂盒 (美国 BD 公司,货号6119909);JC⁃1 线粒体膜电位试剂盒(美国BD 公司,货号6113545);活性氧检测ROS 试剂盒(北京索莱宝科技有限公司,批号20170511);MDC 自噬检测试剂盒(北京索莱宝科技有限公司,批号20170530);乳酸脱羟酶(LDH) 试剂盒、超氧化物歧化酶(T⁃SOD) 检测试剂盒、丙二醛(MDA)检测试剂盒、谷胱甘肽过氧化物酶(GSH⁃PX) 试剂盒(南京建成生物工程研究所,批号分别为20170314、20170308、201710309、20170306 );caspase⁃3 (美国Cell Signaling 公司,货号9665 s);Bax、Bcl⁃2、β⁃actin 抗体(英国Abcam 公司,货号分别为ab32503、ab59348、ab56830);羊抗兔二抗(美国Li⁃Cor 公司,批号C80911⁃11)、羊抗鼠二抗(美国国Li⁃Cor 公司,批号C80816⁃10)。
1.3 仪器 ELIEⅡ细胞培养箱(美国Revco 公司);ECLIPSE TS100 倒置显微镜(日本Nikon 公司);Mill⁃Q 纯水仪(赛恩斯科技有限公司);SW⁃CJ⁃1F 型净化工作台(苏州净化设备有限公司);TDZ5⁃WS 型离心机(上海卢湘仪离心机仪器有限公司);精密分析天平 (瑞士Mettmer Toledo 公司);iMark 酶标仪(美国Bio⁃Rad 公司);BioMate 3S 分光光度计 (美国Thermo Fisher Scientific 公司);FACS AriaⅢ流式细胞仪、Aria 电脑工作站(美国BD 公司);Odyssey CLx 双色红外激光成像系统(美国Li⁃Cor 公司)。
2 方法
2.1 药物炮制与提取 北葶苈子生品水提物和炮制品水提物制备方法参照本课题组已建立的方法[9⁃10],北葶苈子生品水提物提取回收率为6.6%,炮制品水提物提取回收率为13.4%。
2.2 细胞培养与分组 H9c2 大鼠心肌细胞置于37 ℃、5%CO2,饱和湿度,无菌环境下,使用含10% FBS 的高糖DMEM 培养液培养细胞,每2~3天更换1 次培养液,取对数生长期的细胞用于本实验。96 孔板实验中,细胞浓度以5 × 104/mL,200 μL/ 孔种板;6 孔板实验中,细胞浓度以5×105/mL,3 mL/孔种板。细胞培养24 h 后,正常组给予新鲜含血清培养液培养6 h,模型组给予200 μmol/L H2O2培养液培养6 h,普罗布考组给予200 μmol/L H2O2和10 μg/mL 普罗布考的培养液培养6 h,不同剂量北葶苈子生品组(以干浸膏剂量算) 分别给予400、200、100 μg/mL 北葶苈子生品和200 μmol/L H2O2的培养液培养6 h,不同剂量北葶苈子炮制品(以干浸膏剂量算) 分别给予400、200、100 μg/mL 北葶苈子炮制品和200 μmol/L H2O2的培养液培养6 h。
2.3 MTT 法检测细胞存活率 将H9c2 细胞接种于96 孔板中,经药物处理结束后,吸除培养液上清,换用含10%MTT 的新鲜培养液孵育4 h,弃除培养液上清,每孔加入150 μL DMSO,摇床震荡10 min 混匀,用酶标仪检测波长490 nm 处吸光度值(OD)。每组设置6 个复孔,实验重复3 次。细胞存活率=[(OD实验组/OD正常组)] × 100%。
2.4 流式细胞术检测细胞ROS、线粒体膜电位、细胞凋亡率、自噬空泡 将H9c2 细胞接种于6 孔板,经药物处理结束后,吸取培养上清液,洗涤1次并吸取洗涤液,每孔加入0.25% 胰蛋白酶200 μL 进行消化细胞,用3 mL 含血清的培养液终止消化,将细胞悬液与上述收集液以800 r/min 离心5 min,收取细胞,按照试剂盒提供的说明书进行AnnexinV⁃FITC/PI 双染、DCFH⁃DA 探针孵育、JC⁃1 探针孵育及MDC 染料孵育及其他规定操作,利用流式细胞仪和Aria 电脑工作站进行各项检测分析。实验重复3 次。
2.5 Incell⁃Western 法检测细胞凋亡相关蛋白 将H9c2 细胞接种于96 孔板,经药物处理结束后,小心吸出培养液。在室温条件下,将细胞用150 μL 10%甲醛固定20 min,用150 μL 0.1%Triton⁃x⁃100洗涤细胞(5 min/次,5 次),用150 μL 封闭液封闭1.5 h;在4 ℃条件下进行Bax、Bcl⁃2、caspase⁃3、β⁃actin 一抗孵育 (1 ∶100 稀释,50 μL/孔,12 h),然后,在室温条件下,PBST 洗涤细胞(5 min/次,5 次);在室温和避光条件下孵育二抗(1 ∶500 稀释,50 μL/孔,1 h),PBST 洗涤细胞(5 min/次,5 次);小心除尽洗涤液,使用双色红外激光成像系统(Odyssey CLx,USA) 进行双通道700、800 nm 检测与分析。实验重复3 次。
2.6 细胞LDH、MDA、T⁃SOD、GSH⁃PX 水平检测 将H9c2 细胞接种于6 孔板,经药物处理结束后,收集培养上清液,按试剂盒说明书进行细胞培养上清液中LDH 水平的检测;收集细胞,进行反复冻融3 次,测定样品蛋白浓度,遵照试剂盒说明书进行细胞中MDA、T⁃SOD、GSH⁃PX 水平检测。实验重复3 次。
2.7 统计学分析 采用SPSS 19.0 统计软件进行分析,数据以() 表示,多组间比较采用方差分析。以P≤0.05 表示差异具有统计学意义。
3 结果
3.1 北葶苈子炮制前后对H2O2诱导的H9c2 细胞存活率的影响 与正常组比较,模型组H9c2 细胞存活率降低(P<0.01);100、200、400 μg/mL 北葶苈子炮制品和生品水提物干预后,H2O2诱导的H9c2 细胞存活率均提高(P<0.05,P<0.01),见图1。最终选定200 μg/mL 北葶苈子生品、炮制品进行后续作用机制研究。
3.2 北葶苈子炮制前后对H2O2诱导的H9c2 细胞凋亡的影响 与正常组比较,模型组H9c2 心肌细胞凋亡率和坏死率增加(P<0.01),存活率下降(P<0.01)。与模型组比较,200 μg/mL 北葶苈子生品、炮制品均能降低H9c2 细胞的凋亡率及坏死率(P<0.01),提高H9c2 细胞的存活率(P<0.01),且北葶苈子炮制品组与生品组比较,差异无统计学意义(P>0.05)。见图2。

图1 北葶苈子生品与炮制品对H2O2 诱导的H9c2 细胞存活的影响(, n=5)Fig.1 Effects of the crude and processed LaSs on HHCs survival (, n=5)
3.3 北葶苈子炮制前后对H2O2诱导的H9c2 细胞自噬空泡的影响 与正常组比较,模型组H9c2 心肌细胞的自噬空泡增多(P<0.01),与模型组比较,给予200 μg/mL 北葶苈子生品、炮制品均能减少H9c2 细胞的自噬空泡(P<0.01)。见图3。
3.4 北葶苈子炮制前后对H2O2诱导的H9c2 细胞ROS 水平的影响 与正常组比较,模型组H9c2 心肌细胞的细胞ROS 水平上升(P<0.01);与模型组比较,给予200 μg/mL 北葶苈子生品、炮制品后均能降低H9c2 细胞ROS 水平(P<0.01)。见图4。
3.5 北葶苈子炮制前后对H2O2诱导的H9c2 细胞线粒体膜电位的影响 与正常组比较,模型组H9c2 心肌细胞的线粒体膜电位下降(P<0.01),与模型组比较,给予200 μg/mL 北葶苈子生品、炮制品后均能升高H9c2 细胞的线粒体膜电位(P<0.01),且北葶苈子炮制品组与北葶苈子生品组比较,差异无统计学意义(P>0.05),见图5。
3.6 北葶苈子炮制前后对H2O2诱导的H9c2 细胞caspase⁃3、Bax、Bcl⁃2 蛋白表达的影响 与正常组比较,模型组caspase⁃3 表达、Bax/Bcl⁃2 比值升高(P<0.01)。与模型组比较,北葶苈子生品、炮制品均降低细胞Bax/Bcl⁃2 比值(P<0.01),且北葶苈子炮制品组caspase⁃3 蛋白表达降低(P<0.05)。见图6。
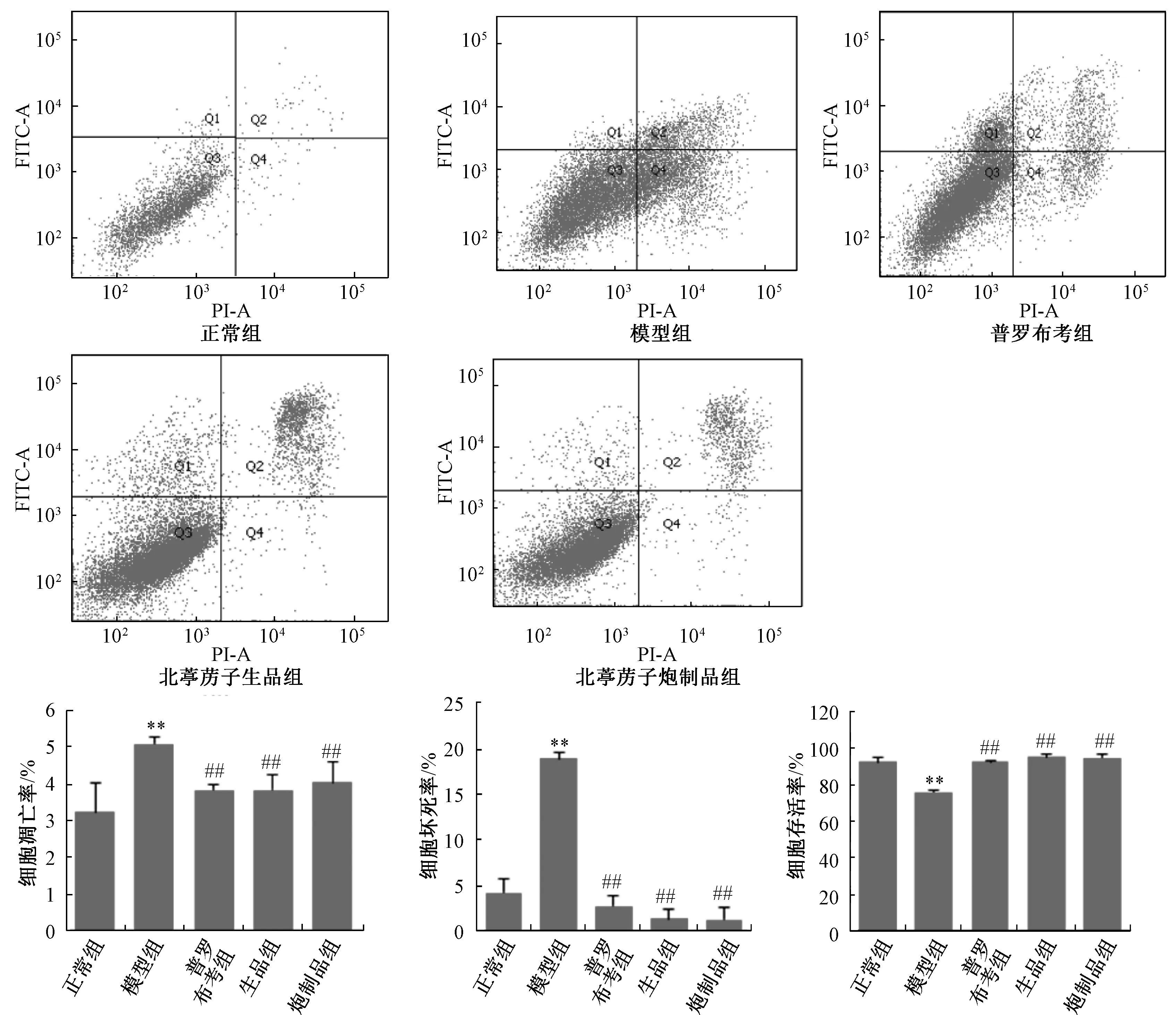
图2 北葶苈子生品与炮制品对H2O2 诱导的H9c2 细胞凋亡的影响(, n=3)Fig.2 Effects of the crude and processed LaSs on HHCs apoptosis (, n=3)

图3 北葶苈子生品与炮制品对H2O2 诱导的H9c2 细胞自噬空泡的影响(, n=3)Fig.3 Effects of the crude and processed LaSs on HHCs autophagic vacuoles (, n=3)
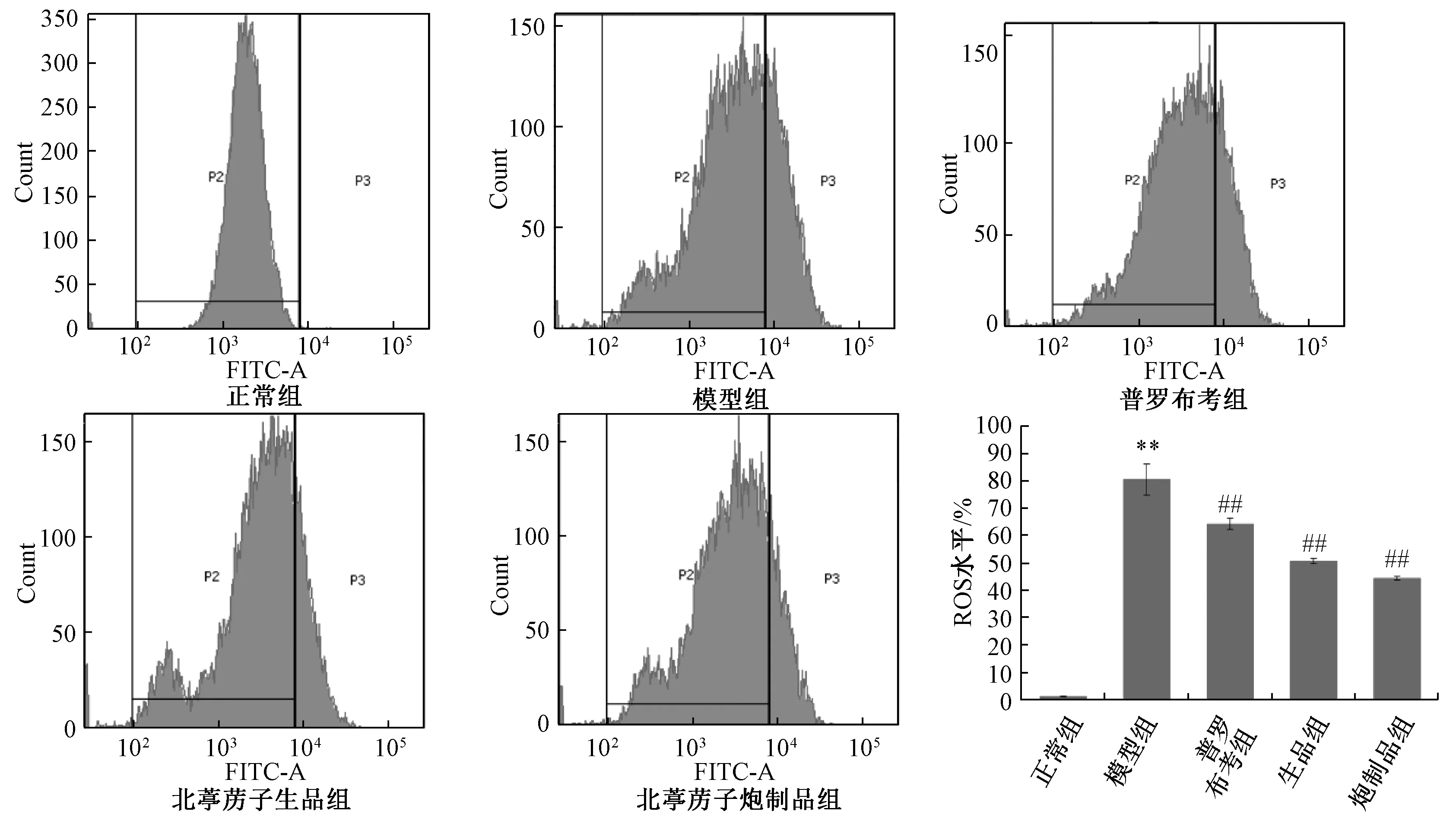
图4 北葶苈子生品与炮制品对H2O2 诱导的H9c2 细胞ROS 水平的影响(, n=3)Fig.4 Effects of the crude and processed LaSs on HHCs ROS level (, n=3)
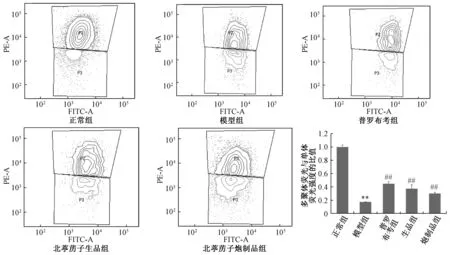
图5 北葶苈子生品与炮制品对H2O2 诱导的H9c2 细胞线粒体膜电位的影响(, n=3)Fig.5 Effects of the crude and processed LaSs on the mitochondrial membrane potential of HHCs (, n=3)
3.7 北葶苈子炮制前后对H2O2诱导的H9c2 细胞LDH、T⁃SOD、MDA、GSH⁃PX 水平的影响 与正常组比较,模型组H9c2 细胞培养液中LDH 水平及细胞MDA 水平升高,H9c2 细胞T⁃SOD、GSH⁃Px水平下降(P<0.01)。与模型组比较,北葶苈子生品组 (200 μg/mL) 和北葶苈子炮制品组(200 μg/mL)T⁃SOD、GSH⁃PX 水平升高(P<0.05,P<0.01),细胞培养液中LDH 水平和细胞MDA 水平降低(P<0.01)。见表1。
4 讨论
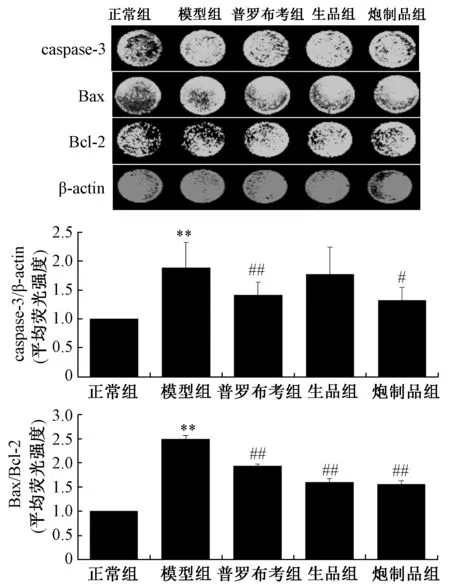
图6 北葶苈子生品与炮制品对H2O2 诱导的H9c2细胞caspase⁃3、Bax、Bcl⁃2 蛋白表达的影响(, n=3)Fig.6 Effects of the crude and processed LaSs on caspase⁃3,Bax,Bcl⁃2 protein expression of HHCs (, n=3)
葶苈子最早在《神农本草经》 中以生品入药,后经《金匮玉函经》 开创了葶苈子炒法炮制品入药的先例[11]。在中国方剂数据库中检索葶苈子方剂后发现,葶苈子生品与炮制品在临床心血管疾病治疗中均有大量的使用。本实验结果表明,200 μmol/L H2O2可引起H9c2 细胞明显的心肌细胞氧化损伤,包括引发心肌细胞存活降低,线粒体膜电位下降以及细胞凋亡和自噬通路激活。经过北葶苈子生品炮制品处理后,发现在 100~400 μg/mL剂量时,北葶苈子生品与炮制品均能有效改善由H2O2诱导的H9c2 细胞损伤,且同等剂量条件下炮制品对H9c2 细胞活力的提升作用,以及对细胞培养液中细胞毒性标志物LDH 水平的抑制作用均较生品作用好,故判断北葶苈子炮制品对心肌细胞的保护作用优于生品。然后,进一步从氧化应激,凋亡和自噬方面进行了北葶苈子抗H2O2诱导H9c2 心肌细胞损伤机制研究,并对北葶苈子炮制前后进行对比。
细胞凋亡在心力衰竭中产生的重要作用不容忽视,将是研究心力衰竭的重点方向之一[12],凋亡信号能引起促凋亡蛋白Bax 与抗凋亡蛋白Bcl⁃2 表达比例失调,致使线粒体膜电位下降,细胞色素c释放,造成caspase⁃3 级联通路激活,最终导致细胞凋亡。本研究表明,200 μg/mL 北葶苈子生品或炮制处理后,两者均可一定程度的降低H2O2诱导的H9c2 细胞凋亡率,提升细胞线粒体膜电位。同时发现,北葶苈子生品和炮制品均可调节Bax/Bcl⁃2比值。推测北葶苈子通过对凋亡通路的调控,进而保护心肌细胞。此外,大量研究表明,细胞还可以通过自噬调节自身死亡,正常水平的自噬保证细胞的持续生存,过度的自噬将造成细胞的程序性死亡[13]。本研究结果表明,北葶苈子炮制前后均可一定程度的降低H9c2 细胞自噬水平。经过对比分析发现,北葶苈子炮制前和炮制后对凋亡和自噬的影响几乎无差别,但北葶苈子炮制后对caspase⁃3蛋白调节作用比炮制前作用强。
表1 北葶苈子生品与炮制品对H2O2 诱导的H9c2 细胞LDH、T⁃SOD、MDA、GSH⁃PX 水平的影响(, n=3)Tab.1 Effects of the crude and processed LaSs on the LDH,T⁃SOD,MDA and GSH⁃PX levels of HHCs (, n=3)
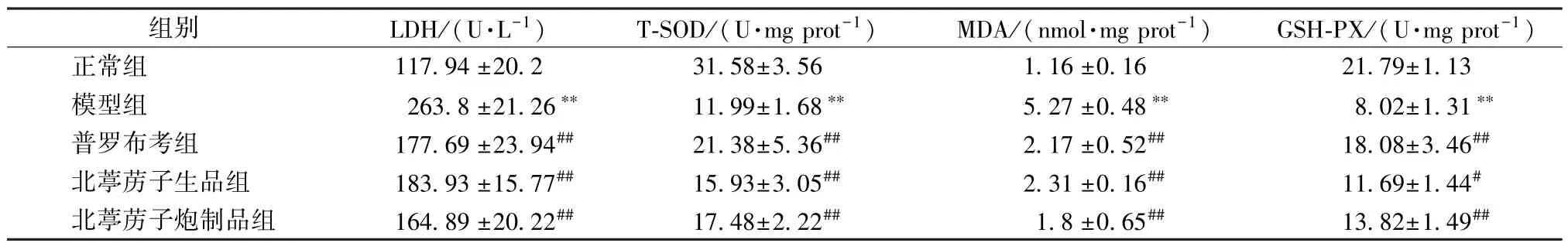
表1 北葶苈子生品与炮制品对H2O2 诱导的H9c2 细胞LDH、T⁃SOD、MDA、GSH⁃PX 水平的影响(, n=3)Tab.1 Effects of the crude and processed LaSs on the LDH,T⁃SOD,MDA and GSH⁃PX levels of HHCs (, n=3)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
有报道指出,H2O2可通过刺激细胞产生ROS自由基诱发凋亡,ROS 自由基过多已经成为缺血性心脏病的主要特征[14⁃15]。研究发现,ROS 产生过多会进一步造成线粒体渗透性转换孔(mPTP)开放,引起线粒体膜电位去极化,激活凋亡执行通路caspase⁃3 级联通路,细胞凋亡[16]。还有报道指出,大量的活性氧能诱导产生细胞自噬从而造成细胞死亡[17]。本研究结果表明,北葶苈子生品或炮制品可提高细胞抗氧化酶T⁃SOD、GSH⁃PX 水平,降低细胞氧化损伤产物MDA 水平,调节细胞总ROS 水平,从而降低细胞毒性标志物LDH 在细胞上清中的水平,且炮制品整体效果更好,这与MTT 法测定细胞活力的结果一致。而且,北葶苈子炮制品对细胞氧化损伤产物MDA 水平的作用显著性优于生品(P<0.05),故推测通过炮制,北葶苈子改善细胞氧化应激能力得到增强。
中药炮制是宝贵的中国医药遗产,其主要目的是增效、减毒、易于贮藏及便于服用等。数千年来保证了中医临床用药安全有效[18]。中药行里流传的“逢子必炒” “逢子必捣” 之说,说的正是果实和种子类药物经炒后,外皮爆裂,质地酥脆,易于煎出有效成分[19]。葶苈子的古代炮制方法较多,但自汉代的《金匮玉函经》 中记载葶苈子熬(炒)法炮制以来,炒法就成了主流并沿用至今,且其也是《中国药典》 的法定炮制方法。本研究根据药典中葶苈子的炮制方法进行清炒炮制[20]。据文献报道,北葶苈子中所含的活性成分包括强心苷类、异硫氰酸和硫苷类、脂肪油类、生物碱类、黄酮类、类萜类等[21]。有研究指出,葶苈子炒用的原理一是外壳破裂而易于煎出药效,二是由于酶受破坏,而有利于苷类成分的保存[22]。还有文献报道指出,北葶苈子经过清炒炮制后芥子苷的含有量升高[23]。北葶苈子中的脂肪油比重高达35%[24⁃25],本课题组通过GC⁃MS 分析,证明北葶苈子经过清炒炮制后多种脂肪油含有量发生降低[8]。经过本研究发现,通过炮制北葶苈子改善细胞氧化应激的能力得到增强,从而对心肌细胞保护作用增强,因此推测北葶苈子炮制品提取物中抗氧化成分含有量有所增高。
综上所述,北葶苈子炮制前后均可以有效改善H2O2诱导的H9c2 心肌细胞损伤,提高心肌细胞活力,抑制细胞凋亡和自噬,改善心肌细胞内氧化应激。北葶苈子炮制品比生品对心肌细胞存活率的提高作用更强,这与其炮制后抗氧化成分溶出率增多是否有关尚需进一步研究。
