术前外周血中性粒细胞与淋巴细胞比值、血小板与淋巴细胞比值对肝癌患者并发微血管浸润的预测价值
2020-09-15车宇梁静王蒨蔡英全郭俊俊邵帅刘伟
车宇,梁静,王蒨,蔡英全,郭俊俊,邵帅,刘伟
陕西省肿瘤医院1放疗科,2普外科,西安 710061
肝癌是全世界范围内常见的恶性肿瘤之一,男性发病率略高于女性,随着科学技术的发展,其病死率得到了一定控制,但中国人口基数相对较大,其发生率和病死率仍居高不下[1]。近年来有研究发现,微血管浸润(microvascular invasion,MVI)已成为影响肝癌患者术后生存情况的独立危险因素之一,因肝癌患者手术治疗后易经血管发生肝转移,在一定程度上增加了手术复发率,故肝内微小病灶转移与MVI密切相关[2]。恶性肿瘤的起始阶段需要炎性环境长期刺激,同时肿瘤细胞也会加重机体炎症反应。大量临床研究证实,机体炎症反应在肿瘤发生发展过程中具有较为重要的作用,而肿瘤侵袭、转移与中性粒细胞、淋巴细胞均存在一定的相关性[3-5]。手术将恶性肿瘤细胞切除后,可在一定程度上减轻机体炎症反应,但部分患者的炎症反应状态并未随肿瘤一起消除,可能隐藏在患者体内,有可能促进肿瘤再次复发。有关研究证实,术前炎症指标如外周血中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)可有效预测肝癌患者预后[6-7]。基于此,本研究对肝癌患者的术前外周血NLR、PLR进行分析,并探讨了肝癌患者并发MVI的影响因素,现报道如下。
1 资料与方法
1.1 一般资料
选择2016年5月至2019年5月陕西省肿瘤医院收治的肝癌患者。纳入标准:①均由同一团队实施全身麻醉下的肝癌切除术,术后经病理检查确诊为原发性肝癌;②均为单发肿瘤,且肿瘤直径≤5 cm;③肝储备功能正常,肝功能Child-Pugh分级为A~B级;④年龄为18~80岁,性别不限;⑤术中切缘距肿瘤边缘≥1 cm,且边缘阴性,并于显微镜下判断MVI情况[5];⑥临床资料及病理资料完整。排除标准:①合并其他恶性肿瘤;②临床证据表明患者处于炎症状态或伴发感染;③术前接受过其他治疗,如放化疗、肝动脉化疗栓塞术等;④肿瘤已侵袭其门脉主干及一级分支、总肝管及一级分支、肝静脉主干及下腔静脉;⑤肿瘤已出现肝外转移。依据纳入和排除标准,本研究共纳入202例肝癌患者,其中MVI阳性92例,MVI阴性110例。
1.2 资料收集
根据医院电子病历系统收集肝癌患者的临床资料,包括年龄、性别、是否发生肝硬化、是否发生慢性病毒性肝炎、Child-Pugh分级、肿瘤直径、分化程度、术前甲胎蛋白(alpha fetoprotein、AFP)水平、术前外周血NLR、术前外周血PLR,其中术前外周血NLR、PLR的检查结果均为术前3~7天的结果。
1.3 观察指标
比较MVI阳性和MVI阴性肝癌患者的术前外周血NLR、PLR。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析肝癌患者术前外周血NLR、PLR单独及联合检测对MVI的诊断价值,其中联合诊断时将2项指标均高于临界值认定为阳性。计算ROC曲线下面积(area under the curve,AUC)、95%可信区间(confidence interval,CI)、临界值、灵敏度及特异度。分析肝癌患者并发MVI的影响因素。
1.4 统计学方法
采取SPSS 17.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Logistic回归模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 术前外周血NLR、PLR的比较
MVI阳性肝癌患者的术前外周血NLR为(3.39±1.56),高于MVI阴性患者的(2.85±1.42),差异有统计学意义(t=2.573,P<0.05)。MVI阳性肝癌患者的术前外周血PLR为(120.35±26.87),高于MVI阴性患者的(112.38±20.36),差异有统计学意义(t=2.338,P<0.05)。
2.2 肝癌患者术前外周血NLR、PLR单独及联合检测对MVI 的诊断价值
ROC曲线分析结果显示,肝癌患者术前外周血NLR、PLR单独检测诊断MVI的临界值分别为3.75和116.08,AUC分别为0.565和0.598,其AUC均低于术前外周血NLR、PLR联合诊断的0.694,差异均有统计学意义(Z=2.291、2.492,P<0.05)。(表1、图1)
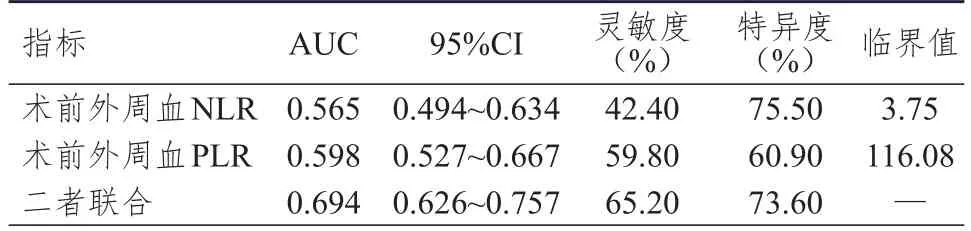
表1 肝癌患者术前外周血NLR、PLR单独及联合检测对MVI的诊断价值
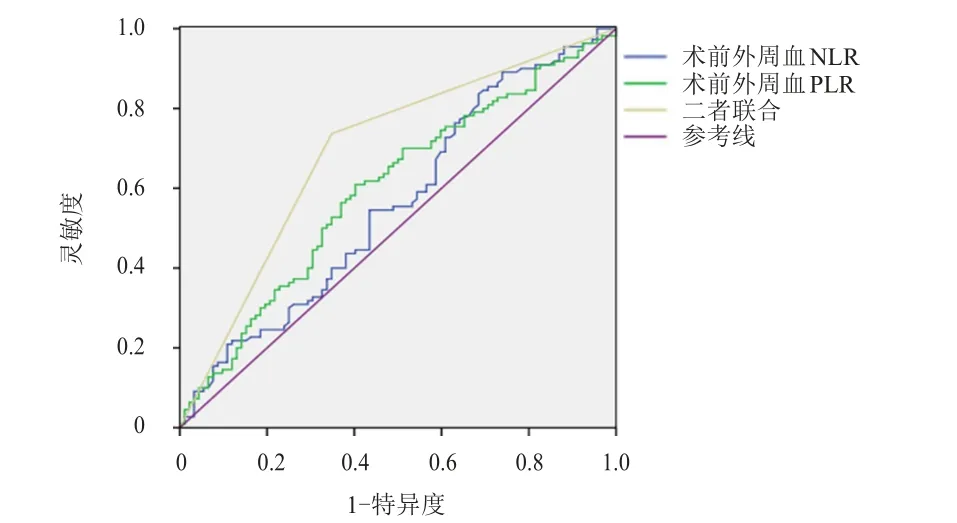
图1 肝癌患者术前外周血NLR、PLR 单独及联合检测诊断MVI的ROC曲线
2.3 肝癌患者并发MVI影响因素的单因素分析
单因素分析结果显示,MVI阳性和MVI阴性肝癌患者的性别、年龄、肝硬化发生情况、慢性病毒性肝炎发生情况、Child-Pugh分级比较,差异均无统计学意义(P>0.05)。MVI阳性和MVI阴性肝癌患者的肿瘤直径、分化程度、术前AFP水平、术前外周血NLR和PLR比较,差异均有统计学意义(P<0.05)。(表2)
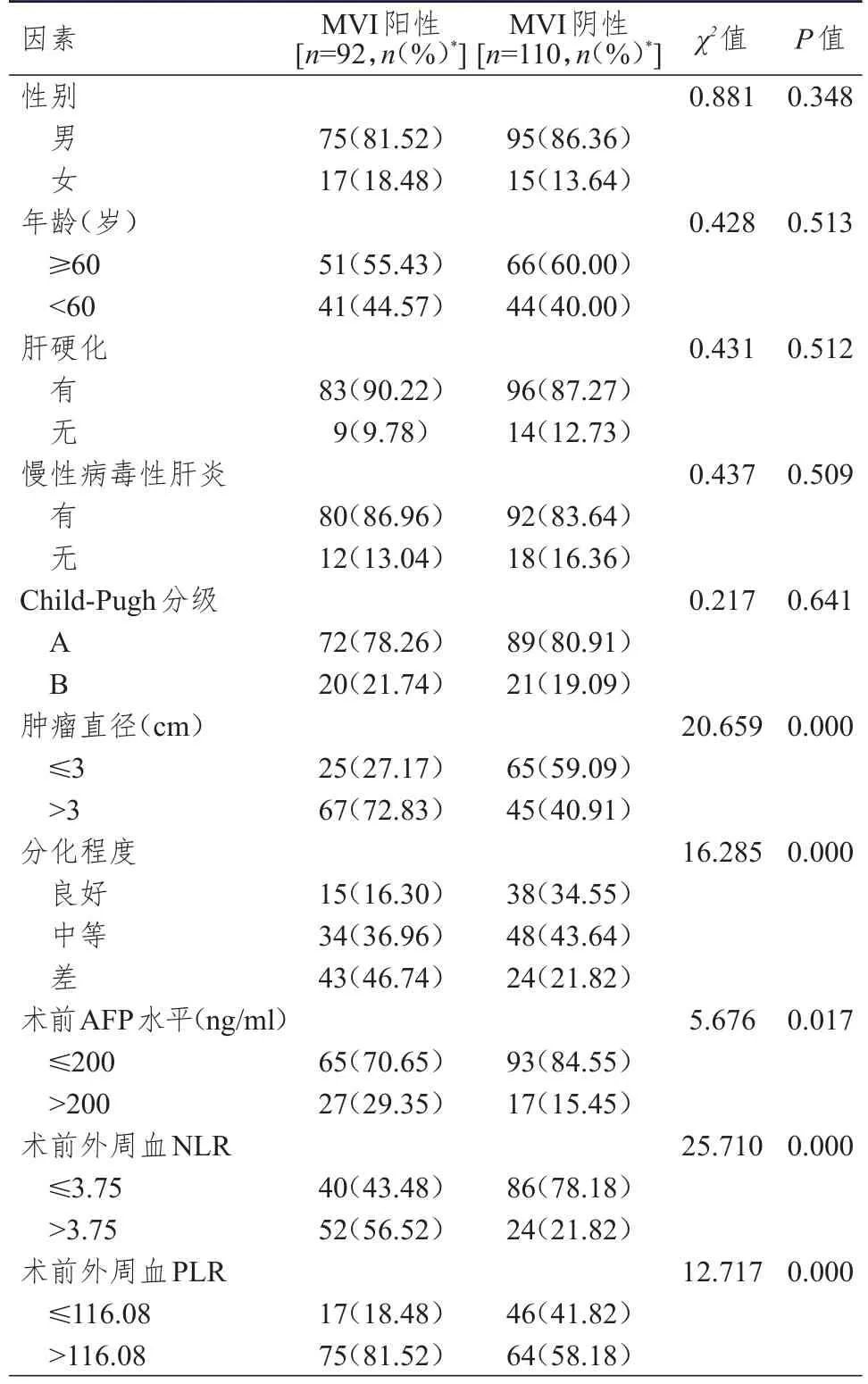
表2 肝癌患者并发MVI影响因素的单因素分析(n=202)
2.4 肝癌患者并发MVI影响因素的多因素分析
多因素分析结果显示,术前AFP水平、术前外周血NLR和PLR均是肝癌患者并发MVI的独立危险因素(P<0.05)。(表3)
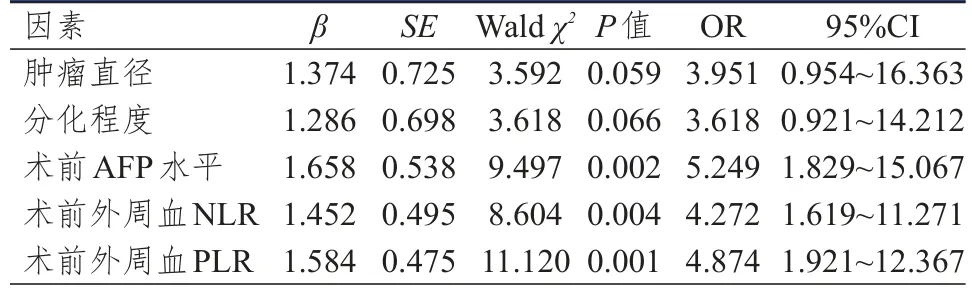
表3 肝癌患者并发MVI影响因素的多因素分析(n=202)
3 讨论
肝癌是一种发生于肝脏部位的恶性肿瘤,分为原发性和继发性肝癌两类,现阶段对原发性肝癌的病因和发病机制尚未完全了解,但随着中国老龄化的加速及人口的增加,其已成为中国第四大常见且致命的恶性肿瘤。近年来对肝癌的研究逐渐深入,对其筛查和诊断方式也不断改进,使得直径≤5 cm肝癌的检出率日益上升。相关研究发现,MVI能够在一定程度上增加肝癌的恶性程度,且对肝癌手术后微小转移和复发均具有较好的预测价值[9]。肝癌根治手术仍是目前公认的最佳治疗手段,随着医学科学技术的不断进步,肝癌患者的生存率得到了有效提高,但术后复发率仍居高不下,已成为现阶段肝癌的主要研究方向之一。恶性肿瘤术后复发不仅与其生物学特性有关,还与其存在的微环境密切相关。相关研究发现,肿瘤细胞的异常增殖可对人体的免疫系统造成一定影响,肿瘤组织周围聚集着大量的炎症细胞,手术仅将肿瘤组织切除,但未消除体内炎症反应,导致术后可能出现复发[10-11]。
NLR代表中性粒细胞与淋巴细胞的比值,NLR过高代表机体中性粒细胞较多,即机体存在炎症反应,而淋巴细胞的降低则反映机体免疫能力下降。大量临床研究发现,术前NLR对多种恶性肿瘤患者术后早期复发具有较高的预测价值[12-15]。任家书等[16]研究证实,NLR不仅是小肝癌患者发生MVI的独立危险因素之一,还对其具有较好的预测价值,且NLR>3.27的肝癌患者发生MVI的可能性较高,与本研究结果一致。本研究结果显示,肝癌患者术前外周血NLR单独检测诊断MVI的临界值为3.75,而且NLR是肝癌患者并发MVI的独立危险因素之一(P<0.05),证明NLR对肝癌患者并发MVI具有一定的预测价值。NLR能够反映恶性肿瘤患者促肿瘤炎症反应与抗肿瘤免疫反应之间的平衡状态,其中的中性粒细胞能够分泌多种细胞因子,对肿瘤的发生、发展均具有一定的促进作用,而淋巴细胞则通过激活机体免疫系统杀伤肿瘤细胞[17]。肝癌患者术前外周血NLR过高,证明其机体免疫系统已处于失衡状态,可在一定程度上增加肝癌细胞的恶性程度和浸润性,进一步增加肝癌并发MVI的风险。
PLR代表血小板与淋巴细胞的比值,血小板能够通过其分泌的多种细胞因子促进血管生成,而肿瘤患者体内多存在血小板升高状态,因血小板上升会使机体处于高凝状态,导致血流速度减慢,对肿瘤细胞的转移具有促进作用,同时还会对肿瘤细胞起到一定的保护作用[18]。本研究结果显示,肝癌患者术前外周血PLR单独检测诊断MVI的临界值为116.08,而且PLR是肝癌患者并发MVI的独立危险因素之一(P<0.05),证明PLR对肝癌患者并发MVI具有一定的预测价值,这与于艳龙等[19]的研究结果存在一定的差异,可能是由于研究时间、研究地域、样本数量、纳入和排除标准、检查方式、样品保存方式等不同导致。本研究还分析了肝癌患者术前外周血NLR、PLR联合检测对MVI的诊断价值,结果发现,术前外周血NLR、PLR联合检测诊断MVI的AUC高于任一指标单独诊断的结果,分析原因可能是两者均能够反映肝癌患者的免疫能力,两者联合可弥补单一指标诊断的不足,能够在一定程度上增加诊断准确率,有利于临床中对肝癌患者并发MVI的诊断。
本研究结果还显示,AFP也是肝癌患者并发MVI的独立危险因素之一(P<0.05),与姚明解等[20]文献报道一致。AFP是肝癌诊断中最常用的血清标志物之一,其水平波动能够反映肝硬化患者疾病活动及其恶化发展为肝癌的过程,但其灵敏度较差,存在较高的假阳性率,需与其他检查方式联合才能提高诊断准确率[21-22]。本研究仍存在一定的不足之处,由于本研究为回顾性分析,存在样本数量有限、患者背景差异、病例仅为本院患者等局限性,后续还需进行多样本、多中心研究进一步证实本研究的结果。
综上所述,术前外周血NLR、PLR可对肝癌患者MVI的发生情况进行一定的预测,且联合检测的预测价值高于单一检测。
