绵羊细颈线虫耐伊维菌素虫株三期幼虫P-gps基因表达分析
2020-09-14王鹏龙罗晓平方变变滕柏桧李军燕杨晓野
王鹏龙 罗晓平,2 刘 阳 方变变 杜 勤 滕柏桧 李军燕 杨晓野*
(1.内蒙古农业大学 兽医学院,呼和浩特 010018; 2.内蒙古自治区农牧业科学院 兽医研究所,呼和浩特 010031)
细颈线虫(Nematodirus)是绵羊胃肠道线虫常见的寄生虫之一,在长期采用化学药物防治胃肠道线虫病的过程中,某些虫株会对驱虫药物产生一定耐药性。Oliver等[1]对新西兰21个羊场中扁刺细颈线虫(Nematodirusspathiger)和尖刺细颈线虫(Nematodirusfilicollis)耐药性调查发现,有11 个羊场的羊群感染细颈线虫且对阿苯达唑产生耐药性,有10 个羊场疑似产生耐药性,仅有1 个羊场分离的细颈线虫虫株对该药物敏感。据额叶勒德格等[2]报道,内蒙古乌审旗地区放牧绵羊细颈线虫对伊维菌素产生了较强的耐药性,粪便虫卵计数减少试验显示,用药后细颈线虫虫卵平均减少率不到10%,虫卵转阴率为0。Han等[3]报道内蒙古东部地区10 个放牧羊群胃肠道线虫耐药性调查,细颈线虫和捻转血矛线虫对伊维菌素、阿苯达唑均产生不同程度的耐药性。李辉明[4]对青海省同仁县牦牛胃肠道线虫耐药调查显示,该地区细颈线虫对阿苯达唑产生了耐药性。可见细颈线虫在某些地区对常用驱虫药物已产生耐药性。
目前,驱虫药耐药机制大致可分为两大类,其一是特异性机制,即药物结合虫体的靶位发生改变,从而导致药物对虫体无效[5]。其二是非特异性机制,即虫体在解毒过程中,多种特异性酶活性的增加以及细胞膜转运蛋白增加使得药物外排[6]。随着多重耐药性的出现,膜转运蛋白增加一直是近十年以来的研究目标。在非特异性机制膜转运蛋白研究中,已有资料显示,在ABC转运蛋白超家族中,外输泵P-gps和多药耐药蛋白 MRP(Multi-drug resistance protein,MRP)是主要的膜蛋白外排通道。其中 P-gps 主要调控伊维菌素在宿主体内吸收、分布和消除[7]。据报道,某些胃肠道线虫出现耐药性与P-gps基因过表达有关。比如,肿孔古柏线虫(Cooperiaoncophora)在体内接触大环内酯类药物后,P-gps基因表达明显上调[8]。Raza 等[6]用伊维菌素治疗宿主后,其捻转血矛线虫耐伊维菌素虫株P-gp-2基因表达增加。但是,到目前为止,尚无关于绵羊细颈线虫耐伊维菌素虫株ABC转运蛋白基因的相关研究。因此,本研究拟以不同浓度的伊维菌素作用耐伊维菌素奥丽春细颈线虫(Nematodirusoiratianus)三期幼虫,以RT-qPCR检测耐伊维菌素细颈线虫三期幼虫P-gps基因的表达情况,旨在为研究奥丽春细颈线虫耐药机理以及分子检测耐药性方法的建立提供基础数据。
1 材料与方法
1.1 试验材料
耐伊维菌素奥丽春细颈线虫(N.oiratianus)虫株于2018 年4—6 月在内蒙古乌审旗地区自养自繁的羊群中分离。该羊群在近5 年一直使用伊维菌素驱虫,每年驱虫2~3 次。本研究室分离得到该虫株并建立实验室动物感染模型后,使用伊维菌素2 倍剂量驱虫时,粪便虫卵减少率为0。该虫株现保存于内蒙古自治区农牧业科学院。
连续收集单独感染有奥丽春细颈线虫的绵羊粪便,在厌氧和常温条件下运输至本研究室。采用饱和盐水漂浮法和筛网拦截法,收集大量细颈线虫虫卵,置于玻璃平皿,在蒸馏水中27 ℃培养15 d,收集三期幼虫,10 ℃保存备用。
1.2 三期幼虫处理
取约135 万条三期幼虫,用无菌无酶水洗涤3 次,均分为3 组。其中试验组分别用低浓度伊维菌素(3.90 μg/mL)(前期幼虫移行抑制试验表明,该浓度作用后幼虫迁移率达85%)和高浓度伊维菌素(19.98 μg/mL)(前期幼虫移行抑制试验表明,该浓度作用后幼虫迁移率达50%)作用三期幼虫;对照组采用0.5% DMSO作用三期幼虫;在0、3、6、12 和24 h,分别提取各组三期幼虫总RNA,每组每个时间点做3 次重复。
1.3 引物合成
参照文献已报道P-gps基因和Actin基因(内参基因)的引物序列,由上海华大有限公司合成,引物序列见表1。

表1 试验所需的引物信息Table 1 Primer required for the experiment
1.4 RNA提取与cDNA合成
参照文献[10]提取线虫三期幼虫总RNA,采用超微量分光光度仪,检测总RNA的纯度和浓度,OD260/OD280作为RNA 纯度的指标[12]。按照mRNA反转录试剂盒的说明书,对检测合格的RNA样品进行反转录,合成cDNA,-20 ℃保存备用。
1.5 荧光定量PCR
以反转录合成的cDNA为模板,Actin为内参基因,按照TB GreenTM Premix Ex TaqTM Ⅱ (TLi RNaseH Plus)说明,每个样品的每对引物做3 个重复。采用CFX Connect 实时定量 PCR 仪,进行实时荧光定量PCR反应,并添加溶解段以确定反应特异性。
1.6 数据分析
采用2-ΔΔCt法,计算目的基因mRNA 的相对表达量F[13],其数据用Excel整理,采用GraphPad Prism 6.01作图,并进行差异显著性分析。基因相对表达量F计算公式如下:
F=2-{[待测组目的基因平均Ct值-待测组内参基因平均Ct值]-[对照组目的基因平均Ct值-对照组内参基因平均Ct值]
2 结果与分析
2.1 P-gps基因引物特异性分析
P-gps基因(除P-gp-1基因)的扩增曲线呈“S”型、基线平直、走势正常,Ct值在15~30且重复性较好。P-gps基因(除P-gp-1基因)的溶解曲线皆表现为单峰且Tm值单一。由此说明,引物的特异性好,反应体系稳定,反应程序合适,得出的数据较为可靠[12]。
2.2 低浓度伊维菌素作用三期幼虫后P-gps基因的表达分析
低浓度伊维菌素作用奥丽春细颈线虫三期幼虫不同时间点,P-gps基因相对表达量见图1(a~f)。与对照组相比,在药物作用0 h,P-gps基因相对表达量均无明显变化;在药物作用3、6、12和24 h时,P-gp-1基因均不表达;P-gp-12基因在各时间点相对表达量均下调;P-gp-9.1基因在3、6和12 h时,其相对表达量分别显著上调了4.71、4.35和3.28倍(P<0.05);但在24 h时,其表达量下调;药物作用3和6 h时,P-gp-2、P-gp-3和P-gp-11基因表达量均显著下调(P<0.01),12 h时基因相对表达量上调达峰值,其表达量分别是3.77、2.2和8.3倍,而24 h时基因表达量下调。表明对该耐药虫株而言,低浓度药物作用也可能诱导P-gp-2、P-gp-3、P-gp-9.1和P-gp-11基因在不同时间点过表达,导致药物的转运或耐药机制的发生。
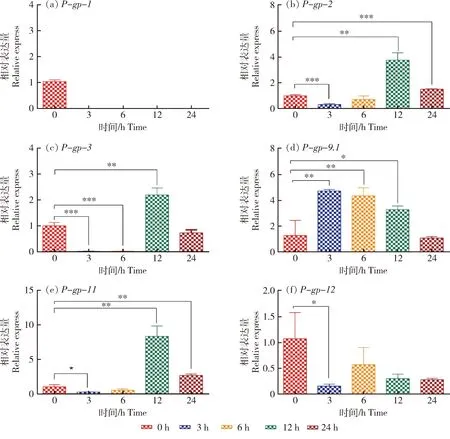
*P<0.05;**P<0.01;*** P<0.001。下同。*P<0.05;**P<0.01;***P<0.001.The same below.图1 低浓度药物作用幼虫不同时间点的 P-gps基因相对表达量Fig.1 Relative expression of P-gps gene at different time points of larvae exposed to low concentration drugs
2.3 高浓度伊维菌素作用三期幼虫后P-gps基因的表达分析
高浓度伊维菌素作用奥丽春细颈线虫三期幼虫不同时间点,P-gps基因相对表达量见图2(a~f)。与对照组相比,在药物作用0 h时,P-gps基因相对表达量均无明显变化。在药物分别作用3、6、12和 24 h 时,P-gp-1基因均不表达;在3 和6 h时,P-gp-2基因相对表达量显著下降(P<0.05),随着药物作用时间延长,在12 h时,其表达量极显著增加了4.46 倍(P<0.001);同样,P-gp-9.1基因在3和6 h时,表达量显著下降(P<0.01),在12 h时表达量极显著增加了8.29倍(P<0.001),但是在24 h时,该基因仍然是过表达;P-gp-3基因在药物作用3 h时,表达量显著下调(P<0.001),而后逐渐上调,于12 h达峰值;P-gp-11基因随着药物作用时间的增加,其表达量逐渐增加,至12 h达峰值,但在24 h时,其表达量仍然显著增加了3.06 倍;P-gp-12基因在3 h时,其表达量下调,之后逐渐增加,在24 h达最大值,显著增加2.73 倍(P<0.05)。表明随着药物浓度增大,P-gp-12基因也发生过表达,进一步说明耐药机制的发生与药物浓度密切相关。

图2 高浓度药物作用幼虫不同时间点的 P-gps基因相对表达量Fig.2 Relative expression of P-gps gene at different time points of larvae exposed to high concentration drugs
3 讨论与小结
家畜胃肠道线虫对伊维菌素敏感性下降,与寄生线虫ABC转运蛋白基因的变化密切相关[14-16]。但是,到目前为止,尚无关于绵羊细颈线虫耐伊维菌素虫株ABC转运蛋白基因的相关研究。本研究采用荧光定量PCR,分析高低浓度伊维菌素作用绵羊奥丽春细颈线虫(N.oiratianus)三期幼虫不同时间点的P-gps基因的表达情况。结果显示,高低浓度的伊维菌素作用绵羊细颈线虫三期幼虫前后,与对照组相比,随着作用时间的增加,P-gp-2、P-gp-3、P-gp-9.1、P-gp-11和P-gp-12基因表达出现明显差异。而P-gp-1基因均不表达。但是,据Lespine等[17]报道,利用秀丽隐杆线虫(Caenorhabditiselegans)P-gps基因,通过相对荧光定量PCR方法,检测未用药物作用的捻转血矛线虫(Haemonchuscontortus)耐伊维菌素虫株P-gps基因表达情况,发现包括P-gp-1基因在内的11 个P-gps基因完全可以表达,且P-gp-2、P-gp-9、P-gp-11基因表达量显著高于伊维菌素敏感株。这一现象可能由不同属线虫耐药性产生机理略有不同导致,也可能是由于在该试验条件下,药物作用仍然没有达到细颈线虫三期幼虫P-gp-1基因表达的阈值。Dicker等[18]研究表明,在环纹背带线虫(Teladorsagiacircumcincta)伊维菌素敏感株和耐药株的各个生活阶段,P-gp-9基因在耐药株的转录水平显著高于敏感株;虽然P-gp-1基因有所表达,但是耐药株与敏感株之间并无显著差异[18]。Drogemuller等[19]报道马盅口线虫(Cyathostomins)耐丙硫咪唑的成虫至少有2 个P-gps基因表达。另外,Williamson等[15]研究发现耐伊维菌素捻转血矛线虫三期幼虫P-gp-2和P-gp-9基因均过表达,但是P-gp-1基因表达量下降。然而,上述研究均未有敏感虫株过表达的现象。由此可见,尽管不同的寄生虫P-gps基因转录水平各不相同,且在敏感株与耐药株之间表达水平各有差异,甚至同一种不同地区的敏感株与耐药株的P-gps基因表达也有所差异,但是耐药株P-gps基因过表达,而敏感株P-gps无过表达现象却相当一致。因此,在以P-gps基因为基础,研究寄生虫耐药机理时,在种的水平上单独研究耐药相关基因是很有必要的,而不能一概而论。
另外,Raza等[20]报道,0.2 μg/mL伊维菌素作用耐伊维菌素捻转血矛线虫虫株三期幼虫后3 h,有5 个P-gps基因转录水平显著增加。其中P-gp-2基因转录水平增加9.1 倍;P-gp-9.1、P-gp-11基因转录水平均增加6.4 倍。Peachey等研究发现,0.068 4 μmol/L(0.056 μg/mL)伊维菌素作用马盅口线虫后3 h,P-gp-9.1基因转录水平显著增加[21]。10-8mol/L(0.009 μg/mL)和10-7mol/L(0.09 μg/mL)伊维菌素作用于敏感株和耐药株肿孔古柏线虫(Cooperiaoncophora)三期幼虫24 h后,耐药株三期幼虫P-gp-1和P-gp-11基因表达水平显著上调;然而敏感株古柏线虫三期幼虫并不表达[22]。同样,本研究也发现,随着伊维菌素作用时间的延长,P-gp-2、P-gp-3和P-gp-11基因表达量于12 h显著增加,说明耐伊维菌素虫株在药物压力的选择下,P-gps基因过表达现象普遍存在。进而表明P-gps作为一种疏水性细胞膜转运蛋白质,完全有可能作为外排泵将伊维菌素药物转运至细胞外,因而寄生虫表现出耐药表型。但是,与Raza等[20]和Peachey等[21]的报道相比,本研究中低浓度伊维菌素浓度也达 3.9 μg/mL,且药物作用12 h时,部分基因表达量才开始显著增加,这可能与不同虫株耐伊维菌素的程度不同有关。
综上,本研究发现绵羊奥丽春细颈线虫(Nematodirusoiratianus)耐伊维菌素三期幼虫受高低浓度的伊维菌素作用后,P-gp-2、P-gp-3、P-gp-9.1和P-gp-11基因在不同时间点均有不同程度过表达,但P-gp-1均不表达;不同浓度伊维菌素作用绵羊细颈线虫三期幼虫后12 h时,P-gp-2、P-gp-3和P-gp-11基因表达量均达峰值。因此,本研究在了解绵羊细颈线虫耐伊维菌素虫株三期幼虫P-gps基因表达情况的基础上,为进一步筛选绵羊细颈线虫耐伊维菌素虫株分子标记提供了基础数据。
胃肠道线虫耐药性是多基因共同决定的,其耐药机制非常复杂。因此,不仅需要先进的科学技术,而且获得理想的试验样品也很重要。遗憾的是,本研究中未分离到奥丽春细颈线虫伊维菌素敏感株,若后续条件允许,以敏感株为对照,研究该耐药株P-gps基因在不同寄生阶段,不同药物浓度作用下,不同时间点的表达情况,并采用基因组、转录组和蛋白组等测序技术,进一步验证P-gps基因的基础上继续挖掘新的耐药基因,为筛选耐药标记基因奠定基础。
