原核细胞基因表达调控与产物纯化综合实验设计与教学实践
2020-09-14赵玉红赵立青李小菊张伟英石建党
李 欣, 赵玉红, 赵立青, 李小菊, 张伟英, 石建党
(南开大学生命科学学院生物国家级实验教学示范中心,天津300071)
0 引 言
基因表达调控是指生物体内基因表达的调节控制,使细胞中基因表达的过程在时间、空间上处于有序状态,并对环境条件的变化作出反应的复杂过程[1]。对于真核生物而言,基因表达调控包括转录前水平、转录水平、转录后水平、翻译水平和翻译后水平等的调控,而原核生物的基因组和染色体结构简单,转录和翻译可以在同一时间和位置上发生,其基因表达调控主要在转录水平上,而原核表达的主要目的多是为获得高纯度的靶蛋白。基因表达调控是生物体内细胞分化、形态发生和个体发育的分子基础,作为现代分子生物学研究的中心课题之一,一直是高校生物学科理论与实践教学的重点和难点[2-4]。
为此,生物国家级实验教学示范中心(以下简称“中心”)分子生物学实验课程组设计了“原核细胞基因表达调控与产物纯化综合实验”,并应用于大三年级生物伯苓班开设的分子生物学实验课程,作为基础实验教学内容的补充与拓展。实验以原核细胞模式生物——大肠杆菌为研究对象,首先利用实时定量PCR技术在转录水平上分析IPTG对启动子活性的调节作用,同时利用免疫印迹技术检测目的蛋白受IPTG 的诱导表达情况,并最终通过亲和层析对表达产物进行纯化。该实验内容由教师科研成果转化而来,集综合性和探索性于一身,在帮助学生夯实基础理论的同时,更加注重培养学生运用所学知识分析问题解决问题的能力,进而为优化分子生物学实验教学体系,提高生命科学本科实验教学质量做出了积极尝试[5]。
1 主要实验仪器
高速冷冻离心机;常规PCR 仪;RocheLightCycler 480 实时定量PCR仪;NanoDrop 2000C 超微量分光光度计;六一水平电泳装置;Bio-Rad 垂直电泳装置;Bio-Rad Mini Trans-Blot SD半干转印槽;Bio-Rad PowerPac HC高电流电泳仪;金属浴;恒温振荡培养箱;GeneSys Chemi:XR5 凝胶成像系统;超声破碎仪等。
2 主要实验材料与试剂
转化有pGEX-4T-2 / GAPDH 质粒的大肠杆菌DH5α;RNAprepPure细菌总RNA提取试剂盒;DNase /RNase-FreeDeionized Water;Revert Aid First Strand cDNA Synthesis Kit;LightCycler 480 SYBRGreen ⅠMaster;诱导物IPTG;TE Buffer(pH 8. 0);实时定量PCR 目的基因扩增引物(上游: 5 ’-GCCAGTGAGCTTCCCGTTCAG-3 ’; 下游: 5 ’-CTGGAAAGCTGTGGCGTGATG-3’);实时定量PCR 内参基因扩增引物(上游: 5 ’-CATGCCGCGTGTATGAAGAA-3 ’; 下游: 5 ’-CGGGTAACGTCAATGAGCAAA-3’)。
30%丙烯酰胺凝胶贮液;分离胶缓冲液(1. 5 mol/L Tris-HCl,pH8. 8);浓缩胶缓冲液(0. 5 mol/ L Tris-HCl,pH6. 8);10% SDS;10% AP;TEMED;1 × 电泳缓冲液;2 × SDS-PAGE上样缓冲液;预染Marker;电转移缓冲液;100% 甲醇;PVDF 膜;Whatman 3MM 滤纸;PBST;封闭液(5%脱脂奶粉);鼠源抗GST 抗体;自制的大肠杆菌内源GAPDH 抗体;辣根过氧化物酶偶联羊抗鼠IgG;ECL化学发光试剂盒;Lysis Buffer;1 × PBS溶液;含30mM GSH 的Tris-HCl(pH8. 0);GE 亲和填料Glutathione Sepharose 4B等。
3 实验方法
3.1 大肠杆菌的诱导培养
将转化有pGEX-4T-2 / GAPDH质粒的大肠杆菌接种于适量含有80 μg / mL氨苄西林的LB 培养基中,37℃,200 r/ min振荡培养,至OD600达0. 6 ~0. 8 h,分为两组,其中一组不加IPTG(对照组),另一组加入IPTG至终浓度为1 mmol/ L(诱导组),37 ℃,200 r/ min继续振荡培养。
3.2 大肠杆菌总RNA的提取
以RNAprepPure细菌总RNA 提取试剂盒说明书为准。
3.3 RNA检测
3.3.1 定量检测
滴加2 μL 待测RNA 于NanoDrop 2000C 超微量分光光度计基座上进行定量。
3.3.2 定性检测
上样4 μg待测RNA进行1%的琼脂糖凝胶电泳,80 V,30 min。用凝胶成像系统观察结果。
3.4 反转录合成cDNA
按表1 配制反转录体系,反转录条件设定为:25℃,10 min;42 ℃,60 min;80 ℃,10 min;4 ℃,forever。

表1 反转录反应体系
3.5 实时定量PCR
按表2 配制反应体系,反应条件设定见表3。

表2 实时定量PCR反应体系
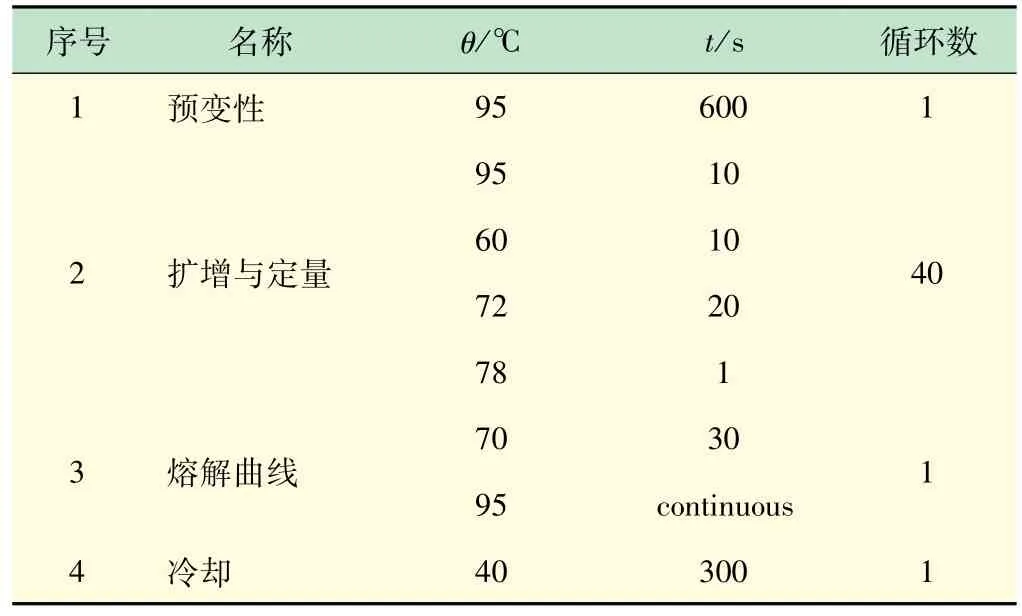
表3 实时定量PCR反应程序
3.6 蛋白质免疫印迹(WesternBlotting)
3.6.1 SDS-PAGE
在1. 5 mL离心管中加入100 μL 菌液,12 000 r/min离心1 min,弃去上清,收集菌体,在沉淀中加入100 μL PBS 溶液,充分混匀后再加入等量的2 × SDSPAGE上样缓冲液,混匀后金属浴上100 ℃加热20min,并且每隔几分钟轻弹盛装样品的离心管底部,保证菌体裂解充分;14 000 r/ min 离心5 min,上清液作为SDS-PAGE 的样品上样。所用Marker 为预染Marker。电泳电压120 V,时间1 h。
3.6.2 电泳转印
(1)根据Marker条带将凝胶切成理想大小,剪好同等大小的滤纸和PVDF膜;
(2)将PVDF膜放入100%甲醇中浸泡1 ~2 min;
(3)将凝胶、滤纸和PVDF 膜放入电转移缓冲液中平衡;
(4)在Bio-Rad Mini Trans-Blot SD半干转印槽中组装“三明治”结构,转印槽连接电泳仪,10 V 转印30 min。
3.6.3 抗体杂交
(1)将PVDF膜置于封闭液中,室温封闭45 min,PBST洗膜,根据不同目的蛋白位置剪膜,以便孵育不同抗体;
(2)分别孵育鼠源抗GST 抗体和自制的大肠杆菌内源GAPDH抗体(1∶5 000 PBST稀释),室温孵育1 h,PBST洗膜;
(3)孵育HRP偶联羊抗鼠IgG(1∶10 000 PBST稀释),室温孵育45 min,PBST洗膜。
3.6.4 成像检测
(1)将ECL化学发光试剂盒中的A液和B液1∶1配制,PVDF膜上孵育1 min后弃去;
(2)将PVDF膜放入凝胶成像系统,CCD成像。
3.7 蛋白质亲和纯化
3.7.1 样品制备
(1)收集菌体:将20 ℃1 mmol/ L IPTG诱导过夜的大肠杆菌4 ℃6 000 r/ min离心15 min,共收集250 mL菌体;
(2)超声破碎:用20 mL lysis buffer 重悬菌体漩涡混匀后置于冰水混合物中,超声功率调至200 W,超声5 s,间歇5 s,循环25 次,直至菌液渐澄清(超声前后分别对全菌、沉淀和上清留样,处理方法同3. 6. 1);
(3)获得样品:将超声裂解液4 ℃14 000 r/ min离心30 min,上清经0. 45 μm滤膜过滤即获得样品。
3.7.2 亲和纯化
(1)将GE亲和填料1 mL 装入层析柱,用10 倍柱体积的ddH20 洗涤;
(2)用10 倍柱体积的PBS溶液平衡柱子;
(3)将离心得到的上清液加入柱子,堵上堵头,使上清与填料4 ℃旋转混合1 h;
(4)将堵头去掉,填料自然沉降,收集流穿液;
(5)用5 倍柱体积PBS 过柱子洗杂,收集洗杂液(每毫升依次取样);
(6)用3 倍柱体积含有30 mmol/ L GSH 的PBS溶液洗脱,收集洗脱液(每毫升依次取样);
(7)将上述收集液分别与2 × loading buffer 混合煮样后离心,进行SDS-PAGE检测。
4 实验结果与分析
4.1 转录水平上分析IPTG 对启动子活性的调节作用
4.1.1 大肠杆菌总RNA的提取与检测按实验方法3. 1 将大肠杆菌诱导培养1 h 后,对照组和诱导组分别提取总RNA,并进行定量检测,结果如图1 所示。图1 表明,提取的大肠杆菌总RNA浓度较好,分别为532. 1 ng / μL(对照组)和754. 0 ng / μL(诱导组),但A260 / A280 比值略高于2. 0,说明提取纯度不甚理想,可能是试剂残留或RNA部分降解造成的。为此还需进一步通过琼脂糖凝胶电泳对RNA 的提取质量进行定性检测,结果如图2。
大肠杆菌总RNA进行琼脂糖凝胶电泳,理论上应该看到23S、16S 和5SrRNA3 条带。根据图2 结果中的条带数量、带型和亮度,说明总RNA 的提取质量良好。
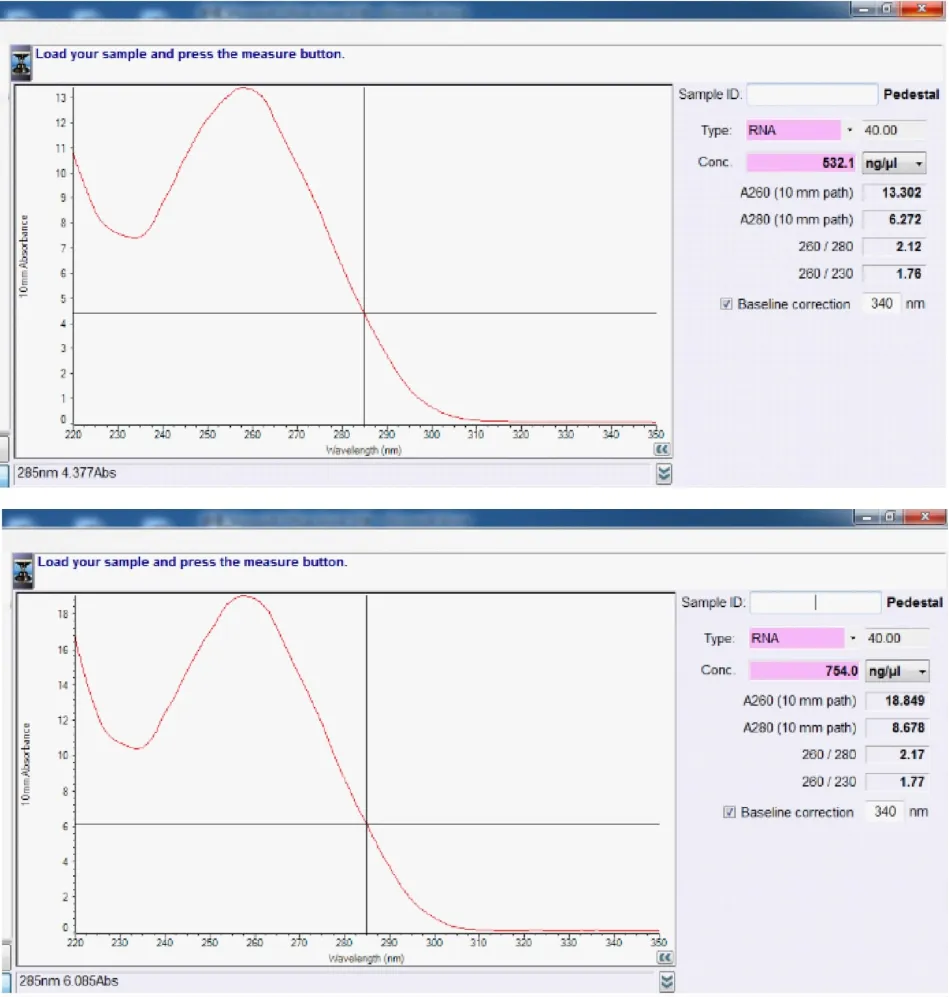
图1 大肠杆菌总RNA定量检测结果(上:对照组;下:诱导组)
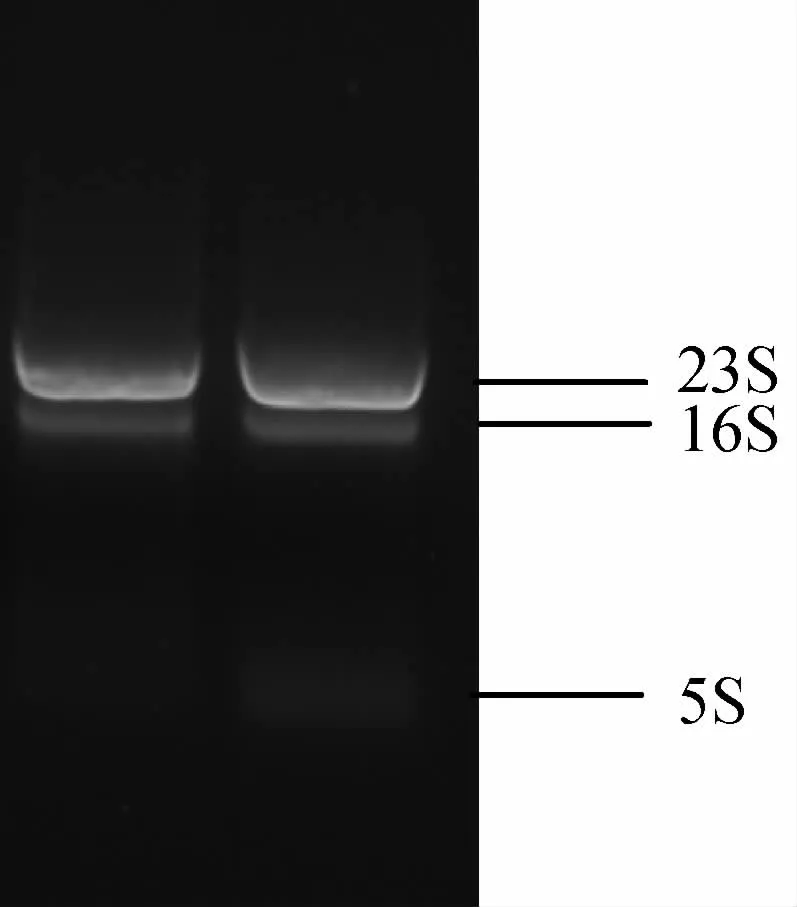
图2 大肠杆菌总RNA 定性检测结果(左泳道:对照组;右泳道:诱导组)
4.1.2 实时定量PCR分析IPTG对启动子活性的调节作用
对提取的对照组和诱导组RNA 按实验方法3. 4进行反转录合成cDNA分别作为实时定量PCR 模板,对内参基因即大肠杆菌内源16SrRNA,和目的基因即外源GST-GAPDH 按实验方法3. 5 各自进行扩增,引物与模板对应关系如表4 所示,共4 组反应,每组反应3 个重复,扩增曲线呈现较为完好的“S”形(见图3),符合定量检测要求。
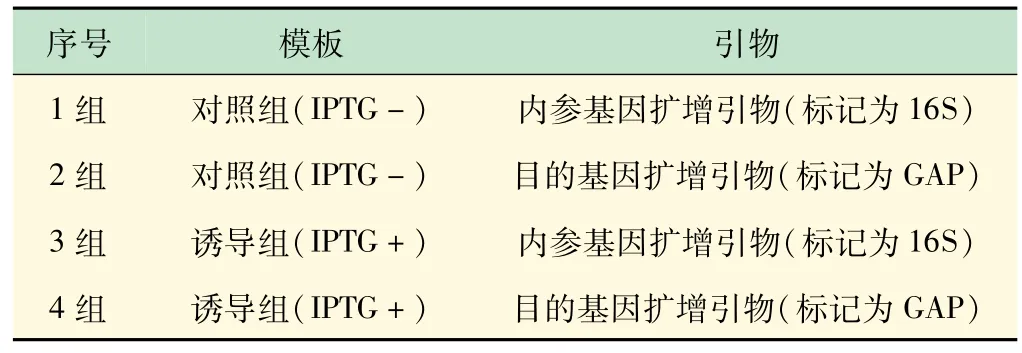
表4 实时定量PCR各组模板与引物对应关系
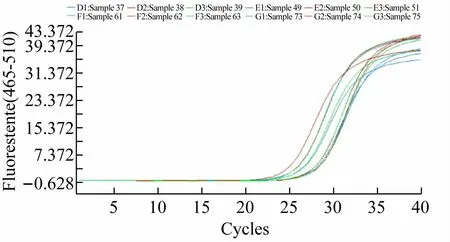
图3 实时定量PCR扩增曲线
本实验选用染料法,因此需要通过各扩增产物的熔解曲线来考察产物的特异性,如图4 所示。从图中可以看出,读板温度设为78 ℃时,扩增产物的熔解曲线分别在目的基因和内参基因Tm 处只有单一峰,表示扩增特异性良好,无非特异性扩增。
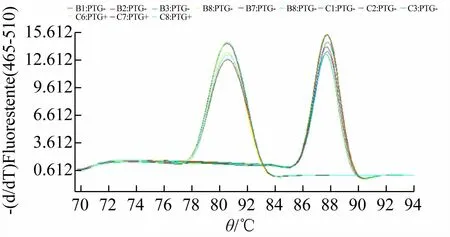
图4 扩增产物熔解曲线
在此基础上选择相对定量分析模式,诱导组经过对照组均一化处理,计算结果如表5 所示。
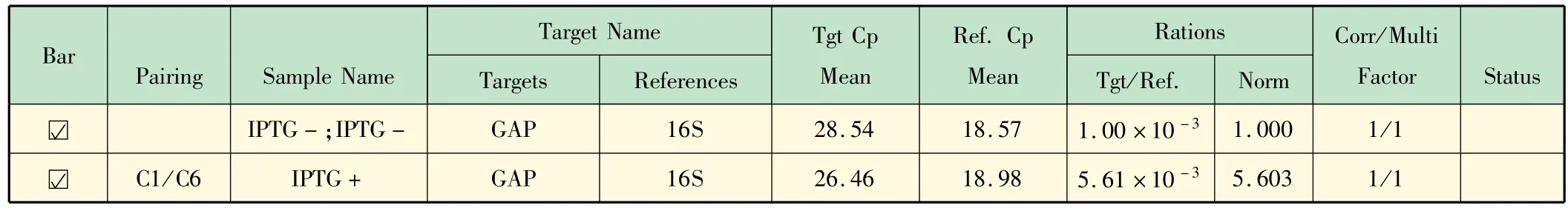
表5 实时定量PCR相对定量结果
结果表明,经内参基因校正后,诱导组目的基因mRNA水平是对照组的5. 603 倍,即经过1 mmol/ L IPTG诱导后,在转录水平上启动子活性即利用效率明显提高,是未经诱导时的5. 603 倍。
4.2 翻译水平上检测目的蛋白受IPTG的诱导表达
按实验方法3. 1 将大肠杆菌同样诱导培养1 h后,按实验方法3. 6 进行免疫印迹实验,在一抗孵育前,将PVDF膜上下剪开,上膜用鼠抗GST抗体对外源目的蛋白GST-GAPDH 进行检测,下膜用自制的大肠杆菌内源GAPDH抗体对内参蛋白GAPDH进行检测,CCD系统成像结果如图5 所示。
免疫印迹结果表明,经过1 mM IPTG 诱导后,诱导组外源目的蛋白GST-GAPDH的表达量明显高于对照组,且内参蛋白GAPGH 的检测证明这种差异并非由上样量不均而引起,说明IPTG 的诱导可在翻译水平上显著提高目的蛋白表达量。值得一提的是,理论上目的蛋白和内参蛋白可以用相同的GAPDH 抗体检出,但因两种蛋白来源上的差异,本实验选择了两种不同的抗体来保证检测效果。

图5 免疫印迹CCD系统成像结果
4.3 目的蛋白亲和纯化
按实验方法3. 7 对靶蛋白GST-GAPDH 进行亲和纯化,结果如图6 所示。
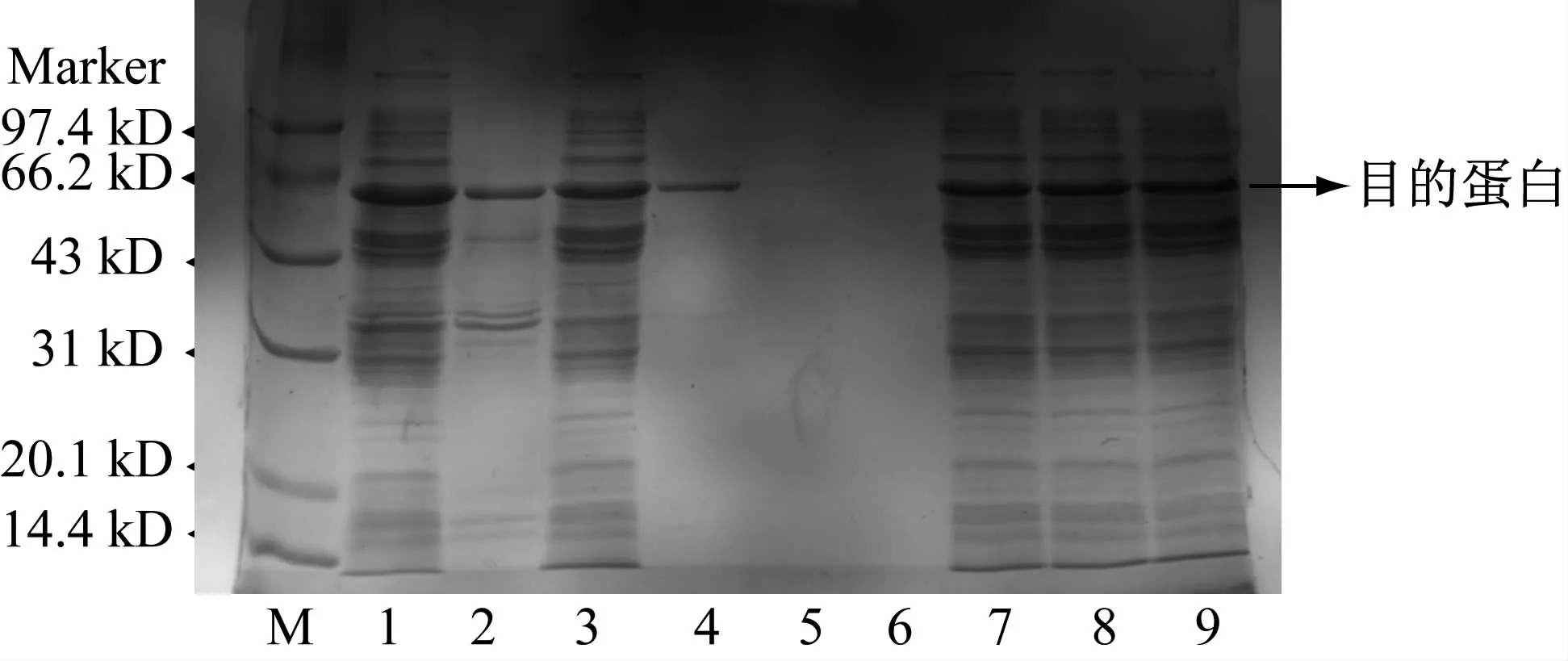
图6 亲和纯化结果
从泳道1 ~3 可见,目的蛋白表达量较高,且可溶性蛋白居多;泳道4 ~6 表明目的蛋白纯化效果良好,几乎无杂蛋白;但因亲和填料饱和或与蛋白作用不充分,导致7 ~9 泳道即流穿液中也有较多目的蛋白,后续实验需增加填料,或延长填料与蛋白孵育时间。
5 实验教学设计与实践
5.1 课堂教学
本实验内容综合性和连贯性强,对于本科生而言,操作难度大,失误率高,为不增加学生负担的同时保障教学效果,实验首先面向学有余力的大三年级生物伯苓班开设。“伯苓班”是南开大学入选的国家“基础学科拔尖学生培养试验计划”的生物学科人才培养试点班。大三年级生物伯苓班学生已经具备分子生物学理论和操作基础,且均有进入实验室参与科研活动的经历,因此,将本项目作为综合性实验开设,学生探索为主,教师指导为辅,以科研微课题的形式让学生自主安排时间完成。过程中任课教师定期组织教学讨论,并随时答疑。实验结束后要求学生以科研论文的形式撰写实验报告,并分组进行实验结果展示与汇报。任课教师综合过程表现、实验报告和展示情况给出最终成绩。上述教学模式充分突出了学生的学习主体地位,旨在充分激发学生的科研兴趣,着重培养学生独立分析问题、解决问题的科学思维和实践能力[6-7],受到伯苓班学生的广泛认可与好评。
5.2 实践拓展
本实验内容是对基础分子生物学实验教学内容的补充与延伸,因此对于其他涉及分子生物学学习的专业来说同样具有实践价值。但由于受到学时有限、实验成本较高、学生基础参差不齐等诸多因素的限制[8-9],扩大本实验项目的课堂教学受众面尚有一定困难。为此,课程组将其中的关键部分通过虚拟仿真技术呈现出来,除了模拟按部就班的实验操作以外,还着重突出了如下两点:一是将实验涉及的理论和技术原理制作成3D动画(见图7 ~10),通过动画的生动演示将微观变为可视,将抽象变为直观,将静态变为动态,能够有效帮助学生理解相应知识点;二是在多个实验环节中设计了常规教学无法平行开展的多样化实验方法以达到同一实验目的,使学生在充分体验“条条大路通罗马”的同时拓展实验思路,如Western Blotting部分中,电泳转印除了实验中用到的半干转,还有湿转法(见图11),而蛋白质亲和纯化除了填料法以外,蛋白质层析系统配合预装柱同样是科研中的常用手段(见图12)。采用虚实结合的教学模式,不仅可以拓展实验本身的广度和深度,尤其对于尚无条件开展完整实验的相关院校和专业,更能够有效弥补实体实验教学的不足,促进教学质量的提升[10-11]。

图7 “基因表达调控”原理动画界面

图8 “Western Blot”原理动画界面
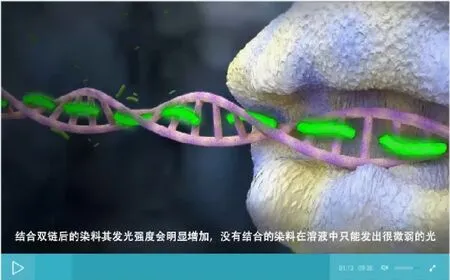
图9 “实时定量PCR”原理动画界面
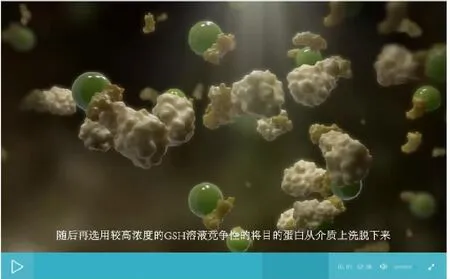
图10 “目的蛋白亲和纯化”原理动画界面

图11 电泳转印(左:湿转;右:半干转)

图12 蛋白纯化(左:填料法;右:蛋白质层析系统)
6 结 语
基因表达调控是分子生物学教学任务中的重要组成部分,让学生深入理解其基本内容,形成分子生物学基本思维方式和研究方法是教学实践的重要目标[12-13]。为此,中心分子生物学实验课程组设计了“原核细胞基因表达调控与产物纯化综合实验”作为对基础实验教学内容的补充。实验是在1 mmol/ LIPTG诱导下对大肠杆菌转录水平和翻译水平分别进行了检测。结果表明,经诱导,大肠杆菌启动子活性明显提高,目的蛋白表达量显著增加,并可通过亲和层析获得纯度较高的靶蛋白。实验内容上环环相扣,不仅让学生掌握基因表达调控相关的常用实验方法,提高学生的动手实践能力,更培养了学生系统的科研思维以及严谨的科研素养。在教学实践中,实验以实体课堂授课模式为主线,并辅以虚拟仿真技术,可满足不同学习条件、学习基础和学习需求的受众,对于增强学生的自主学习意识,推进实验教学模式多样化,提高本科实验教学水平和人才培养质量发挥了积极作用[14-16]。
