还原型谷胱甘肽添加治疗Wilson病神经系统症状的疗效及对氧化应激水平的影响
2020-09-12李良勇吴云虎李亚军杨文明
李良勇,吴云虎,李亚军,杨文明
Wilson病(WD)是一种多以儿童和青少年起病的常染色体隐性遗传性铜代谢异常疾病[1-2]。因ATP7B基因变异,致使Wilson病患者血清铜蓝蛋白合成减少,铜离子则在肝、脑等器官蓄积难以排出,从而损害肝脏、神经系统等组织,并出现相应的临床症状和体征[3]。WD是少数几种可治疗的神经系统遗传性疾病,但其病程发展快,如不及时治疗可致命。青霉胺、曲恩汀、二巯丙磺酸钠(DMPS)、锌剂等排铜和抑制铜吸收药物目前仍是WD的主要治疗手段,但众多患者用药期间可出现一系列不良反应及不可逆转的神经系统症状恶化,极大地降低了用药安全性和终身治疗的依从性[4]。因此,拓展更多有效的新治疗手段对WD患者显得尤为重要。
谷胱甘肽是一种普遍存在于动物细胞中的多功能三肽化合物。研究证实,谷胱甘肽活性巯基含量丰富,可与重金属及多种毒性物质相结合,发挥解毒作用[5]。基于此,我院将谷胱甘肽用于WD患者治疗。既往报道谷胱甘肽片和还原型谷胱甘肽注射剂对WD具有较好的疗效,且无明显不良反应[6-7],但目前尚缺乏对谷胱甘肽治疗WD的相关机制研究。众所周知,WD临床表现各异,故临床治疗和观察有所差异,尤其脑型和肝-脑型WD表现有神经系统症状的患者在治疗过程中可能会出现效果不理想甚至恶化,且相关机制不明确[1]。既往对于谷胱甘肽治疗WD神经系统症状亚型的详细分类研究无报道和观察。鉴于此,本研究将还原型谷胱甘肽注射剂应用于表现有神经系统症状的WD患者,评价其对神经系统症状的疗效,并探讨相关机制。
1 对象与方法
1.1 对象 系2016年1月至2019年11月安徽省中医院神经内科收治住院的WD患者60例。纳入标准:(1)均符合国际WD的诊断标准[3];(2)脑型或肝-脑型,表现为神经系统症状[3];(3)入组前患者或监护人知情并签署知情同意书。排除标准:(1)存在严重精神障碍;(2)伴发肝硬化失代偿,严重的心、肾、肺部疾病;(3)孕妇及哺乳期妇女;(4)无神经系统症状者。患者根据是否应用谷胱甘肽分为:(1)谷胱甘肽组:30例,男19例,女11例;年龄11~54岁,平均(27.00±7.52)岁;病程0.17~17年,平均(4.14±4.75)年。(2)对照组:30例,男19例,女11例;年龄13~47岁,平均(24.43±9.02)岁;病程0.17~17年,平均(5.55±5.24)年。两组患者性别、年龄、病程差异无统计学意义(均P>0.05),具有可比性。本研究经过本院伦理委员会批准。
1.2 方法
1.2.1 治疗方法 所有入组患者均严格执行低铜饮食,同时常规应用DMPS注射液等进行驱铜。谷胱甘肽组在此基础上加用还原型谷胱甘肽注射剂治疗(0.9~1.8 g溶于生理盐水250 ml中静脉滴注;成人1.8 g/d,儿童0.9 g/d),共4周。
1.2.2 神经功能评价方法 所有患者于治疗前后采用改良Young量表[8]评价神经功能,包含言语、吞咽、共济失调、震颤、精神、智能症状。按照5级标度法,每个项目相应症状由轻到重对应得分0~4分。
1.2.3 血液指标的检测 所有患者于治疗前后清晨空腹时抽取静脉血。首先采用日立7072型全自动生化分析仪检测血清谷丙转氨酶(ALT)、天冬氨酸转移酶(AST)水平;余部分血标本装于EDTA抗凝管外送至安徽中医药大学实验室检测血清总抗氧化能力(TAC)、丙二醇(MDA)水平。
1.2.4 24 h尿铜水平测定 所有患者于治疗前及治疗后留取24 h尿,采用火焰原子吸收分光光度法测定24 h尿铜水平。

2 结 果
2.1 谷胱甘肽组及对照组神经功能评分的比较 见表1。与治疗前比较,治疗后谷胱甘肽组及对照组改良Young量表评分均显著降低(均P<0.05)。治疗前谷胱甘肽组及对照组改良Young量表评分差异无统计学意义(P>0.05),治疗后谷胱甘肽组改良Young量表评分显著低于对照组(P<0.05)。

表1 谷胱甘肽组及对照组改良Young量表评分的比较(x±s)组别例数治疗前治疗后谷胱甘肽组3013.63±3.829.93±3.34∗△对照组3012.53±4.6311.63±4.91∗ 注:与治疗前比较∗P<0.05;与对照组比较△P<0.05
2.2 谷胱甘肽组及对照组TAC、MDA水平比较 见表2。两组患者治疗后血清TAC水平均显著升高(均P<0.05),同时MDA水平显著降低(均P<0.05)。谷胱甘肽组与对照组治疗前TAC水平及MDA水平差异无统计学意义(均P>0.05);谷胱甘肽组治疗后TAC水平显著升高(P<0.05),MDA水平显著降低(P<0.05)。
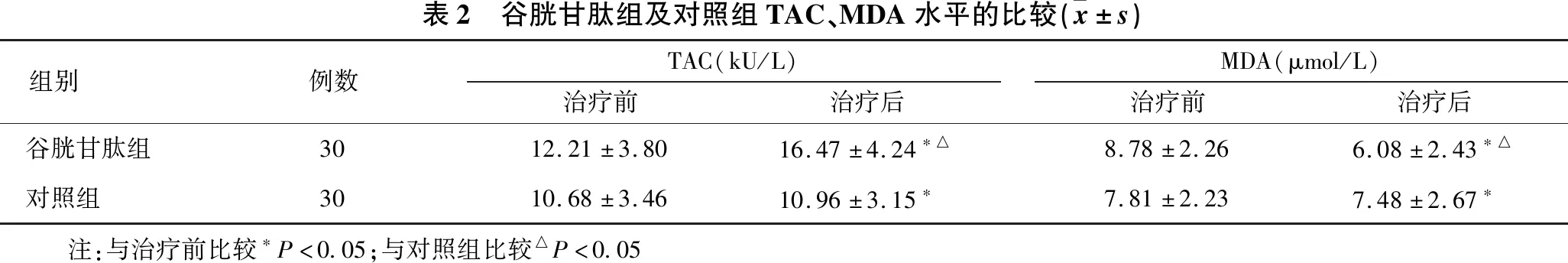
表2 谷胱甘肽组及对照组TAC、MDA水平的比较(x±s)组别例数TAC(kU/L)治疗前治疗后MDA(μmol/L)治疗前治疗后谷胱甘肽组3012.21±3.8016.47±4.24∗△8.78±2.266.08±2.43∗△对照组3010.68±3.4610.96±3.15∗7.81±2.237.48±2.67∗ 注:与治疗前比较∗P<0.05;与对照组比较△P<0.05
2.3 谷胱甘肽组及对照组24 h尿铜水平的比较 见表3。与治疗前比较,治疗后谷胱甘肽组及对照组24 h尿铜水平显著升高(均P<0.05)。谷胱甘肽组与对照组治疗前24 h尿铜差异无统计学意义(P>0.05),谷胱甘肽组治疗后24 h尿铜水平显著升高(P<0.05)。

表3 谷胱甘肽组及对照组24h尿铜水平的比较(x±s)组别例数治疗前治疗后谷胱甘肽组301289.63±721.681559.55±769.60∗△对照组301028.42±671.921297.14±706.98∗ 注:与治疗前比较∗P<0.05;与对照组比较△P<0.05
2.4 谷胱甘肽组及对照组ALT、AST水平的比较 见表4。与治疗前比较,治疗后两组ALT、AST水平显著降低(均P<0.05)。两组患者治疗前血清ALT、AST水平差异无统计学意义(均P>0.05);谷胱甘肽组治疗后ALT显著降低(P<0.05),AST水平差异无统计学意义(P>0.05)。

表4 谷胱甘肽组及对照组ALT、AST水平的比较(x±s)组别例数ALT(U/L)治疗前治疗后AST(U/L)治疗前治疗后谷胱甘肽组3023.87±12.3120.10±9.70∗△25.13±10.6622.97±8.58∗对照组3028.97±21.9230.20±23.58∗22.83±9.1221.33±8.63∗ 注:与治疗前比较∗P<0.05;与对照组比较△P<0.05
2.5 不良反应 在治疗过程中,谷胱甘肽组出现1例DMPS相关消化系统不良反应,主要表现为恶心,对症处理后改善;对照组出现3例DMPS药物过敏反应,表现为肢体局部皮疹伴瘙痒,给予抗过敏治疗后症状完全消失。
3 讨 论
谷胱甘肽是一种具有特殊生物学功能的三肽化合物,含有巯基、氨基、酰胺基等多种配位基团,可以直接与细胞内金属离子络合,特别是对巯基具有高亲和力的金属离子。谷胱甘肽易于与金属离子螯合,从而起到解毒作用[5]。有研究表明,谷胱甘肽可与金属离子结合形成无毒结合物排出体外,治疗砷、铅、锰等重金属中毒[5]。本研究也发现,给予还原型谷胱甘肽治疗后,谷胱甘肽组患者24 h尿铜较对照组显著增加。本研究中谷胱甘肽促铜排出机制可能与含巯基的二巯基丙磺酸钠、二巯基丁二酸等排铜药物类似,利用自身所含活性巯基在体内与铜离子结合形成络合物从而促进铜的排出。随着铜的排出,WD神经系统症状改善。本研究结果显示,谷胱甘肽组神经系统症状评分较对照组明显降低,提示还原型谷胱甘肽可改善WD患者的神经系统功能。同时,谷胱甘肽组WD患者经还原型谷胱甘肽治疗肝功能亦获得改善。
WD铜沉积所致机体组织损伤的发病机制十分复杂,其中氧化应激反应可能处于核心部分。研究表明,机体组织内过量的铜沉积可产生大量的自由基、活性氧,激发一系列“瀑布”反应,诱导持续的氧化应激反应,破坏线粒体的结构和完整性,进而导致神经细胞损伤或进行性神经系统的损害。近来研究发现,WD模型LEC大鼠纹状体及肝脏组织氧化应激水平明显活跃,且诱导Caspase-3促凋亡蛋白及神经、肝脏细胞凋亡明显增加[9]。近年,关于表现为神经系统症状的WD和氧化应激之间的相关性受到关注。Bruha等[10]发现,有神经系统症状的WD患者较肝型、无症状型患者的氧化应激水平显著升高。此外,Kalita等[11]发现,有神经系统症状的WD患者抗氧化应激水平较肝型、无症状型WD患者明显降低。不仅如此,WD患者神经系统症状恶化的同时,氧化应激活力增加,抗氧化应激水平下降[12];治疗好转的WD患者氧化应激活力下降,抗氧化应激水平增加[13]。谷胱甘肽是机体重要的抗氧化物质,可有效清除生物氧化产生的自由基,从而抑制氧化应激反应及由此引发的细胞损伤、凋亡等,进而改善神经系统症状[14]。MDA是生物膜中的一种脂质过氧化物,可反映机体氧自由基水平[15];TAC则是反映总抗氧化能力的一项指标[16]。本研究结果显示,在给予还原型谷胱甘肽治疗后,谷胱甘肽组TAC活性较对照组显著升高,而MDA活性较对照组显著下降,提示还原型谷胱甘肽可提高WD患者总抗氧化能力,减轻铜沉积所致氧化应激反应对WD患者的脑损害,从而改善WD患者的神经系统症状。
综上所述,还原型谷胱甘肽可增强排铜效果,提高机体抗氧化应激水平,改善神经系统症状,同时可改善其肝功能,且无明显不良反应。当然本研究亦存在一些局限,如病例数较少、观察时间较短等,在以后的进一步研究中本研究小组将采用更多的研究方法、加大相应的样本量及延长研究时间等。
