高通量测序分析酒糟鱼中微生物群落多样性
2020-09-11马肖肖赵利
马肖肖 赵利
1、江西科技师范大学生命科学学院
2、国家淡水鱼加工技术研发分中心
草鱼(Ctenopharyngodon idellus)是我国四大淡水家鱼之一,其肉质肥嫩、味鲜美,深受消费者喜爱,是一种营养价值较高的水产品。酒糟鱼是江西鄱阳湖地区的特色美食,产品选用活鲜草鱼,以精酿酒糟糟制,通过糟制可使鱼糟之间蛋白相互补进,鱼肉的营养成分发生变化,经过微生物的作用鲜味氨基酸含量增加,各项指标均高于WHO/FAO 提出的参考蛋白模式标准[1]。有研究表明,微生物在酒糟鱼糟制过程中发挥着极为重要的作用,影响着酒糟鱼风味物质的变化和形成。将传统分离方法与16S rRNA 分子鉴定技术相结合,对酒糟鱼糟制过程中微生物进行分析得出酒糟鱼的主要优势菌为乳酸杆菌和明串珠菌,但由于传统分离条件限制无法进行全面分析[2]。同时不同的糟制方式使酒糟鱼产生了不同的风味物质,其微生物群落结构也将随之发生变化。近年来,随着技术的发展,高通量测序技术应运而生,其无须进行微生物分离培养,不仅可以检出样品中微生物的菌种组成,还能确定其相对丰度[3]。因此,高通量测序技术已广泛应用于食品发酵、食品微生物检测等多方面[4-5]。
为了全面地研究酒糟鱼产品所含微生物种类情况,本实验以实验室自制酒糟鱼和市场酒糟鱼为研究对象,采用Illumina Miseq 高通量测序技术分析两种不同酒糟鱼样品中的菌群组成情况及优势菌种,分析其群落丰度和差异,为酒糟鱼发酵过程中微生物的影响作用提供部分依据。
1 材料与方法
1.1 材料与试剂
材料:酒糟鱼(200~250 g)。工厂直取腌制鱼块标号为A,以A 做发酵处理自制酒糟鱼标号为B,以A 做发酵处理工厂制作酒糟鱼标号为C,三种鱼均于同一时间段做处理。
试剂:实验中用到的主要试剂和耗材如表1 所示。

表1 主要试剂/ 耗材
1.2 仪器设备
表2 主要仪器设备
1.3 方法
1.3.1 样品的预处理
使用高温灭菌的剪刀或刀片将样品剪碎后混合均匀,取适量样品(不超过0.5 g)放入2 ml 样品管,在组织破碎仪中进行破碎后提取。
1.3.2 DNA 提取方法
按照Omega 公司细菌基因组DNA 提取试剂盒的方法操作,以OMEGA 试剂盒E.Z.N.ATMMag-Bind Soil DNA Kit 提取试剂盒提取样品总DNA,琼脂糖凝胶检测DNA 完整性,Qubit 定量检测DNA 样本浓度[6]。
1.3.3 PCR 扩增
利用Qubit3.0 DNA 检测试剂盒对基因组DNA 精确定量,确定加入的DNA 量,以提取的总细菌基因组DNA 为模板,引物针对16S rRNA 基因V3/V4 区,利用341F(CCTACGGGNGGCWGCAG)和805R(GACTACHVGGGTATCTAATCC)引物进行PCR 扩增。扩增后的PCR 产物进行2%琼脂糖凝胶电泳,经纯化后的样品进行定量检测[7]。将检测后的样品委托上海生工生物工程股份有限公司,进行高通量测序。
1.3.4 数据优化处理
Illumina MiseqtTM得到的原始图像数据文件经CASAVA 碱基识别分析转化为原始测序序列,由于Miseq 测序序列中含有barcode 序列,以及测序时加入的引物和接头序列。首先需要去除引物接头序列,再根据PE reads 之间的overlap 关系,将成对的reads 拼接(merge)成一条序列,然后按照barcode 标签序列识别并区分样品得到各样本数据,最后对各样本数据的质量进行质控过滤,得到各样本有效数据[8]。
基于操作分类单元(OTU)聚类分析结果,选择丰度最高的序列作为OTU 的代表性序列,进行各类的OTU 分析,通过Alpha 多样性分析微生物群落的丰度和多样性,绘制物种分类条形图和物种丰度热图[19]。最后,基于物种分类结果,比较样本菌种丰度存在显著差异的物种分类,筛选条件为P≤0.05,综合讨论酒糟鱼发酵产品中微生物群落的分布差异。
2 结果与分析
2.1 测序数据统计与OUT 分析
2.1.1 原始序列数据
图1 为原始序列使用pear 融合后的序列长度及该长度reads数目;图2 为质控(去除barcode、primer 以及部分低质量序列)后序列长度及该长度reads 数目。原始序列共163831 条有效序列,序列平均长度为453.40~465.52 bp,主要集中在461~480 bp 的区间长度内(图1)。QC 后的序列共160522 条有效序列,平均长度为414.92~427.81,主要集中在425~435 bp 的区间长度内。

图1 原始序列长度分布图
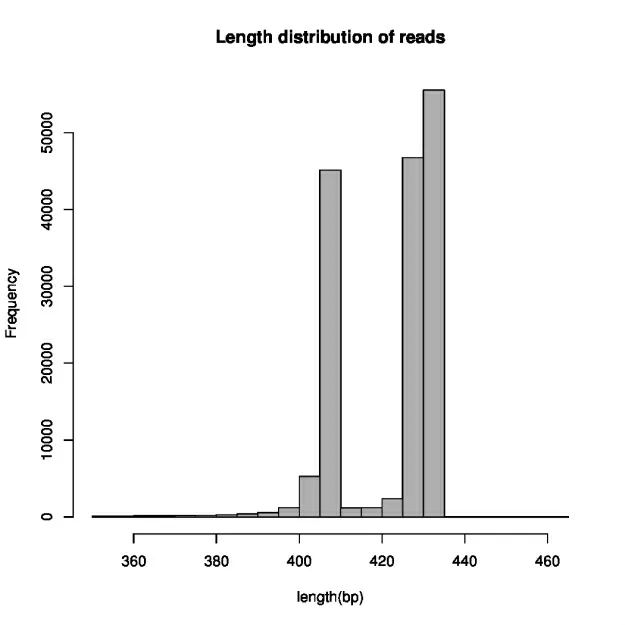
图2 质控后序列长度分布图
2.1.2 OUT 分析
OTU 样本分布韦恩图如图3 所示,不同颜色代表不同组,数字代表特异或共有的OTU 数。其中,B、C 两组的OUT 数量高于A 组,即发酵后的酒糟鱼产品样品中的微生物种类在不断增加;C 组OTU 数量高于B 组,说明市场酒糟鱼产品微生物数目略高于实验室自制酒糟鱼产品。三种产品的共有OTU 数目为77 个,这部分微生物保留在了发酵末期,是对酒糟鱼发酵益处较小的微生物;A、B 共有的66 个和A、C 共有的50 个OTU 数目则是由于酒糟鱼发酵方式不同导致的改变;B、C 两组发酵酒糟鱼共有OTU 数目为73,这些微生物对酒糟鱼发酵益处较大。
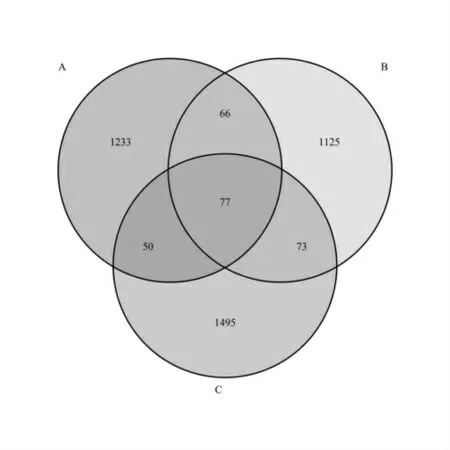
图3 OTU 样本分布韦恩图
2.2 Alpha 多样性分析
根据97%相似性水平下的OTU 信息,采用Alpha 多样性指标的Shannon、Simpson、ACE、Chao1 及Coverage 指数对样品微生物物种的丰富度和多样性进行评估,结果如表3 所示。A 组样品的ACE、Chao1、Shannon 指数均高于其他组,Simpson 指数均低于其他组,说明酒糟鱼原样群落分布丰度高于成品,证明了腌制后酒糟鱼菌群分布丰度高于酒糟鱼产品;但其菌群落分布多样性较低,证明了糟制可以有效提高微生物多样性如B 组的ACE、Chao1、Simpson 指数低于C 组,Shannon 指数大于C 组,说明实验室自制酒糟鱼菌群落分布丰度低于市场酒糟鱼,群落多样性大于市场酒糟鱼,多样性的菌种可以促进糟制过程中微生物作用的发挥。
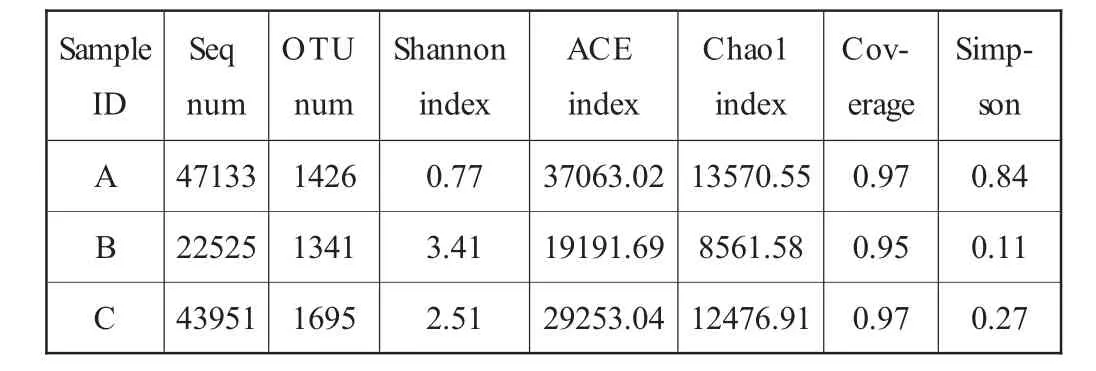
表3 Alpha 多样性分析表
图4 所示的稀疏曲线图中,以横坐标为随机取样抽取到的序列数,纵轴为其所代表的OTU 数目构建的稀释曲线反映了样品的丰富度和测序合理性。以shannon 曲线为例,A、B、C 三条曲线均在序列数20000 左右时趋于平稳,足以证明测序数据量合理,更多的数据量只会加入少量的OTU 数目。图5 所示的Rank-Abundance 曲线以OTU 等级为横坐标,以每个OTU 中所含的序列数的相对百分含量为纵坐标做图,反应了样品的丰富程度和均匀程度。由图可看出,A 组曲线较B、C 两组平坦,说明腌制鱼肉物种组成的均匀程度高于发酵酒糟鱼两组;而作为发酵酒糟鱼的B、C 两组物种组成均匀程度较为相似,贴近样品总体。
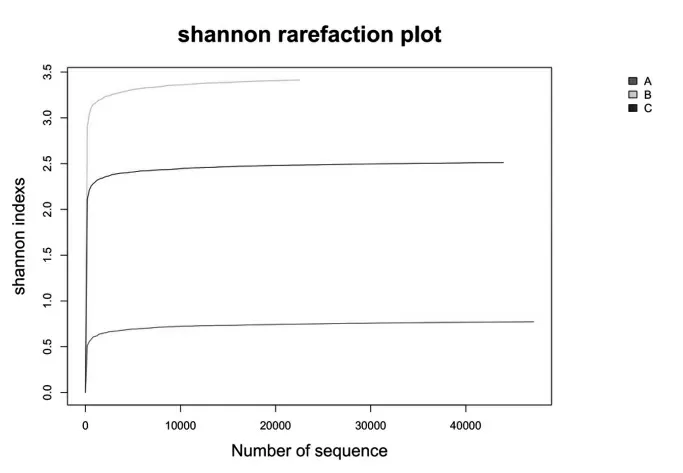
图4 Alpha 指数稀疏曲线图
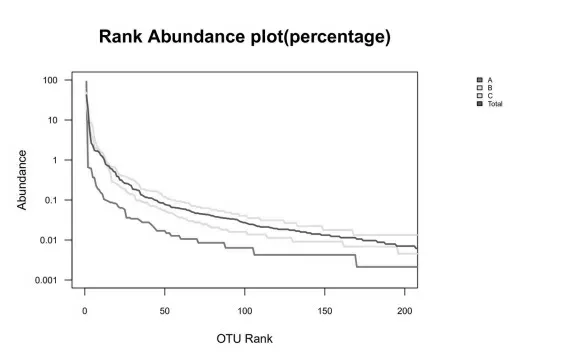
图5 Rank_Abundance 曲线图
2.3 不同酒糟鱼细菌群落结构分析
2.3.1 基于属水平的细菌菌群结构分析
三种酒糟鱼样本序列经分类分析,在属水平上,其相对丰度排行前50 的菌群柱状分布图如图6 所示,丰度较少统一作other,图中横轴为各样品的编号,纵轴为相对丰度比例,在属水平上,酒糟鱼产品共分离得到了434 属。
A 组腌制鱼肉中魏斯氏菌属(Weissella)所占的比例较大,余下依次为不动细菌属(Acinetobacter) 和假单胞菌属(Pseudomonas)。研究表明,肉制品中的魏斯氏菌能够发酵葡萄糖、甘露糖、麦芽糖等产生D 乳酸或DL- 乳酸。B 组酒糟鱼总细菌组成主要以乳酸杆菌属(Lactobacillus) 为主,相对丰度37.03%,余下为布丘氏菌属(Buttiauxella)、小球菌属(Pediococcus)、弧菌属(Vibrio)、假单胞菌属(Pseudomonas)、盐水弧菌属(Salinivibrio)、葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)等。C 组酒糟鱼总细菌组成同样以乳酸杆菌属为主,相对丰度50.81%,余下为魏斯氏菌属(Weissella)、嗜冷杆菌属(Psychrobacter)、 嗜 冻 菌 属(Peptoniphilus)、 漫 游 球 菌 属(Vagococcus)、葡萄球菌属、盐水弧菌属、狭义梭菌属(Clostridium sensu stricto)、 梭 菌 属 (Fusobacterium)、 消 化 链 球 菌(Peptostreptococcus)、摩根氏菌属(Morganella)和其他属类。总体来看,发酵产生了更多菌种,且在丰度大于1%的菌种中,B 组少于C 组;在B、C 两组中,乳酸杆菌属可发酵葡萄糖并产生大量乳酸,是动物和人肠道等处重要的生理性菌群之一,同时也是常用的工业微生物菌种;小球菌属中的乳酸小球菌(P.acidilactici)为同型发酵性乳酸细菌。
2.3.2 物种丰度热图
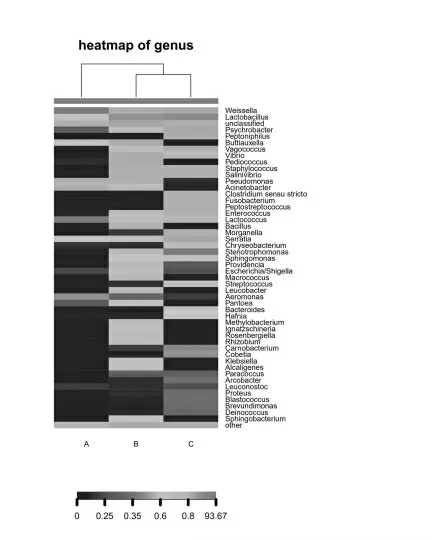
图7 菌属水平所有样本物种丰度热图
将样品以及菌群落分布信息进行聚类并重新排布,将聚类之后的结果显示在heatmap 中,可以很好地反映各分类水平上群落分布组成的异同。图7 所示的物种丰度热图为丰度最高的前50 个物种分类信息。由图中可以看出,B、C 两组在图上方聚类树中的位置靠近,说明两组发酵酒糟鱼中菌群分布最为类似。
在A 组腌制鱼中,魏斯氏菌属呈红色,是主要组成部分,对比B、C 两组显示,魏斯氏菌属和不动杆菌属(Acinetobacter)呈黄色,说明发酵抑制了两组菌属;而在B、C 两组发酵酒糟鱼中,乳酸杆菌始终占据优势,对比A 组蓝色部分,Vagococcus、Vibrio、Staphylococcus、Salinivibrio、Enterococcus、Lactococcus 等菌属呈现黄色及以上,说明其为发酵过程中的优势菌属。
此外还可以明显看出在两种酒糟鱼样品中,各有自己独特的微生物菌群,如B 组的Pediococcus 和Bacillus,C 组的Peptoniphilus。
2.4 菌群丰度差异分析
为了得出B、C 两组菌群丰度的差异,对B 组和C 组做差异分析。图8 所示为两种发酵酒糟鱼中的丰度比例,中间所示为95%置信度区间内,物种分类丰度的差异比例,图中p 值<0.05,表示各菌群丰度均差异显著。
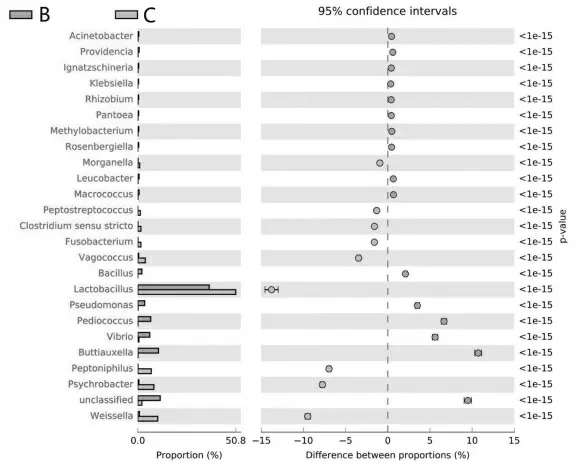
图8 B、C 两组样本差异比较误差异图
由图8 可看出,在25 种分类中,B 组的差异性菌群有16种,Buttiauxella、Pediococcus、Vibrio、Bacilus 差异较大;C 组的差异 性 菌 群 有 9 种,Weisselllaa、Psychrobacter、Peptoniphilus、Vagococcus 差异较大。
3 结论与讨论
本研究采用Illumina Miseq 高通量测序技术分析两种不同酒糟鱼样品中菌群组成及变化情况。结果表明:发酵可以有效提高酒糟鱼微生物群落分布多样性,实验室自制酒糟鱼菌种丰度低于市场酒糟鱼,菌种多样性和菌群丰度差异项高于市场酒糟鱼。两种酒糟鱼菌群结构存在差异,在属水平上,实验室自制酒糟鱼样品中微生物主要以乳酸杆菌属、布丘氏菌属,小球菌属,弧菌属假单胞菌属等为主;而市场上酒糟鱼样品中微生物菌属以乳酸杆菌属、魏斯氏菌属,嗜冷杆菌属,嗜冻菌属等为主。相对于传统的分离鉴定方法,高通量测序技术在检测优势菌时更具优势,两种酒糟鱼样品都以乳酸杆菌为主要优势菌种,其他优势菌种包括漫游球菌属、葡萄球菌属等6 种,对酒糟鱼发酵过程影响显著。同时不同发酵方式导致了两种酒糟鱼各有其特殊菌种,实验室自制酒糟鱼以Buttiauxella、Pediococcus、Vibrio、Bacilus 等菌属为主,市场酒糟鱼以Weisselllaa、Psychrobacter、Peptoniphilus、Vagococcus 等菌属为主。
高通量测序技术检测不仅可以快速检测微生物种类,对比不同发酵方式下酒糟鱼的优势菌和特殊菌,优化酒糟鱼发酵工艺,还可以检测酒糟鱼发酵过程中微生物多样性和丰富性,为酒糟鱼成品的保藏提供一定的参考依据。
