小麦、玉米两熟区小麦纹枯病菌群体组成及其农田分布特征
2020-09-11赵绪生齐永志甄文超
赵绪生,齐永志,2,甄文超
(1河北农业大学植物保护学院,河北保定 071001;2省部共建华北作物改良与调控国家重点实验室,河北保定 071001;3河北农业大学农学院,河北保定 071001;4河北省作物生长调控重点实验室,河北保定 071001)
0 引言
【研究意义】由禾谷丝核菌(Rhizoctonia cerealis)或立枯丝核菌(Rhizoctonia solani)引起的小麦纹枯病(wheat sharp eyespot,WSE)是一种世界性土传病害,20世纪80年代初在北美洲和欧洲小麦产区严重发生[1]。进入21世纪以来,随着气候变暖、秸秆还田以及氮肥用量提高,加之小麦纹枯病抗性品种匮乏,造成该病害已成为中国黄淮海小麦、玉米两熟区的小麦主要病害,严重影响了小麦的优质高产[2]。据统计,近十年来,小麦纹枯病在河北、河南和山东等省麦区每年发生总面积高达420万公顷以上,一般发病地块减产5%—30%,严重地块减产超过50%[3-5]。自2012年,小麦纹枯病成为河北省仅次于白粉病的第二大病害[4]。调查河北、山东、河南麦区纹枯病发生程度,探析3省不同生态类型区小麦纹枯病菌的群体差异及优势病原菌在小麦-玉米秸秆还田种植体系中的分布特征,对该病害的科学防控具有重要意义。【前人研究进展】已有研究表明,中国小麦纹枯病菌的优势菌群多为禾谷丝核菌,其中,以CAG1(AG-D)、CAG-3、CAG-6、AGC1菌丝融合群为主[6-11]。李海燕等[3]研究发现,2014年采自河北省3个不同生态类型麦区的196株纹枯病菌包括 AG-D、AG-B (0)、AG-I、AG-5和AG-4 5种融合群,且以强致病力AG-D融合群为主;汪敏等[12]研究表明,2011年采自河南周口等13个地区的157株纹枯病菌包括156株双核丝核菌AG-D融合群和1株双核丝核菌为AG-B (0)融合群;于金凤等[13]研究发现,2002年采自山东麦区的55株纹枯病菌中有54株为双核丝核菌AG-D融合群。汪敏等[12]根据标准菌株致病力强弱,将采自河南省13个麦区的119株菌株划分为强、中等和弱致病力3种类型;李海燕等[3]根据196株分离所得菌株及6株标准致病力菌株接种3个小麦品种后的平均病情指数,可将202株菌株划分为极强、强、中等和弱4种致病力类型;杜文珍[14]从江苏等5省麦区分离鉴定的237株双核丝核菌株中,强致病力和弱致病力菌株数仅分别为 46株和30株;陈莹等[15]明确了中国北纬33°地区小麦纹枯病菌约96%菌株均属于强致病力AG-D融合群,但不同地区菌株间的致病力均无显著差异。【本研究切入点】受长期少免耕和秸秆还田、小麦种子异地调运以及农机跨区作业等影响,当前河北、山东、河南麦区小麦纹枯病的病原菌群体组成、致病力差异需要系统调查;同时,小麦纹枯病菌强致病力优势菌群在中国北方小麦、玉米两熟区农田中的分布特征也未见报道。【拟解决的关键问题】调查河北、山东、河南 3省小麦、玉米两熟区小麦纹枯病的发生程度,通过细胞核染色、菌丝融合反应和rDNA-ITS序列分析鉴定病原菌群体特征,分析优势病原菌禾谷丝核菌的菌株间致病力差异及其在小麦、玉米两熟秸秆还田种植体系中的分布特征。
1 材料与方法
1.1 材料
小麦品种:石新 828(冀审麦 2005004)、济麦22(国审麦2006018)、周麦22(国审麦2007007),均为河北、山东、河南麦区种植的小麦主推品种,对小麦纹枯病抗性表现分别为高感、中感和感病。
小麦纹枯病菌菌丝融合群标准菌株:AG-D(CAG1)、AG-E、AG-B (0)和AG-Ba为禾谷丝核菌;AG-5和AG-2为立枯丝核菌,由河北省农林科学院植物保护研究所孔令晓研究员提供。
禾谷丝核菌致病力标准菌株:R0301、C16、R8433为强致病力菌株,R8401为中致病力菌株,R8406、D32为弱致病力菌株,由江苏省农业科学院陈怀谷研究员提供。
1.2 方法
1.2.1 小麦纹枯病样品采集与病害调查 2017—2018年,在小麦拔节至孕穗期,选取河北(黑龙港平原、山前平原和冀东平原)[3]、山东(山东半岛、中部、西北部和西南部)[16]、河南(南部、北部、中南部和中北部)[17]11个不同生态类型麦区72个采样点(秸秆还田均15年以上)为检测点,每检测点随机选5块样田(约90 m2/块),采用5点取样法,每点从1.1 m双行中选30个茎,按照小麦纹枯病成株期分级标准调查小麦纹枯病发病情况,计算病情指数;同时,采集小麦纹枯病组织样品,低温保存带回实验室。小麦纹枯病成株期分级标准:0级:无症状;1级:叶鞘有病斑,但未侵入茎秆;3级:病菌侵入小麦茎秆,病斑宽度环绕茎秆长度未长于茎秆周长1/2;5级:病斑环绕小麦茎秆长度达周长 1/2—3/4;7级:病斑环绕小麦茎秆周长3/4以上;9级:形成小麦枯孕穗或白穗[9]。
1.2.2 小麦纹枯病菌分离与鉴定 小麦纹枯病病原菌分离纯化与初步鉴定:无菌条件下剪取样品病健交界处组织块(2.0 mm×2.0 mm),表面消毒后转移至含链霉素和利福平的PDA培养基,25℃黑暗培养5 d后单菌丝顶端分离、纯化、保存,根据病菌形态学特征进行初步鉴定。
供试菌株与融合群标准菌株的融合情况[18]:采用对峙培养法判定,将供试菌株与标准菌株同时打取菌饼后,接种于载玻片上,25℃黑暗保湿对峙培养(相距2 cm)。每菌株3次重复,每皿1个菌饼。当菌丝生长至相互接触时,用番红O-KOH染色液染色5 min后,盖上盖玻片在显微镜下观察菌丝细胞的融合情况和细胞核数目。
小麦纹枯病病原菌分子鉴定[19]:采用CTAB法提取菌株基因组DNA,采用真菌rDNA-ITS PCR扩增通用引物 ITS1(5′-TCCGTAGGTGAACCTGCG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增待测菌株DNA序列片段。PCR扩增产物测序后,在NCBI中进行BLAST序列比对。
1.2.3 小麦纹枯病菌致病力测定 接菌体的制备:先于PDA培养基上活化不同生态类型区选出的120个供试禾谷丝核菌菌株(随机选40株/区)和6个标准致病力菌株,然后将10个直径5 mm纹枯病菌菌饼接种至含有80 g无菌麦粒的200 mL三角瓶中,25℃黑暗培养。培养期间每2 d摇匀1次,每供试菌株接种3瓶。40 d后得麦粒接菌体,直接粉碎后过20目筛,备用。
菌株致病力测定:小麦种子经1% HgCl2表面消毒5 min后[20],用无菌水冲洗3次,置于铺有3层湿润纱布的培养皿中,28℃黑暗保湿催芽,露白后播入装有0.5 kg灭菌土(121℃,间歇湿热灭菌3次,每次45 min,间隔时间3.5 h)直径为12 cm的营养钵中,每钵20粒;种子周围匀撒0.8 g接种体,表面覆盖3 cm厚灭菌土。以未接菌粉碎麦粒为对照。每供试菌株接种3个小麦品种,每品种3次重复,每重复6钵。25℃、14 h﹕10 h(光﹕暗)条件下培养,30 d后,参考汪敏等[12]的小麦幼苗分级标准调查发病情况:0级:无症状;1级:外层叶鞘变褐或有明显的纹枯病斑,但病斑直径小于叶鞘周长的1/2;3级:外层叶鞘有明显的纹枯病斑,病斑直径大于叶鞘周长的1/2,但内层叶鞘无症状;5级:内层叶鞘变褐或有明显的纹枯病斑,但病斑直径小于叶鞘周长的1/2;7 级:内层叶鞘有明显的纹枯病斑,病斑直径大于叶鞘周长的1/2,但植株不死苗:9级:植株死苗。
1.2.4 小麦、玉米两熟秸秆还田种植体系中禾谷丝核菌的检测 试验田基本情况:2017年10月至2018年10月,选择河北省保定市望都县河北农业大学实验基地(小麦品种为良星99)、山东省德州市乐陵市辛庄村(小麦品种为济麦22)、河南省洛阳市偃师市庞村(小麦品种为周麦22)作为检测点,各点均采用小麦、玉米两熟种植制度,已连续17年秸秆全量还田,小麦纹枯病历年发病率≥50%。每个试验基地均为沙壤土,肥力中等。0—20 cm耕层土壤pH 7.0。按常规生产方法进行栽培管理。
小麦、玉米生长季取样:(1)植株组织。采用随机5点取样法采样,在小麦三叶期、分蘖期、越冬期、返青期、起身期、拔节期、抽穗期,每点各取10株;在玉米三叶期、拔节期、大喇叭口期、抽雄期、乳熟期,每点各取3株;小麦、玉米整株样品(地上部和0—20 cm根系)置于低温冰盒中带回实验室,并于-20℃保存;(2)根际土壤。分别在小麦、玉米关键生育期(同1)采集根际土壤样品,采用大田挖掘法5点取样[21],每点选择连续10株小麦、3株玉米,挖取0—40 cm土层的根系,轻轻抖去根系上脱落的土壤,保留附着于根的根际土壤,并及时放入无菌袋中混匀后,置于低温冰盒中带回实验室,于-20℃保存,用于禾谷丝核菌的定量测定。
植株组织和土壤样品中禾谷丝核菌实时荧光定量PCR检测:植物组织整株样品经粉碎后,分别用土壤和植物组织DNA提取试剂盒(型号分别为DP305和DP336,天根生化科技有限公司)提取禾谷丝核菌DNA,每份(1.0 g)土壤、组织样品分别提取份3份,提取方法按说明要求并稍作调整。禾谷丝核菌特异性引物为 RtubF4(5′-CCTAAATGAGTCTGGAGTAAGT C-3′)和 RtubR4(5′-GCTAGTGCGGTCAATGTATA G-3′)[22],由上海生工生物工程有限公司合成。荧光定量 PCR 体系(20 μL):SYBR Premix Ex TapTM(2×)10 μL,上游引物(10 μmol·L-1)0.4 μL,下游引物(10 μmol·L-1)0.4 μL,ROX reference dye(50×)0.4 μL,DNA模板2.0 μL,ddH2O 6.8 μL。荧光定量检测使用美国应用公司ABI StepOne荧光定量PCR仪,扩增程序[23]:95℃预变性 30 s,95℃变性 5 s,60℃退火 30 s,40个循环,熔解曲线分析:95℃ 0 s,60℃ 1 min,然后以 0.3℃·s-1升至 95℃。以禾谷丝核菌 BD-14的DNA 为标准品进行梯度稀释(1.0×10-6—1.0×102ng·μL-1),经荧光定量检测后,以 DNA 起始浓度的对数值为x轴,以Ct值为y轴构建标准曲线。以梯度稀释的土壤和组织样品的 DNA为模板,进行扩增检测,根据标准曲线,得到待测样品Ct值,即可获得对应DNA样品的浓度值。
1.2.5 数据统计与分析 根据所测定数据,对比分析11个不同生态类型麦区小麦纹枯病发生程度差异、纹枯病菌致病力差异及优势病原菌禾谷丝核菌在小麦-玉米秸秆还田种植体系的农田分布特征。用 Excel 2010和DPS 7.0软件对试验数据进行统计分析,采用Duncan’s新复极差法比较菌株致病力差异,采用非加权配对算术平均法对病菌致病力进行聚类分析[20]。
2 结果
2.1 河北、山东和河南不同生态类型区小麦纹枯病发病程度
由表1可知,2017—2018年3省11个生态类型区小麦纹枯病均有发生。省际间比较,发病程度由重到轻依次为河南、山东和河北。河南4个生态类型区小麦纹枯病发病率均在38.7%以上,各区差异不显著,但北部麦区病情指数显著低于南部、中南部;山东西南部麦区纹枯病发病率为38.1%,显著高于山东半岛、西北部,但该区病情指数与山东半岛麦区无显著差异;河北省黑龙港平原麦区纹枯病发病最重,发病率和病情指数分别为32.7%和10.8,均显著高于山前平原和冀东平原。
2.2 不同生态类型区小麦纹枯病菌菌丝融合群种群分布
从11个不同生态类型麦区72个采样点采集的小麦纹枯病株中,分离、纯化出445个菌株,其中河北、山东、河南麦区分别为179、149和117株。通过番红 O-KOH染色、菌丝融合和分子鉴定(相似性比对均在98%—100%),表明这些分离物分别属于具有双核的禾谷丝核菌(421个)和多核的立枯丝核菌(24个),分别占分离总数的 94.61%和5.39%,菌株菌丝融合群分属AG-D、AG-B (0)、AG-2和AG-5 4个融合群(表2、图1),各融合菌群菌株数量分别为409、12、17和7株,占比91.91%、2.70%、3.82%和1.57%。
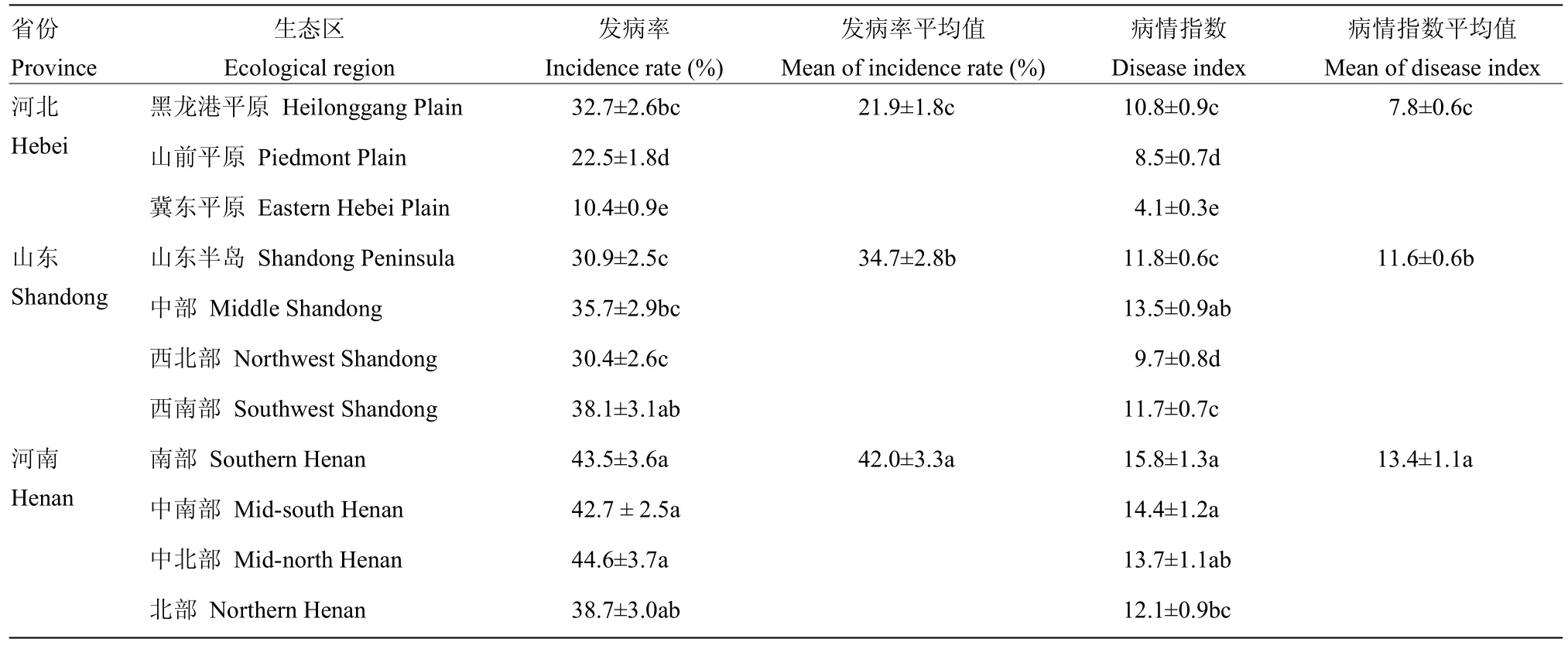
表1 不同生态类型区小麦纹枯病的发生程度Table 1 Incidences of wheat sharp eyespot in different ecological regions
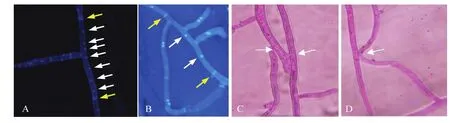
图1 小麦纹枯病菌菌核数量及菌丝融合反应类型Fig.1 Number of nucleolus and types of hyphal anastomosis reaction of Rhizoctonia strains on wheat
2.3 不同生态类型区禾谷丝核菌致病力差异
对120个禾谷丝核菌菌株在3个小麦品种上进行了致病力测定,结果表明采自河北麦区的禾谷丝核菌对石新828和济麦22的致病力无显著差异,但显著强于在周麦22上的致病力;接种采自山东麦区的禾谷丝核菌后,石新828的病情指数显著高于另外2个供试品种;采自河南麦区的菌株对3个小麦品种致病力由强到弱依次是石新828、济麦22和周麦22(表3)。综合对比,采自河南的禾谷丝核菌致病力显著强于山东和河北麦区,河北麦区菌株致病力最弱。
2.4 不同生态类型区禾谷丝核菌致病力区域特征
对120个禾谷丝核菌菌株和6株致病力标准菌株在石新828、济麦22和周麦22 3个小麦品种上的致病力进行了聚类分析,结果表明(图2),河北、山东、河南麦区禾谷丝核菌致病力由强到弱依次可划分为VT1、VT2、VT3、VT4和 VT5 5个致病力类型(d=2.37),平均病情指数分别为44.0、39.4、34.2、29.6和27.2;各类型中供试病原菌菌株数分别有7、50、41、18和4株。
最强致病力VT1类型中仅有山东西南部3个菌株和河南南部4个菌株;VT2类型中包括河南28个(南部、中南部和中北部分别8、11、9个)、山东12个(中部、西南部各6个)和河北10个(黑龙港平原、山前平原分别8、2个);VT3类型中包括河南12个(北部、中北部分别为9、3个),山东10个(中部、西北部各5株),河北19个(黑龙港平原、山前平原、冀东平原分别3、10、6个);VT4类型中包括河南2个(北部)、山东12个(西北部、山东半岛分别10、2个)、河北4株(冀东平原);VT5类型中仅包括山东4个(西北部)。

表2 不同生态类型区445株小麦纹枯病菌分布及其细胞核数量Table 2 Nucleolus number and distribution of 445 Rhizoctonia strains on wheat in different ecological regions

图2 随机选取不同生态类型区55株禾谷丝核菌对石新828、济麦22和周麦22致病力聚类分析Fig.2 Clustering analysis of the pathogenicity of 55 R. cerealis strains collected from 11 ecological regions to Shixin 828, Jimai 22 and Zhoumai 22
2.5 小麦、玉米两熟秸秆还田种植体系中禾谷丝核菌的分布特征
河北、山东和河南小麦、玉米两熟秸秆还田种植体系中,小麦季禾谷丝核菌在地上部组织、根系和根际土壤中的分布差异较大(图3-A)。随着生育进程,小麦地上部组织和根系中的禾谷丝核菌 DNA含量均呈先升高、后降低的趋势。地上部植物组织中病原菌菌量在起身期含量最高,达3 774.6 ng DNA/g鲜组织;与三叶期相比,分蘖期菌量增长幅度最高,为 28.17倍,其次是起身期。根系中的含菌量在拔节期最高,为193.1 ng DNA/g鲜组织;与三叶期相比,其分蘖期含菌量增长幅度也最高,达17.26倍。而3省根际土壤中的平均菌量呈逐渐升高的趋势,在抽穗期最高达309.0 ng DNA/g干土。
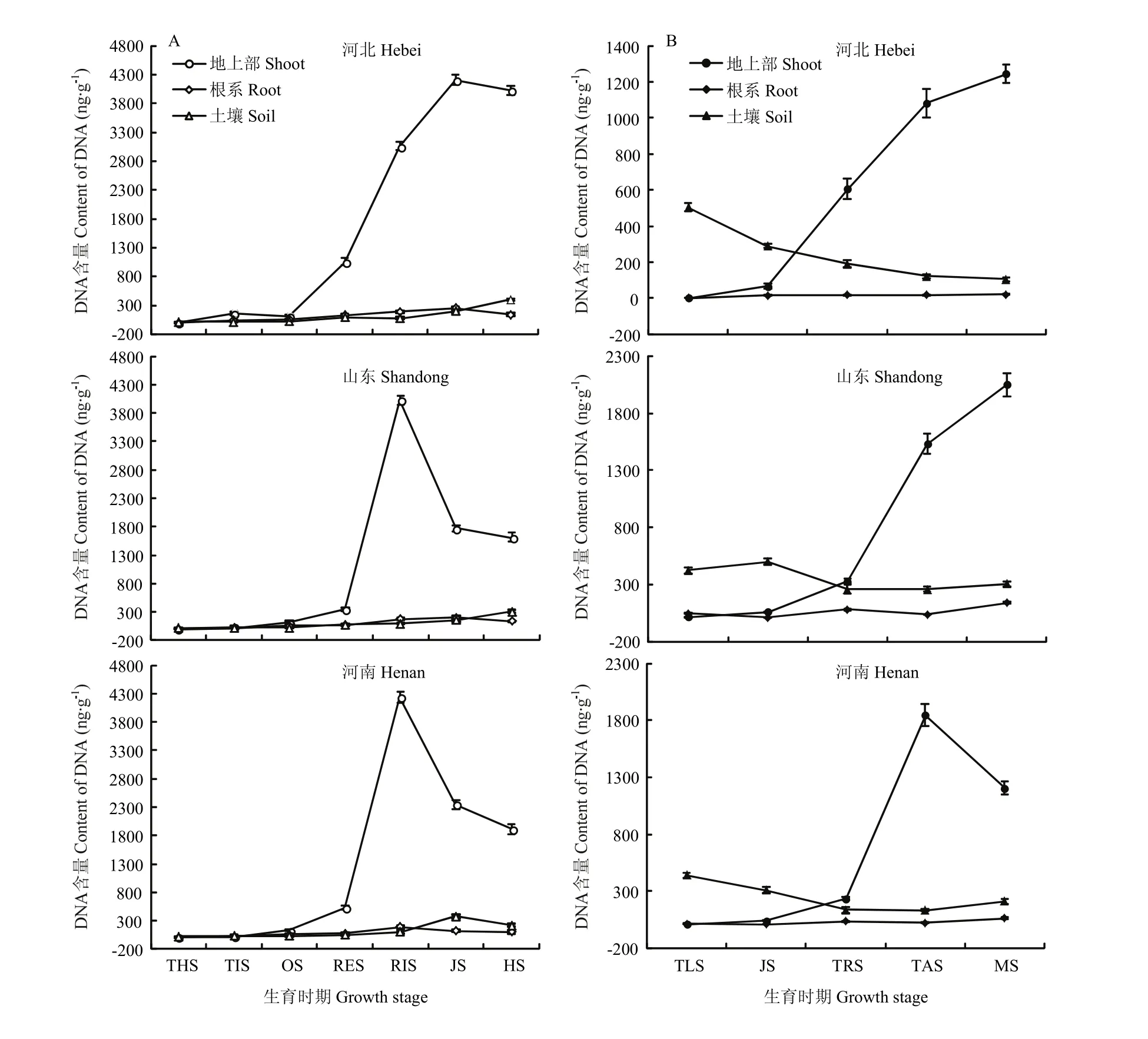
图3 小麦、玉米两熟区小麦季(A)和玉米季(B)禾谷丝核菌农田分布特征Fig.3 Distribution characteristics of R.cerealis in wheat (A) and maize (B) double cropping system

表3 不同生态类型区120株禾谷丝核菌对3个小麦品种的致病力Table 3 Pathogenicity of 120 R. cerealis strains collected from the different ecological regions on three wheat cultivars
图3-B为玉米季禾谷丝核菌在地上部组织、根系和根际土壤中的分布情况。随着生育进程,玉米地上部组织中禾谷丝核菌 DNA含量逐渐升高,河北、山东乳熟期达到最高,分别为1 245.4、2 047.6 ng DNA/g鲜组织,河南在抽雄期达最高,为1 846.3 ng DNA/g鲜组织;与三叶期相比,拔节期和大喇叭口期菌量增长倍率均在6.0倍以上。根系中的菌量在玉米季变化幅度较小,在10.5—73.7 ng DNA/g鲜组织。根际土壤中的菌量基本呈现降低趋势,抽雄期最低为170.6 ng DNA/g干土,乳熟期略有增长。
3 讨论
从河北、山东和河南小麦、玉米两熟秸秆还田的11个不同生态类型区分离获得的445株小麦纹枯病菌中,强致病力 AG-D(CAG1)融合群占 91.91%。此结果与已有报道基本一致,如 2011年,汪敏等[12]发现河南麦区纹枯病菌AG-D融合群占比高达99.36%;李海燕等[3]研究证明,双核丝核菌占河北省小麦纹枯病菌群体的89.8%,AG-D和AG-B (0)各占88.3%和1.5%,另外,还鉴定出部分AG-I、AG-4融合群;而李永娟等[24]从河北麦区分离的小麦纹枯病病菌仅包括双核禾谷丝核菌AG-D融合群;于金凤等[13]分离的55株山东小麦纹枯病菌中 AG-D融合群占比高达98.2%。本研究中未检测到已报道过的部分多核丝核菌(AG-4融合群),究其原因可能是样本采集样点或样品数量不同所致;亦有可能是病菌在适应小麦、玉米长期秸秆还田耕作条件过程中,病菌群体构成发生了微小变化。经SPSS统计软件K-S检验发现,随机选定河北、山东和河南不同生态类型麦区120株禾谷丝核菌的致病力强弱参数(3个小麦品种平均病情指数)的均值、标准差、Z值分别为36.3、3.97、0.623,P值(sig 2-tailed)=0.832>0.05,数据呈正态分布,基本可代表河北、山东、河南麦区禾谷丝核菌的整体特征。石新828、济麦22和周麦22对纹枯病的抗性分别表现为高感、中感和感病。但接种河北麦区禾谷丝核菌后,石新828与济麦22病情指数差异不明显;接种山东麦区禾谷丝核菌后,济麦22和周麦22病情指数差异也不明显。上述结果可能是因不同小麦品种纹枯病的室内抗性与田间抗性表现略有差异所致。
在不同致病力类型群体中,较强致病力VT1、VT2类型中河南、山东和河北麦区分别有32、15和10株,中间致病力VT3、VT4类型中河南、山东和河北麦区分别有14、22和23株,而弱致病力类型中仅包括山东地区4株。由菌株群体致病力聚类分析发现,河南麦区禾谷丝核菌群体致病力明显强于山东麦区和河北麦区,强致病力菌株数量也较多。河南麦区该类强致病力菌株数量多以及小麦纹枯病抗性品种的匮乏,可能是该区纹枯病发生较重的主要原因。接种山东半岛、山东西北部麦区菌株后3个小麦品种平均病情指数均显著低于接种西南部麦区菌株病情指数;采自河北麦区菌株平均致病力由强到弱为黑龙港麦区>山前平原>冀东平原麦区。因此,导致山东西南部麦区纹枯病发生程度明显重于山东半岛、西北部麦区,河北黑龙港麦区发生程度明显重于山前平原、冀东平原麦区的主要原因可能是各区菌株致病力差异所致。此外,河南、山东和河北各生态类型区禾谷丝核菌或立枯丝核菌菌株之间的遗传多样性也需要进一步研究。
作物病害的发生程度与病原菌致病力强弱、环境中的菌量及增殖速度紧密相关。研究致病菌在农田中分布特征,对探明土传病菌致病机理及制定科学防控措施具有重要作用[25-26]。王建明等研究发现,尖镰孢(Fusarium oxysporum)菌丝在西瓜和棉花地上部植株体内的相对含量和枯萎病发病程度呈显著正相关[27-28]。本研究通过对河北、山东和河南麦区定位检测发现,从三叶期至分蘖期,小麦植株体内禾谷丝核菌菌量增幅近30倍,在全生育期中增速最快;根系中菌量增幅度也高达17倍。本研究室前期研究发现,冬小麦、夏玉米一年两熟秸秆还田土壤中含有机酸、酯、烃、酰胺及醛类等化学物质,有机酸类物质相对含量最高,达29.98%;且其中的3-(4-羟基-3-甲氧基苯基)-2-丙烯酸和4-甲氧基邻氨基苯甲酸对禾谷丝核菌菌丝生长和菌核形成均具有显著促进作用[29]。因此,从三叶期至分蘖期禾谷丝核菌增速较快的原因可能与玉米秸秆腐解物中的酸类物质密切相关。对于生产中有纹枯病发病史的麦区,在分蘖期就应加强纹枯病监测和防控;其次,还田秸秆作为主要病残体始终存在于小麦、玉米两熟周年种植体系中,所以田间麦玉秸秆粉碎还田时也应该注重化学或生防药剂处理。在起身期至抽穗期,小麦植株体内的禾谷丝核菌含量呈明显下降趋势,可能是由于该阶段小麦植株生物量增速加快或茎秆硬度增强影响了病菌在植株体内扩展。玉米全生育期植株体内菌量相对较低可能主要因为是禾谷丝核菌对玉米的侵染力较弱造成的。
4 结论
河南麦区纹枯病发生程度最重,山东麦区次之,河北麦区最轻。强致病力双核禾谷丝核菌为3省优势病原菌。采自河南麦区菌株整体致病力最强,河北麦区最弱。禾谷丝核菌菌量在小麦三叶期至分蘖期增速最快,在小麦秸秆中相对含量最高、玉米秸秆中最低。生产中可有针对性的在还田秸秆粉碎过程中与冬前小麦幼苗期加强纹枯病的监测与防控。
