黄曲霉快速分子检测方法的建立
2020-09-10薛健
薛健

摘 要:本研究以黄曲霉菌的黄曲霉毒素合成基因簇中的关键调节基因蛋白活化基因afl-2为靶基因,使用溶菌酶-CTAB法提取黄曲霉菌的基因组,采用PCR方法对黄曲霉菌以及其他真菌进行检测研究。结果分析表明,本研究建立的溶菌酶-CTAB-PCR检测方法快速、准确,灵敏度达达到1050pg。该方法稳定可靠,可为控制黄曲霉菌的污染、保障人畜健康提供一定的技术支持。
关键词:黄曲霉;快速检测;PCR
1 前言
黄曲霉(Aspergillus flavus),它是一種常见的腐生真菌,多见于发霉的粮食、粮制品及其它霉腐有机物上。且它代谢产生的黄曲霉毒素是一种剧毒物质,它的毒性是氰化钾的10倍,砒霜的68倍。被世界卫生组织划定为I类致癌物[1]。据统计每年有近1/4的农作物受到真菌毒素的污染,其中最主要的污染源就是黄曲霉毒素[2]。而黄曲霉毒素的主要产生菌之一就是黄曲霉,能够广泛的污染花生、玉米、水稻、坚果等农作物及其制品[3]。因此,能否及时的防控黄曲霉毒素的危害,首要任务就是能否快速准确的检测出产品是否被黄曲霉等产黄曲霉毒素真菌污染。
目前国内外研究的焦点主要集中在黄曲霉毒素的检测方法,而对黄曲霉菌株的检测报道较少,传统的病原菌检测方法费时、费力,而且容易出现假阳性。黄曲霉细胞含有细胞壁,传统CTAB法提取基因组不容易破壁。因此,建立一种快速、灵敏、准确的黄曲霉分子检测技术不仅非常必要,而且十分迫切。本研究以改良CTAB-溶菌酶法提取黄曲霉菌基因组DNA,使用PCR技术扩增黄曲霉毒素合成途径的关键基因afl-2,建立一种快速、准确的黄曲霉菌检测方法,可为控制黄曲霉菌的污染、保障人畜健康提供一定的技术支持。
2 材料与方法
2.1 材料与仪器
2.1.1 实验菌株
本研究中使用的黑曲霉、米曲霉、红曲霉、寄生曲霉、黄曲霉菌株均由吉林农业科技学院生物与制药工程学院实验室保藏。
2.1.2 主要试剂
NaOH、HCl、氯仿、异戊醇、EDTA和Tris、CTAB、氯化钠、异丙醇均为国产分析纯。Taq DNA聚合酶、溶菌酶、dNTPs、10*PCR buffer、DL2000 DNA Marker购于上海生物工程有限公司。
2.1.3 仪器与设备
SW-CJ-10型超净台:伯乐 C1000TM型PCR仪;DYY-8C琼脂糖凝胶电泳仪;Universal Hood Ⅱ型凝胶成像仪。
2.2 实验方法
2.2.1 液体培养基配制
琼脂1.5%、硝酸钠0.3%、磷酸氢二钾0.1%、氯化钾0.1%、蔗糖3%,溶于蒸馏水中,调至pH6.0~6.5,121℃灭菌30min。
2.2.2 黄曲霉基因组DNA的提取
刮取菌丝于0.5ml无菌生理盐水中,10000r 5min,离心。弃上清,晾干。称取100mg于1.5mL EP管中,加入4μL 1M Tris- HCL,4μL 1M EDTA,2-3μL溶菌酶,混匀。37℃温育30min。加入1mL CTAB裂解液65℃温育1h,每隔10min上下颠倒混匀。将温育好的离心管12000r 10min离心,取上清,加入等体积24∶1的氯仿和异戊醇混合溶液,漩涡震荡,静置5min。12000r 10min离心,取上清,重复上一步洗脱。加入等体积异丙醇,静置30min。12000r 10min离心,弃上清。用0.5ml 70%乙醇洗涤沉淀,12000r 10min离心,弃上清。用30μL TE溶解沉淀。-20℃下保存。
2.2.3 PCR扩增
根据黄曲霉蛋白活化基因afl-2的基因序列,获得对应的上下游引物afl-2 F:5′-TATCTCCCCCCGGGCATCTCCCGG-3′和afl-2 R:5′-CCGTCAGACAGCCACTGGACACGG-3′[3],送吉林省库美生物科技有限公司合成。
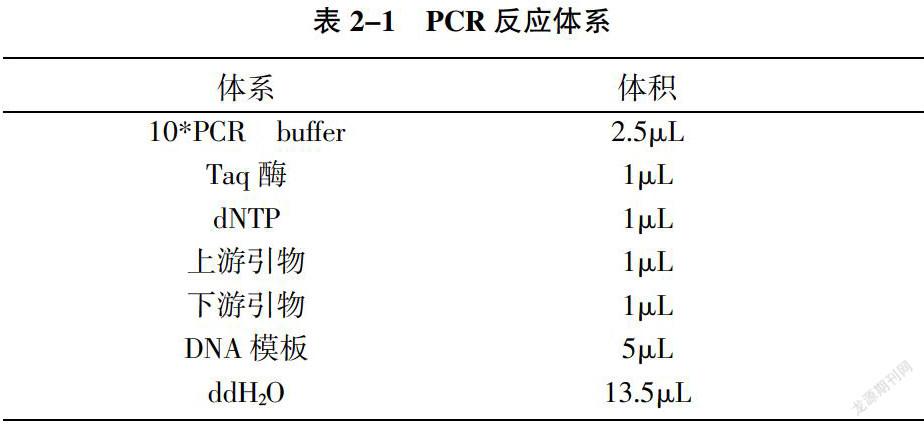
选取黄曲霉毒素合成的关键基因afl-2进行PCR扩增检测。PCR反应体系见表2-1。
PCR反应条件:95℃预变性5min后,95℃ 30sec、55℃ 30sec、72℃ 30sec,30个循环,72℃延伸10min,4℃保存。反应结束后,用1.0%的琼脂糖凝胶电泳检测PCR结果。
2.2.4 灵敏度分析
滤膜过滤黄曲霉孢子悬浮液除去菌丝体和杂质,血球计数器计数以调节孢子液浓度为105个/ml,取1ml孢子液,用溶菌酶-CTAB法提取基因组DNA后,用50μLTE进行溶解。将浓度确定的基因组阳性模板210ngμL-1进行梯度稀释后作为检测模板进行PCR扩增蛋白活化基因afl-2基因片段,检测PCR扩增的灵敏度。
2.2.5 特异性分析
以黑曲霉、米曲霉、寄生曲霉、红曲霉为对照菌株,提取各菌株基因组DNA,以蛋白活化基因afl-2为靶基因进行PCR扩增,PCR反应体系和扩增条件同上。
3 结果与分析
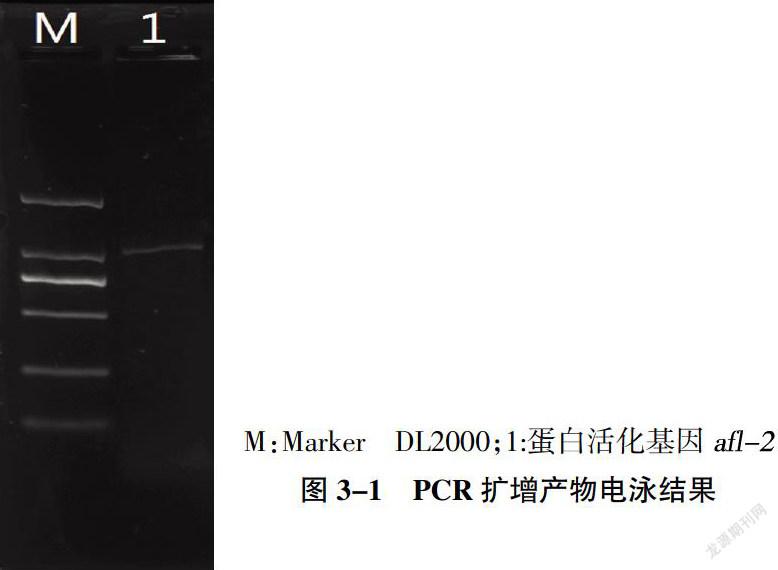
3.1 PCR扩增目的片段
针对蛋白活化基因afl-2进行PCR扩增,结果如图3-1所示。结果显示:蛋白活化基因afl-2 PCR产物在1034bp处有电泳条带。与目的片段长度相符。初步说明实验成功,实验所用黄曲霉菌株产生黄曲霉毒素。针对目的片段检测的引物验证是成功的。
3.2 灵敏度分析
灵敏度检测结果如图3-2所示。反应体系中能清晰显示目标条带的最低DNA浓度为21pgμL-1(泳道5)。进行PCR检测,其检测灵敏度达到104倍稀释度,检测最低DNA含量达到1050pg,黄曲霉菌每个孢子所含DNA含量为103pg,因此,理论上本方法的灵敏度约为10个孢子。
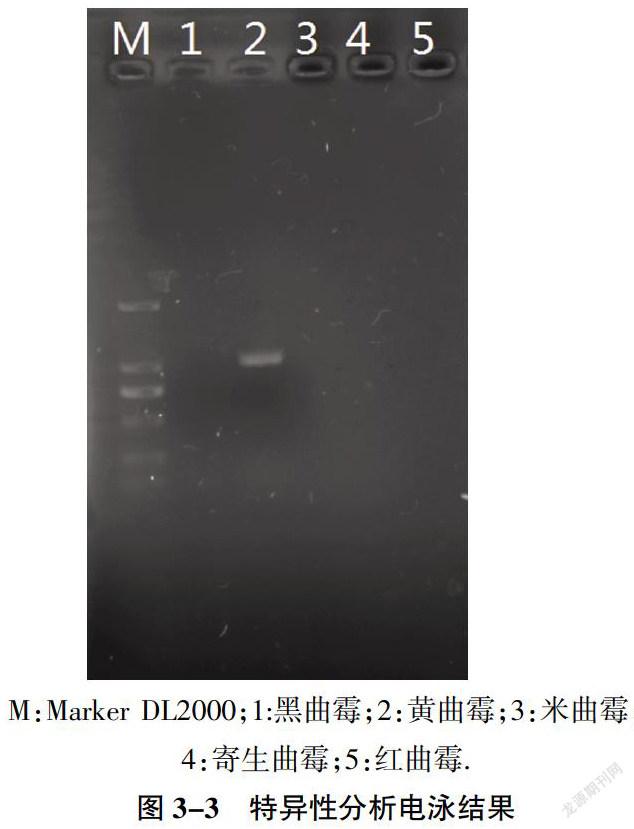
3.3 特异性分析
结果如图3-3所示,仅有2号泳道的黄曲霉菌呈阳性,其余均为阴性,未扩增出蛋白活化基因afl-2。表明本检测方法特异性良好。
4 结论
本研究采用溶菌酶-CTAB法快速提取黄曲霉菌基因组DNA,使用PCR技术扩增黄曲霉毒素合成途径的关键基因afl-2,建立一种快速、准确的黄曲霉菌检测方法,本方法特异性较强,灵敏性较高,检测最低检出DNA含量达到1050pg,达到10CFU/ml。与传统方法相比,本检测方法大大节省了检测时间,可为从源头上对黄曲霉菌的防控提供有效措施,保障食品安全与公众健康。
参考文献
[1] 晏丽.黄曲霉毒素产毒菌检测方法的研究及其应用[D].江南大学,2012.
[2] 孙长坡,常晓娇,伍松陵,沈晗.利用PCR-RFLP方法鉴别黄曲霉毒素产毒菌株[J].中国农业科学,2014,47(18):3675-3683.
[3] 李少晖,任丹丹,谢云峰,等.食品中黄曲霉毒素检测方法研究进展[J].食品安全质量检测学报,2015,6(04):1107-1115.
[4] 秦文彦.潜藏性产黄曲霉毒素真菌的多重PCR检测体系构建及真菌DNA提取技术的改进[D].浙江大学,2007.
