HBsAg抑制聚乙二醇化α干扰素治疗敏感性的初步分子机制
2020-09-10陈苏华程振波李直懋张国灿
陈苏华,程振波,李直懋,张国灿,张 冉
(湖南师范大学医学院,长沙 410006)
乙型肝炎病毒(HBV)感染是急、慢性肝炎的主要原因[1]。目前用于治疗乙型肝炎的药物有聚乙二醇化α干扰素(Peg-IFNα)与核苷类似物。但是,Peg-IFNα往往只在治疗初期有效[2],Peg-IFNα耐药的分子机制尚不清楚。蛋白磷酸酶2Ac(PP2Ac)可以与细胞中的蛋白质精氨酸甲基转移酶1(PRMT1)发生相互作用,从而导致信号转导子和转录激活子1(STAT1)的低甲基化,抑制Peg-IFNα诱导的信号传导[3-6]。有研究表明,HBV的表面蛋白和X蛋白可以诱导PP2Ac的表达[5]。
本研究分别采用HBsAg特异性免疫球蛋白G(HBIG)和RNAi技术控制细胞内HBsAg的水平,对HBsAg导致干扰素治疗无效的机制进行了初步探讨。
1 材料与方法
1.1 细胞培养使用DMEM培养基(GIBCO)加10 %的胎牛血清(GIBCO)将HepG2.2.155细胞(上海细胞生物学研究所,HBV阳性并能完整复制)置于37 ℃、5%的CO2的条件下培养。以3×105/mL细胞密度接种六孔板。24 h后用Peg-IFNα和HBIG分别处理细胞,72 h后收集培养上清进行分析。
1.2 RNAi转染前一天,将HepG2.2.15细胞以2×104个/cm2的密度接种在6孔板中,第二天细胞融合度约50%。对照组仅用siRNA缓冲液处理。按照试剂盒操作说明,使用无血清、无抗生素培养基将10μL Lip2000(Invitrogen)和 150 pmol siRNA 混合进行转染。转染6h后,把培养基换成含10% FBS的DMEM。siRNA处理72 h后,收集上清液和细胞进行进一步分析。
抑制率= [1-A值(实验组)/ A值(阴性对照)]×100%。
1.3 免疫印迹分析(Western blot)使用冷藏后的PBS和0.1% EDTA收集细胞,PBS洗涤3次,再加入100μL pH 8.0的裂解缓冲液(1%NP-40,80 mM Tris,150 mM NaCl,10mM EDTA),充分混匀后 4℃放置 30 min。1200 g离心5 min去除细胞核。以总上样量为10μg的蛋白在12%的聚丙烯酰胺凝胶上电泳分离,并转移到0.45μm 的醋酸纤维薄膜,转膜缓冲液为 25 mM Tris /HCl(pH 8.3),192 mM甘氨酸和20%甲醇。使用含5%脱脂奶粉的TBST封闭1 h。随后加入一抗和HRP标记的二抗进行检测。一抗分别是抗HBsAg的小鼠单克隆抗体(abcam)、抗PP2Ac、抗PRMT1、抗pSTAT1和抗β-actin(内参)的兔单克隆抗体,1∶1000稀释。二抗为HRP标记的羊抗鼠IgG和羊抗兔IgG单克隆抗体,1:5000稀释。选择β-actin作为内参蛋白,在QUANTITY ONE成像系统(Bio-Rad)下显影。
1.4 ELISA根据雅培HBsAg ELISA试剂盒的说明书,检测HepG2.2.15细胞上清液中分泌的HBsAg量。结果以吸光度值与cut-off值的比值表示,并计算出HBsAg分泌的百分比。
1.5 RNA提取和定量实时PCR(Q-PCR)严格按照Trizol试剂盒(Invitrogen)操作说明书,提取细胞总RNA。使用反转录试剂盒(Takara)以起始模板量为0.5μg的RNA制备cDNA。实时荧光定量PCR使用 SYBR Premix ExTaqⅡ试剂盒(Takara)。扩增仪器为 Step One Plus(Applied Biosystems),扩增程序为 95℃30 s后接着 95℃ 5 s,60℃ 34 s,95℃ 15 s,60℃ 1 min,95℃ 15 s进行40个循环,做熔解曲线分析。HBsAg基因表达分析的引物 :上游引物 5'-CTC ACA ATA CCG CAG AGTC-3'和下游引物5'-TAA ACT GAG CCA GGA GAAA-3'。PP2Ac的引物是 :上游引物 5'-CAA TGG CCT CAC GTT GGT-3'和下游引物 5'-TCC ATG ATT GCA GCT TGG TT-3'。以 GAPDH RNA 作为内对照。GAPDH的引物是:上游引物5'-TGACTTCAACAGCGA CACCCA-3'和下游引物5'-CACCCTGTTGCTGTAGCCA AA-3'。结果以2-ΔCt表示 mRNA的相对表达水平[7],实验组和对照组之间的mRNA浓度差异以倍数表示,使用Prism 5软件作图。
2 结果
2.1 HBIG对细胞内HBsAg含量的影响为了分析HBIG对HBsAg分泌的影响,用不同浓度(1.0、0.5和0.25 mg/mL)的HBIG培养HepG2.2.15细胞,以没有添加HBIG的细胞作为对照。培养72 h后,用免疫印迹检测细胞内HBsAg。我们发现用HBIG处理的细胞中HBsAg的表达都有不同程度增加;与对照组相比,用0.25、0.5、1.0 mg/mL HBIG培养的细胞中 HBsAg的分别增加2.24、3.22、5.20倍(图1A)。为了进一步确定PP2Ac是否会随HBsAg的变化而改变,我们还测定了PP2Ac表达量。在相同的细胞质提取物中,我们通过免疫印迹发现,PP2Ac的表达量在使用0.25、0.5和1.0 mg/mL HBIG时,相比对照组分别增加2.13、2.20和3.22倍(图1A)。然后,我们使用实时定量PCR分析了PP2Ac 的mRNA表达量。如图1B所示,所有实验组的PP2Ac mRNA都出现了不同程度的增加。由此表明,当HBsAg水平升高时,PP2Ac出现表达增加。

图1 用不同浓度的HBIG处理HepG2.2.15细胞72 h后 :(A)Western blot检测HepG2.2.15细胞中HBsAg和PP2Ac表达。(B)qRT-PCR检测HepG2.2.15细胞中PP2Ac的mRNA水平。
2.2 HBsAg诱导PP2Ac表达为研究HBsAg是否影响Peg-IFNα作用通路,我们比较了不同剂量Peg-IFNα组PP2Ac表达水平(图2A)。如图所示,在用Peg-IFNα处理细胞后,PP2Ac的表达被抑制;且在Peg-IFNα浓度为5000 IU/mL时,PP2Ac的表达量最低,可用于后续实验。
然后,我们将细胞在不同浓度HBIG(1、0.5、0.25 mg/mL)培养 72 h,再加入Peg-IFNα(5000 IU/mL)中培养6 h。通过免疫印迹和实时定量PCR分析了PP2Ac的mRNA以及蛋白的表达水平,以确定在Peg-IFNα存在的情况下,HBsAg是否会干扰PP2Ac的表达。结果显示,在不同浓度 HBIG(1、0.5、0.25 mg/mL)HBIG 处理的细胞中,PP2Ac的蛋白表达量时分别为对照组的3.02、2.93、1.34倍(图2B);mRNA的水平也高于对照组(图2C)。同时,我们还采用免疫印迹分析PRMT1的表达。与对照细胞相比,我们发现在具有高浓度的PP2Ac细胞中,PRMT1明显被抑制(图2B)。
结果表明,HBsAg在Peg-IFNα的存在下增加PP2Ac的表达,并抑制PRMT1在细胞中的表达。
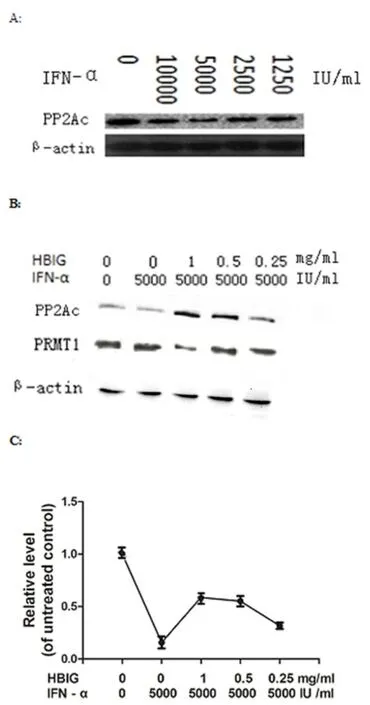
图2 (A)不同浓度的IFN-α处理HepG2.2.15细胞6 h后,Western blot分析PP2Ac的表达。(B)用5000 IU/ml的IFN-α刺激细胞6 h后,以不同浓度HBIG处理HepG2.2.15细胞72 h,Western blot检测PP2Ac和PRMT1的表达水平。(C)处理方法同(B),qRT-PCR检测细胞中PP2Ac的mRNA水平。
2.3 RNAi下调HBsAg的水平我们用三种不同的siRNA(表1)转染HepG2.2.15细胞,并使用一种沉默siRNA作为阴性对照。在用siRNA处理后,分别在24 h、48 h和72 h 收集上清液。经 ELISA(图 3A)、Western blot(图3B)检测发现,在siRNA转染的细胞中HBsAg表达水平被显著抑制。与沉默 siRNA转染细胞相比,三种siRNA对HBsAg的抑制率分别为60.2%、27.8%和57.0%。说明三种siRNA均可有效地降低了HBsAg基因的表达。另外我们同时分析了用siRNA处理72 h后细胞中PP2Ac的表达水平,发现PP2Ac表达水平也显著降低(图3B)。与沉默siRNA转染的细胞相比,三种siRNA对PP2Ac的抑制率分别为44.1%、29.3%和37.0%。实时定量PCR结果(图3C)也表明,随着HBsAg mRNA表达的降低,PP2Ac mRNA的水平随之降低。

表1 RNAi中使用的引物
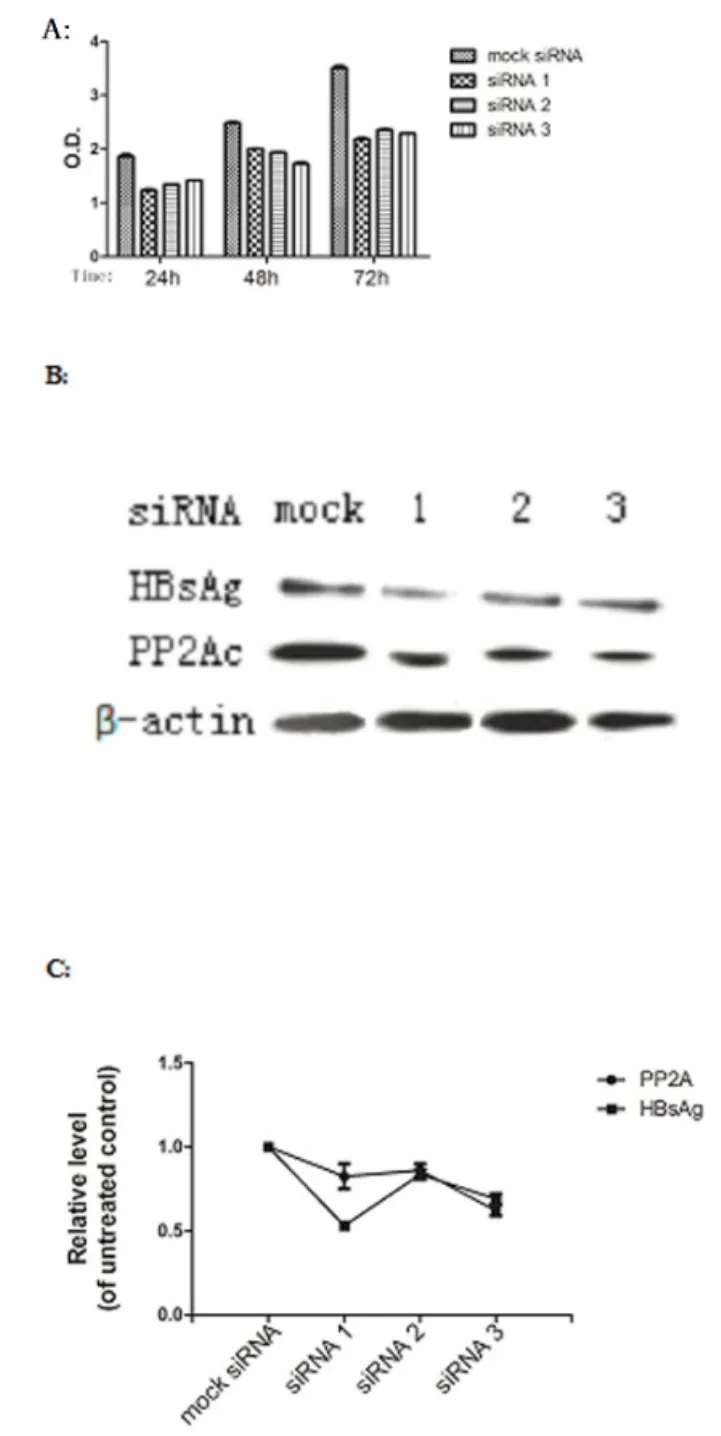
图3 (A)用三种不同的siRNA或沉默siRNA转染HepG2.2.15细胞。在每个周期结束时,即在三个时间点,通过酶联免疫吸附测定法测试上清液。(B)Western blot分析检测siRNA转染72 h后细胞中HBsAg和PP2Ac蛋白表达水平。(C)转染的72 h后qRT-PCR检测细胞中HBsAg和PP2Ac的mRNA水平。
3 讨论
PP2A是几乎在所有细胞中都表达的一种异源三聚体丝氨酸/苏氨酸磷酸酶,由36 kD催化C亚基(PP2Ac)、65 kD结构性A亚基和可变调控B亚基组成。PP2Ac在细胞周期调节、形态、发育、应激反应、凋亡和多种信号通路的调节等细胞进程中发挥着效应[8]。PP2Ac在HCV转基因小鼠和丙型肝炎患者的肝细胞都有过表达[4]。另外有研究证明HBV的表面蛋白和X蛋白可以诱导PP2Ac的表达[5]。
近年,有相关研究对病毒逃逸干扰素作用的分子机制做了探讨,PP2Ac会通过Jak-STAT途径影响Peg-IFNα的敏感性[3]。这些研究表明,PP2Ac与PRMT1在细胞中发生相互作用导致STAT1低甲基化和Peg-IFNα诱导的信号传导受到抑制,从而导致HBV患者干扰素治疗无效[4-6]。
体外实验表明,HBIG可以被内吞入肝细胞系,与HBsAg发生相互作用,抑制细胞分泌HBsAg和HBV病毒颗粒[9,10]。RNAi是 siRNA 引起 mRNA 特异性降解的过程。利用RNAi技术可以显著且特异性地抑制HBsAg基因的表达[11,12]。因此,我们使用 HBIG 和基因沉默来调节体外HBsAg的水平。
在本研究中,我们使用稳定表达HBV基因组的HepG2.2.15细胞来分析HBsAg对PP2Ac的作用。结果显示,无论Peg-IFNα是否存在,随着HBsAg的水平升高,PP2Ac的表达均会增加(图1和图2)。表明HBsAg增加可以促进PP2Ac的表达,且Peg-IFNα不能影响HBsAg对PP2Ac的作用。随后我们发现PP2Ac表达增加可以抑制PRMT1的表达(图2B)。PRMT1是在所有细胞中表达的重要酶,并参与许多蛋白质的精氨酸甲基化。PRMT1通过改变STAT1的精氨酸甲基化程度,调节Peg-IFNα诱导的靶基因转录[13]。当HBsAg的表达被RNAi抑制时,PP2Ac基因的表达也被抑制(图3)。我们的结果表明HBsAg可以增强PP2Ac的表达,而PP2Ac可以直接与PRMT1相互作用,进而抑制Peg-IFNα的敏感性。
在HBV的患者血清中,除了感染性颗粒外,还有大量游离的HBsAg以SVP的形式存在[14]。SVP可能会中和宿主产生的抗体,从而增加病毒感染性[15,16];SVP也有助于产生免疫耐受状态,导致病毒的持续感染[17]。因血清中HBsAg的含量与细胞内HBsAg成正比[18]。血清中存在高浓度的HBsAg预示着患者对干扰素治疗的敏感性低。与以前研究相比,本研究让我们对HBsAg功能有了新的认识,然而,HBsAg与IFN相互作用的潜在分子机制需要进一步研究。
总之,我们使用Western blot,qRT-PCR和ELISA确定了HBsAg对PP2Ac表达的影响;探究了HBsAg抑制干扰素作用的初步分子机制:PP2Ac的上调会抑制PRMT1的活性,最后影响干扰素治疗的敏感性。HBsAg可以影响Peg-IFNα的敏感性,可作为治疗慢性乙型肝炎患者潜在靶标,为慢性乙肝感染患者的治疗方法提供新思路。
