HPLC法同时测定清瘟解毒口服液中栀子苷、黄芩苷的含量
2020-09-10龚旭昊杨星张璐赵富华范强
龚旭昊,杨星,张璐,赵富华,范强
(中国兽医药品监察所,北京 100081)
清瘟解毒口服液质量标准现收载于《兽药质量标准(2017年版中药卷)》中,其由地黄、栀子、黄芩、连翘、玄参、板蓝根6味中药经现代提取工艺加工而成[1]。方中用黄芩清泻肺热,连翘清心经客火,板蓝根利咽解毒,三者共为君药,清解中上焦气分实热;栀子清三焦火热为臣药,辅助君药泻火败毒;地黄、玄参凉血滋阴降火皆入肾经,为佐使药;诸药合用,共奏清热泻火、益阴败毒之功[2]。临床上主治外感发热,在家禽病毒病的防控中应用十分广泛,系国家药品标准中清热解毒类代表性方剂之一[3]。
该方剂现行质量标准中只采用薄层色谱法对黄芩、栀子、连翘进行定性检测,不能完全反映处方情况,质控水平较低,缺乏主要药效成分的定量测定,不利于产品质量的稳定性控制和质量评价,可能导致较为严重的产品临床疗效差异。基于以上分析,本研究参考《中国兽药典》2015年版二部龙胆泻肝散及相关文献[4-5],选择方中君药黄芩、臣药栀子中指标活性成分黄芩苷、栀子苷为研究对象,建立同时测定二者含量的高效液相色谱方法,为清瘟解毒口服液质量标准的完善及产品质量控制提供科学依据。
1 材料与方法
1.1 仪器与试剂 仪器:Waters e2695高效液相色谱仪,配置Waters 2998 PDA检测器,Empower3色谱工作站软件。分析天平(Mettler XS205,十万分之一),昆山KQ-300型超声波清洗器。试剂:乙腈,色谱纯,购自默克公司;甲醇,分析纯,购自国药集团化学试剂有限公司;磷酸,分析纯,购自国药集团化学试剂有限公司;水由实验室MILLIPORE超纯水仪自制。
1.2 试药 栀子苷对照品(批号:110749-201718),97.6%,中国食品药品检定研究院;黄芩苷对照品(批号:Z0271705),96.8%,中国兽医药品监察所。供试品:某企业生产的清瘟解毒口服液,批号:18010201;阴性对照供试品:根据清瘟解毒口服液处方组成,取处方中除栀子、黄芩以外的其他药味,照其制备工艺[1],由实验室自制而成。
1.3 试验方法
1.3.1 色谱条件 色谱柱:Shiseido MGⅡC18(4.6 mm×250 mm,5 μm),编号:A4AD06200;流动相:以0.2%磷酸溶液为流动相A,以乙腈为流动相B,梯度洗脱,见表1。柱温:25 ℃,流速:1.0 mL/min;二极管阵列检测器,采集波长范围为210~400 nm,分辨率为1.2 nm,记录238 nm波长处的色谱图。
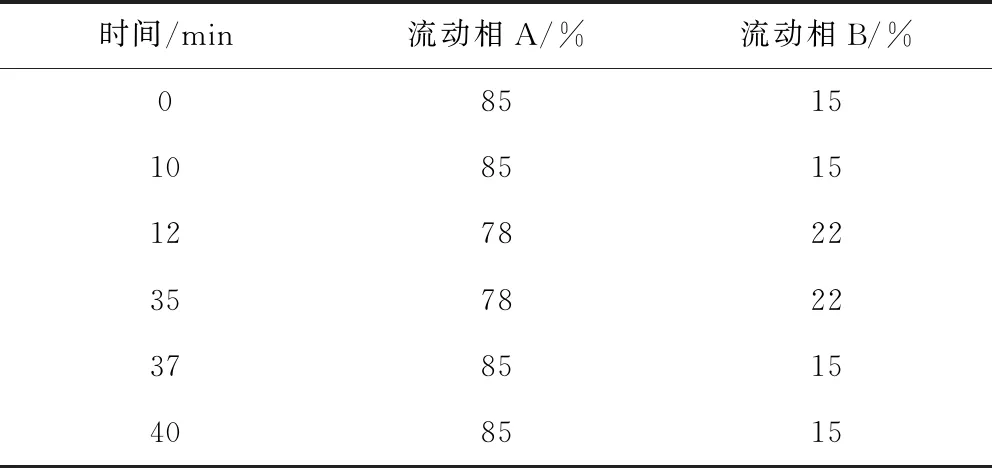
表1 梯度洗脱表Tab 1 Gradient elution form
1.3.2 对照品溶液的制备 取栀子苷对照品25.0 mg,置50 mL量瓶中,加甲醇使溶解并稀释至刻度,摇匀,作为栀子苷对照品储备液;取黄芩苷对照品25.0 mg,置50 mL量瓶中,加甲醇使溶解并稀释至刻度,摇匀,作为黄芩苷对照品储备液;精密量取栀子苷对照品储备液5 mL、黄芩苷对照品储备液10 mL,至同一50 mL量瓶中,加甲醇稀释至刻度,摇匀,得浓度为栀子苷50 μg/mL和黄芩苷100 μg/mL的混合对照品溶液。
1.3.3 供试品溶液的制备 精密量取清瘟解毒口服液供试品1 mL,置50 mL量瓶中,加50%甲醇40 mL,超声处理10 min,放置至室温,加50%甲醇稀释至刻度,摇匀,即得。
1.3.4 阴性对照溶液的制备 精密量取阴性对照供试品1 mL,同1.3.3项下方法,制备得阴性对照溶液。
1.3.5 测定法 分别精密吸取对照品混合溶液、供试品溶液及阴性对照溶液各10 μL,注入液相色谱仪,测定,即得。
2 结果与分析
2.1 系统适用性试验结果 为考察方法的专属性,即判断空白溶剂、制剂中各化学成分及辅料对栀子苷、黄芩苷的测定是否存在干扰,分别精密吸取空白溶剂(50%甲醇)、对照品溶液、供试品溶液及阴性对照溶液各10 μL,注入液相色谱仪,照1.3.1项下色谱条件进行测定,记录色谱图与光谱图。结果显示,对照品溶液中栀子苷和黄芩苷的保留时间分别为8.008 min、33.601 min;供试品中栀子苷、黄芩苷与相应的对照品色谱峰的保留时间及光谱图均一致,且均达到基线分离;空白溶剂和阴性对照溶液色谱图中,在栀子苷和黄芩苷出峰处均没有干扰,表明其他成分对二者的测定均不会造成影响。结果见图1~图4。

图1 空白溶剂色谱图Fig 1 Chromatogram of blank solvent

图2 对照品溶液色谱图Fig 2 Chromatogram of control solution

图3 阴性对照溶液色谱图Fig 3 Chromatogram of negative control solution
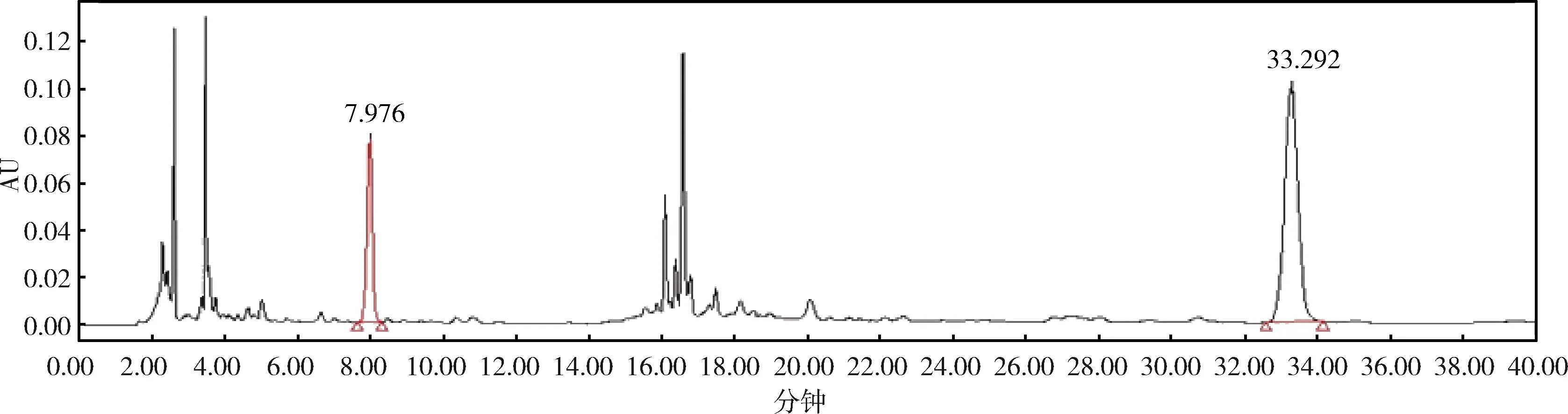
图4 供试品溶液色谱图Fig 4 Chromatogram of test solution
2.2 方法学考察
2.2.1 线性关系考察 精密称取栀子苷、黄芩苷对照品适量,置量瓶中,加甲醇使溶解并稀释至刻度,摇匀,分别制成栀子苷浓度依次为5、15、25、50、100、200、250 μg/mL,黄芩苷浓度依次为10、30、50、100、200、400、500 μg/mL的混合对照品溶液,滤过,分别进样10 μL,照1.3.1项下色谱条件进行测定。以对照品溶液浓度为横坐标(X),峰面积积分值为纵坐标(Y),分别绘制标准曲线,得栀子苷、黄芩苷回归方程分别为(n=7):Y=14614X+35809,R2=0.9999;Y=13270x+23503,R2=1.00。结果表明,栀子苷浓度在5 μg/mL~250 μg/mL、黄芩苷浓度在10 μg/mL~500 μg/mL范围内,峰面积与溶液浓度线性关系良好。见表2。
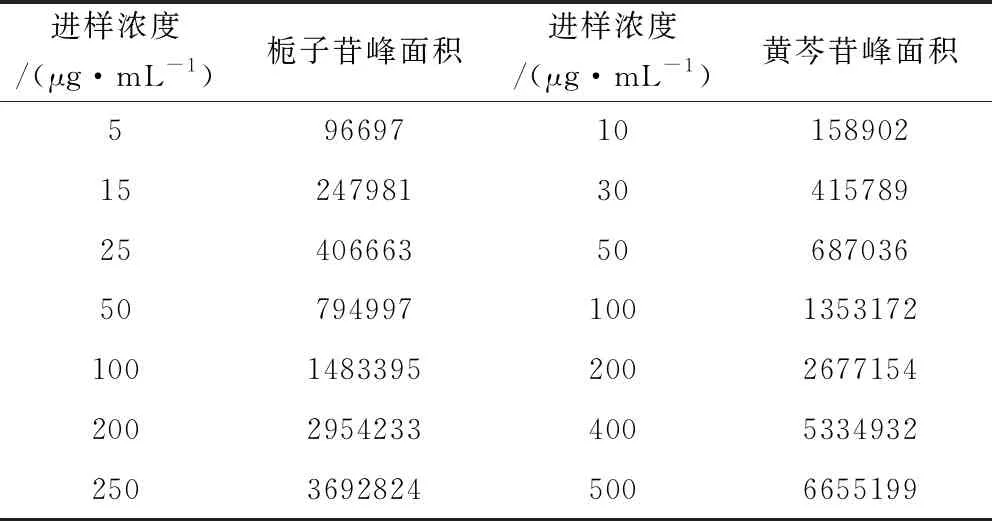
表2 线性关系考察Tab 2 Investigation of linear relations
2.2.2 重复性试验 取清瘟解毒口服液供试品,根据1.3.3项下方法平行配制6份供试品溶液,照1.3.1项下色谱条件分别进行测定,记录峰面积,计算含量。结果栀子苷、黄芩苷平均含量分别为5.49、4.36 mg/mL,RSD分别为0.42%、0.60%,表明方法重复性良好,见表3。
2.2.3 精密度试验 取同一对照品溶液,照1.3.1项下色谱条件,连续进样6次,每次进样10 μL,测定峰面积,结果连续进样6次栀子苷、黄芩苷峰面积的RSD分别为0.22%、0.36%,表明方法精密度良好,见表4。

表3 重复性试验Tab 3 Repeatability test
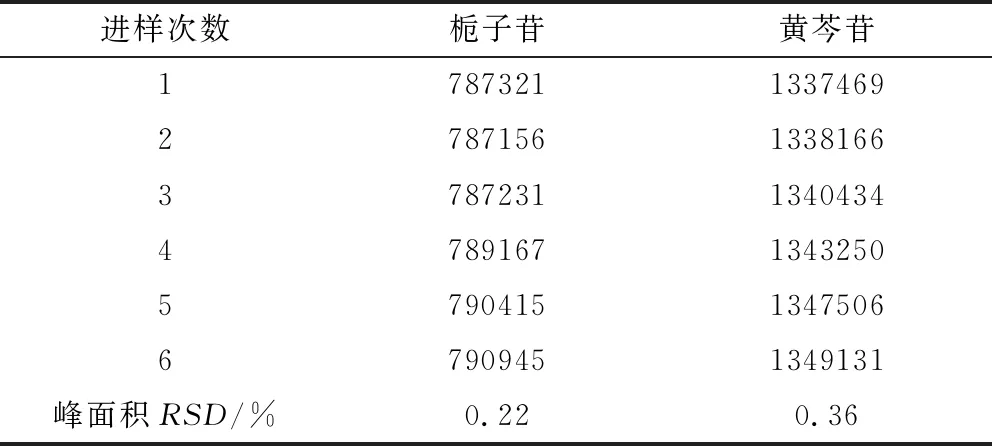
表4 精密度试验Tab 4 Precision test
2.2.4 稳定性试验 取同一供试品溶液,照1.3.1项下色谱条件,分别在0、2、6、12、24、48 h各进样10 μL进行测定,记录栀子苷、黄芩苷的峰面积,其RSD分别为0.30%、0.56%,表明供试品溶液在48 h内稳定性良好,见表5。
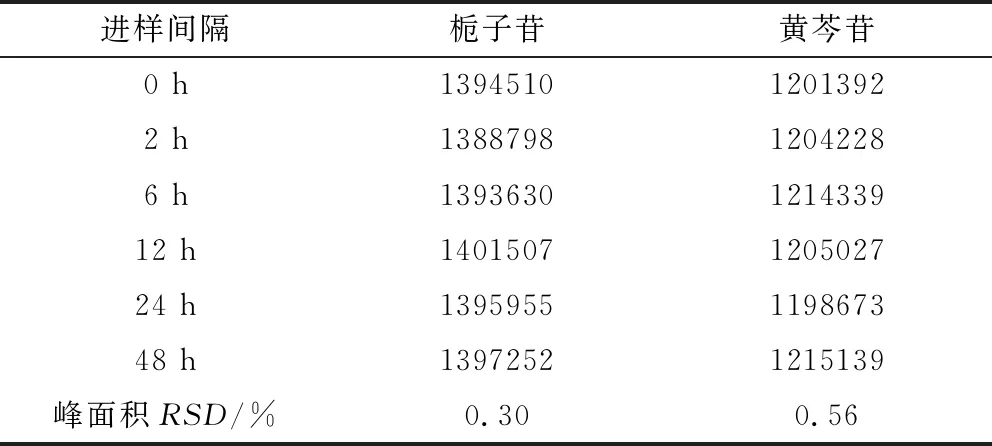
表5 稳定性试验Tab 5 Stability test
2.2.5 回收率试验 根据清瘟解毒口服液供试品中栀子苷和黄芩苷含量,按照供试品、对照品量各半的方法,精密添加栀子苷和黄芩苷对照品储备液,平行制备6份样品,照1.3.1项下色谱条件测定,计算加样回收率。结果显示,栀子苷的回收率在98.99%~100.96%之间,平均回收率为100.14%,RSD值为0.87%;黄芩苷的回收率在98.01%~100.40%之间,平均回收率为99.42%,RSD值为0.94%,表明方法回收率良好,符合要求,见表6。
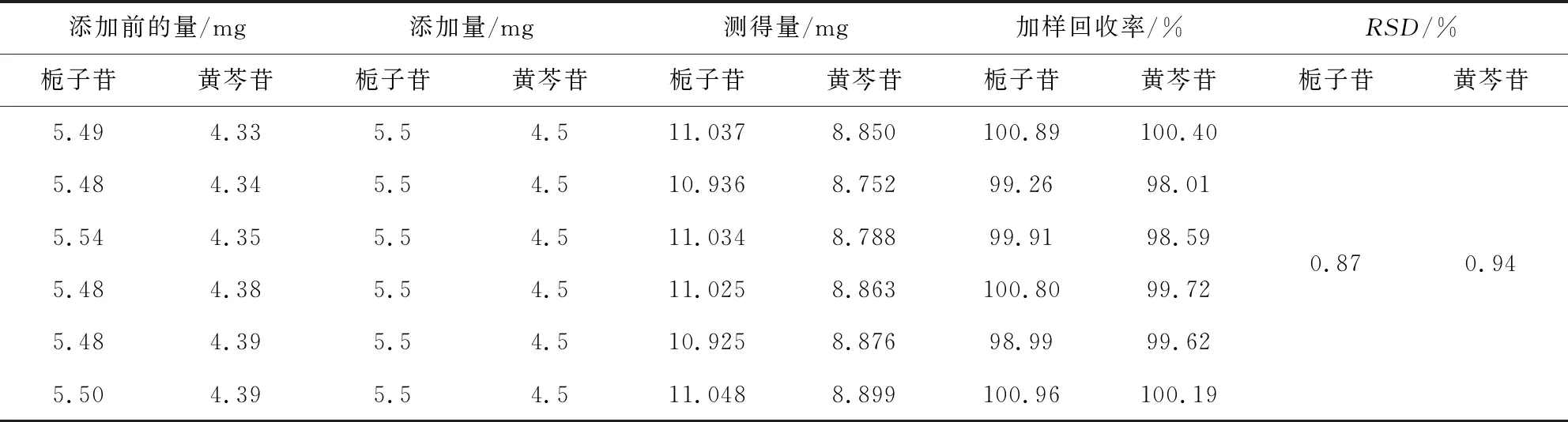
表6 回收率试验Tab 6 Recovery test
2.2.6 检测限与定量限 分别精密量取1 mL阴性对照供试品置50 mL量瓶中,再精密吸取1.3.2项下混合对照品溶液0.5、1、1.5、2 mL加入相应量瓶中,加50%甲醇稀释至刻度,摇匀,照1.3.1项下色谱条件进样检测。按照3倍噪音计算检测限浓度,并参考紫外吸收光谱图进行综合评价。栀子苷、黄芩苷的检测限浓度分别为0.5、1.0 μg/mL,S/N值均为4.5;按照10倍噪音计算定量限浓度,栀子苷、黄芩苷的定量限浓度分别为1.0、2.0 μg/mL,S/N值分别为15.6、11.9。
2.2.7 耐用性试验 分别从色谱柱类型和柱温对方法的耐用性进行考察。
2.2.7.1 色谱柱类型考核 取清瘟解毒口服液供试品溶液,照1.3.1项下色谱条件,分别考察Waters SunFire C18(4.6 mm×250 mm,5 μm;S.N:01623329013880),Shiseido MGⅡ C18(4.6 mm×250 mm,5 μm;S.N:A4AD06200),Dikma C18(4.6 mm×250 mm,5 μm;S.N:6012835),Grace Apollo C18(4.6×250 mm,5 μm;S.N:210100396)对两种被测成分保留时间、分离度、拖尾因子、理论塔板数的影响。结果见表7。
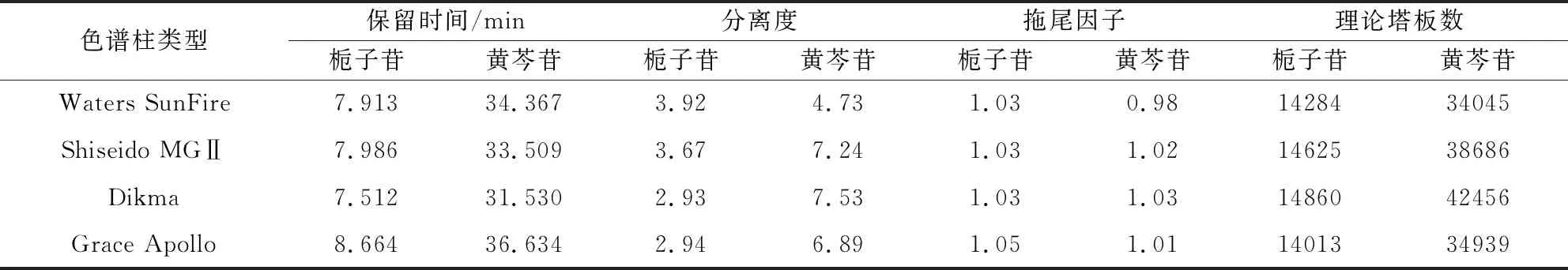
表7 色谱柱类型考察Tab 7 Investigation of chromatographic column types
2.2.7.2 色谱柱柱温考察 取清瘟解毒口服液供试品溶液,改变色谱柱柱温分别在20 ℃、25 ℃、30 ℃进行测定。结果显示,随柱温升高,栀子苷和黄芩苷保留时间有所提前,但峰面积、分离度、拖尾因子、理论塔板数基本没有变化。
上述耐用性试验结果表明,该方法耐用性良好。
2.3 样品含量测定 为摸排市场现有清瘟解毒口服液的质量差异,进而为产品质量标准的完善提供科学依据。照1.3.1项下色谱条件,本次研究共对来自河南、山东、江苏等8家兽药企业的8批样品及实验室自制的1批样品进行了栀子苷、黄芩苷含量的测定。结果显示,一是本实验研究所建立的HPLC含量测定方法可行,适用于不同厂家产品中两种成分的同时测定;二是不同厂家的产品质量差异较大,在9批样品中,栀子苷含量范围为0.39 mg/mL~12.48 mg/mL,最大相差32倍;黄芩苷含量范围为1.11~18.91 mg/mL,最大相差17倍;见表8。该结果表明,不同厂家的工艺水准、质控水平参差不齐,或导致产品质量及临床疗效存在严重差异。基于此,完善清瘟解毒口服液的质量标准极为必要。
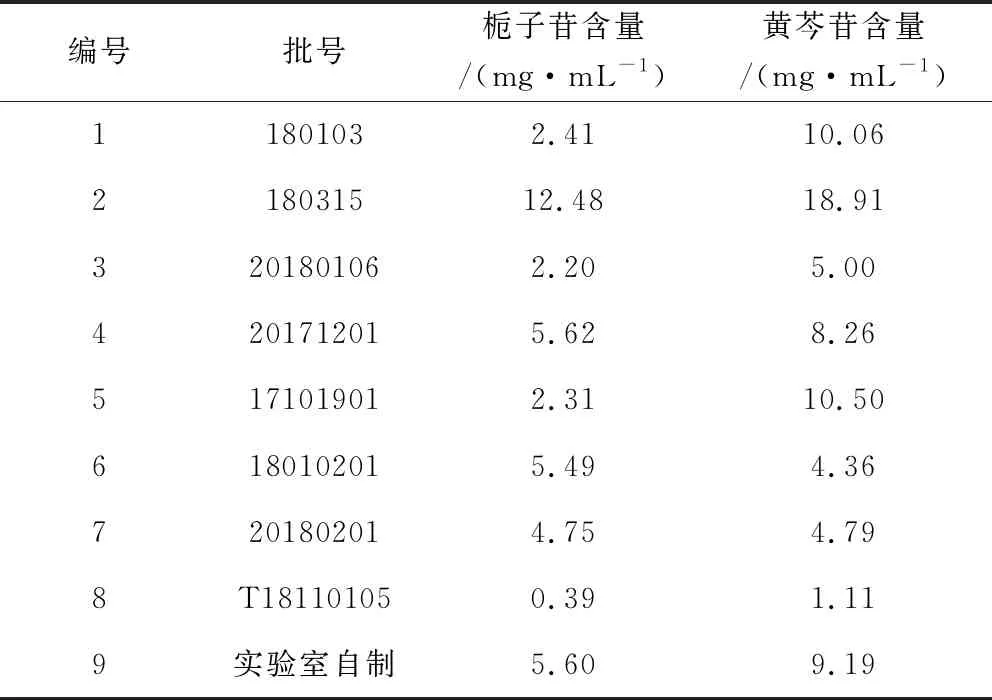
表8 样品含量测定结果Tab 8 Determination results of sample content
3 讨论与结论
3.1 提取溶剂考察 根据兽药典及文献相关方法,试验分别考察了水、30%甲醇、50%甲醇、70%甲醇的提取效率。即精密量取供试品1 mL置50 mL量瓶中,分别加入水、30%甲醇、50%甲醇、70%甲醇40 mL,超声30分钟,放置至室温,再加相应溶剂稀释至刻度,摇匀,进样测定。结果发现,供试品中黄芩苷在50%甲醇中的提取效果优于其他溶剂,最终选择50%甲醇为供试品提取溶剂。
3.2 提取方式考察 精密量取供试品1 mL置50 mL量瓶中,加50%甲醇40 mL,分别采取不超声直接稀释至刻度并振摇,超声10 min、超声20 min、超声30 min后放置至室温并稀释至刻度,摇匀,进样测定。结果上述四种提取方式所得栀子苷峰面积RSD为0.18%,黄芩苷RSD为0.28%,均小于2%。该结果表明,振摇和超声的提取效率基本相同,为确保供试品溶液混合均匀,兼顾测定效率,最终选择超声10 min作为供试品提取方式。
3.3 检测波长的选择 试验中,在210~400 nm的波长范围内对栀子苷、黄芩苷的最大吸收波长进行扫描。其中,黄芩苷的特征吸收在278 nm,栀子苷的特征吸收在238 nm。经试验考察,发现在278 nm波长处,栀子苷几乎无响应值,而在238 nm处,黄芩苷仍有较为明显的特征峰,故最终将检测波长设定在238 nm。
3.4 流动相的选择 本试验在参考相关文献[6]和《中国兽药典》2015年版二部龙胆泻肝散含量测定的基础上,分别考察了“甲醇/乙腈-水”、“甲醇-磷酸水溶液”、“乙腈-磷酸水溶液”洗脱系统,经试验发现使用“甲醇/乙腈-水”作为流动相,基线分离效果较差;“甲醇-磷酸水溶液”作为流动相,柱压较高;而乙腈洗脱能力优于甲醇,且在流动相中加入少量磷酸可以起到改善峰形和分离度、减少拖尾的效果。故最终选择“乙腈-0.2%磷酸水溶液”作为本含量测定方法流动相。
3.5 结论 随着我国集约化规模化养殖业的快速发展,以及社会公众对动物源性食品中兽药残留的担忧,中兽药因其绿色天然、毒副作用低、不易产生耐药性等优点在兽医临床中的使用日益广泛[7]。伴随中兽药广泛应用而来的是其质量控制问题日益突出,其质量标准的研究与制定,对生产实际及临床疗效的影响越来越大。因此,质控问题及研究也是决定中兽药产业能否实现现代化和国际化的重要前提。基于此,提高中兽药质量标准并建立完善的质控体系,不仅是为养殖业持续提供质量可控、成份明确及品质稳定的产品,也是推动行业健康发展的需要[8]。
作为清瘟解毒类的代表性方剂,清瘟解毒口服液现有质量标准缺乏对主要活性成分的含量监测,已经无法对产品质量和临床疗效进行有效控制。本研究选取方中主要药味黄芩、栀子中的主要活性成分黄芩苷、栀子苷为研究对象,建立了HPLC同时对两种活性成分进行含量测定的方法。研究结果显示,该方法操作简单,专属性强,准确性、重复性、精密度、耐用性良好,适用于该制剂的质量控制,并为制剂标准的完善和产品疗效的有效控制提供了科学依据。
