咪唑型离子液体/苯两相体系下不对称催化氢化合成手性泛内酯*
2020-09-10崔菲菲
朱 琳,崔菲菲,金 欣
(青岛科技大学 化工学院,山东 青岛 266042)
手性泛内酯是泛酸钙[1]、泛酸醇[2]、泛酰硫氢乙胺[3]和泛磺酸[4]等化学品大规模生产的重要原料,也是广泛用作合成天然产物的手性助剂。目前,已开发了几种制备手性泛内酯的方法,如外消旋体的拆分[5]、酮基泛内酯的不对称氢化[6]、微生物合成[7]。其中利用手性过渡金属催化剂的不对称氢化法是获得手性泛内酯绿色化学的方法[8-11]。但是,由于常用的贵金属催化剂价格昂贵,并且催化结束后催化剂难以回收利用,增加了生产成本和规模化生产的难度。
相对于传统均相催化反应,在离子液体中进行的反应具有不同的热力学和动力学行为,这往往会有利于催化剂催化性能的提高,获得更好的催化活性和选择性。此外,离子液体增强了手性金属催化剂的稳定性,易于产品和催化剂的回收利用[12-18]。咪唑型离子液体具有低熔点、低饱和蒸气压等优点,成为目前研究最广泛的一类离子液体[19-21],咪唑型离子液体作为液/液两相催化的理想溶剂,广泛应用于烯胺、脱氢氨基酸、芳香酮和β-酮酸酯等底物的不对称氢化反应中[22]。
关于咪唑型离子液体应用于不对称氢化反应的报道较多,但是至今未见其应用于不对称氢化酮基泛内酯的报道。作者重点考察1-乙基-3-甲基咪唑四氟硼酸盐([EMIM]BF4)、1-丁基-3-甲基咪唑四氟硼酸盐([BMIM]BF4)、1-丁基-3-甲基咪唑双三氟甲磺酰亚胺盐([BMIM]Tf2N)咪唑型离子液体(见图1),将已有报道的膦配体Ⅰ~Ⅴ[23](见图2)应用于咪唑离子液体/苯两相体系,考察不对称氢化酮基泛内酯的规律,实现手性催化剂的高效循环利用。

图1 离子液体的结构
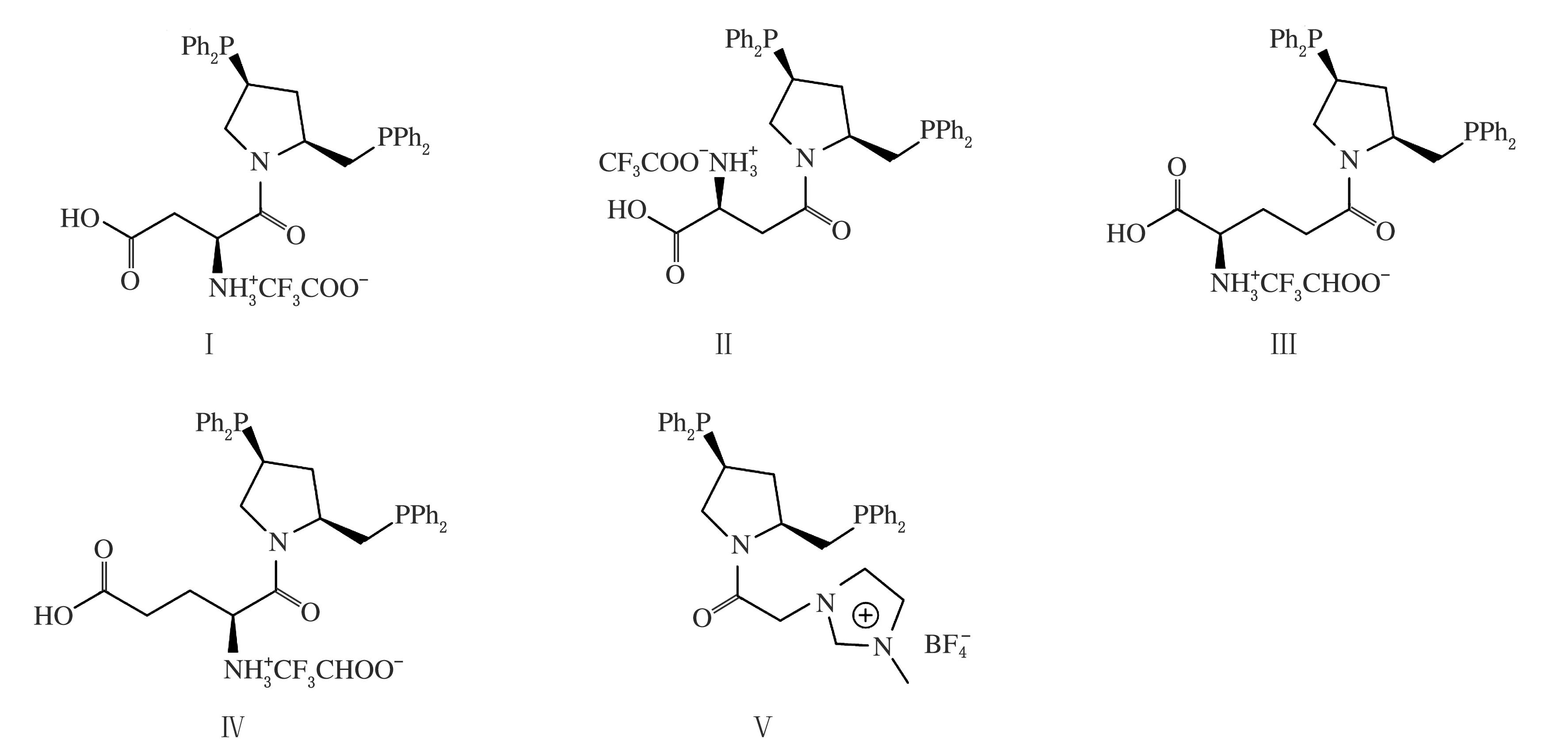
图2 膦配体Ⅰ~Ⅴ的结构
1 实验部分
1.1试剂与仪器
离子液体([BMIM]BF4、[EMIM]BF4、[BMIM]Tf2N):上海邦成化工有限公司;氢化钙:阿拉丁化学试剂有限公司;苯:天津市博迪化工有限公司;以上试剂均为分析纯;溶剂采用标准的Schlenk技术脱氧除水;膦配体Ⅰ~Ⅴ:按参考文献[23]制备;双(1,5-环辛二烯氯化铑)[Rh(COD)Cl]2:阿拉丁化学试剂有限公司。
循环水式多用真空泵:SHB-Ⅲ,恒温加热磁力搅拌器:CL-3A,郑州长城科工贸有限公司;旋片式真空泵:2XZ-2,浙江黄岩宁溪医疗器械有限公司;电子天平:YP402N,上海精密科学仪器有限公司;气相色谱仪:SP-2100A,CP-ChiraSil-DEX CB毛细管柱,北分瑞利仪器集团公司;高压反应釜:60 mL,西安泰康生物科技有限公司。
1.2 咪唑离子液体/苯两相体系下不对称氢化酮基泛内酯的一般过程
原位制备了咪唑型阳离子Rh催化剂。在氩气气氛下,分别将1 g咪唑型离子液体([EMIM]BF4、[BMIM]BF4、[BMIM]Tf2N)和1 mg[Rh(COD)Cl]2(2×10-3mmol)以及2.2倍量膦配体(4.4×10-3mmol)加入到60 mL高压反应釜中,在25 ℃下进行搅拌形成催化剂前体,将酮基泛内酯(1.3 mg,400×10-3mmol)充分溶解于2 mL的脱气苯溶液中,将其转移至高压反应釜。在t=50 ℃、p(H2)=5.0 MPa、n=400 r/min条件下反应4 h,GC在CP-ChiraSil-DEX CB(25 m ×0.25 mm) 手性柱上检测。
1.3 咪唑离子液体/苯两相体系下铑催化剂循环的一般过程
在氩气气氛下,将1 g咪唑离子液体[EMIM]BF4和1 mg[Rh(COD)Cl]2(2×10-3mmol)以及2.2倍量的配体Ⅲ(3 mg,4.4×10-3mmol)加入到60 mL高压反应釜中,在25 ℃下进行搅拌形成催化剂前体,再在高压反应釜中加入2 mL苯溶解的酮基泛内酯(1.3 mg,400×10-3mmol),在p(H2)=5.0 MPa,t=50 ℃,n=400 r/min条件下反应4 h。冰水浴下猝灭反应,静置一段时间后,开釜快速取出上层溶液,减压蒸馏除掉反应釜中残留的苯,再将新的底物和苯溶剂加入到离子液体中进行下一步的催化剂回收。
2 结果与讨论
2.1 咪唑型离子液体/苯两相体系下不对称氢化酮基泛内酯
考察了配体结构和离子液体对不对称氢化酮基泛内酯催化剂活性的影响,见表1。
由表1可知,咪唑修饰的手性配体(配体Ⅴ)表现出较差的活性和对映选择性。而对于氨基酸修饰的配体,配体Ⅰ至配体Ⅳ的结构在3种离子液体中对催化剂的活性和对映选择性有相同的规律。当氨基酸手性中心远离吡咯烷环结构时,催化剂的催化活性和对映选择性提高(配体Ⅰ~Ⅲ),随着氨基酸的手性中心接近吡咯烷环结构时,催化剂的活性和选择性又开始降低(配体Ⅲ~Ⅳ)。这说明氨基酸手性中心与手性催化剂的手性中心产生了消极的相互作用,这与之前发表的文章规律相似[23]。
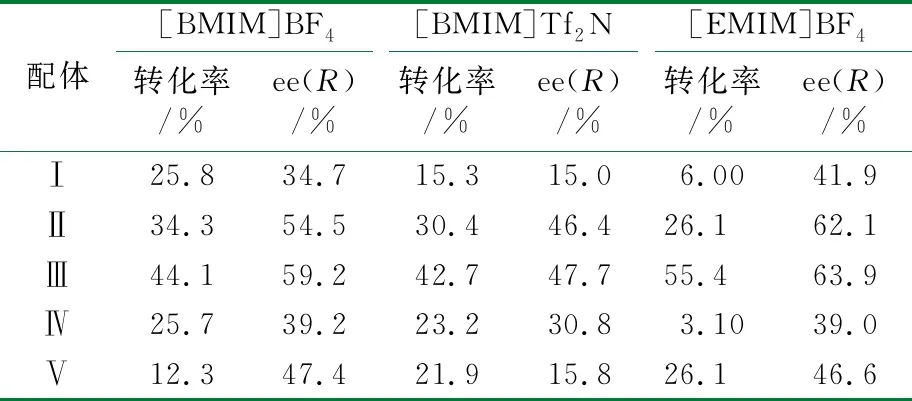
表1 在咪唑型离子液体/苯两相体系下配体结构对酮基泛内酯不对称氢化的影响1)
为了证明离子液体结构对不对称加氢反应的影响,考察了不同溶剂条件下对催化活性的影响,结果表明,配体Ⅰ至配体Ⅴ整体催化活性和对映选择性在[EMIM]BF4/苯两相体系中最高,对映选择性表现最明显,[EMIM]BF4对配体Ⅰ~Ⅴ的固载能力更强,更有利于催化剂的回收循环实验。配体Ⅲ在[EMIM]BF4/苯两相体系下的催化活性和对映选择性是相对最高的。
2.2 咪唑离子液体/苯两相体系铑催化剂的循环
氨基酸离子修饰的配体因极性较大,所以与咪唑离子液体有较强的亲和力,增大了咪唑离子液体对催化剂的固载能力,配体与铑前体在[BMIM]BF4、[BMIM]Tf2N和[EMIM]BF43种离子液体中的溶解度较大,形成离子液体/苯两相反应体系,催化剂被固载到离子液体相中,产品能溶解在苯层中,反应结束后将苯层分离再加入底物即可实现催化剂的循环利用。通过表1筛选出配体Ⅲ在[EMIM]BF4/苯均相体系下进行催化剂的循环利用,见表2。

表2 Rh-配体Ⅲ在[EMIM]BF4/苯两相体系中的循环1)
由表2可知,配体Ⅲ催化循环2次仍然保持相对稳定的转化率和对映选择性,在催化循环第3次之后,催化活性出现明显的降低,根据在[EMIM]BF4/苯两相体系催化剂回收的结果显示,金属Rh流失量为5.87%,因此,认为催化剂活性和对映体选择性迅速丧失是由于Rh损失引起的催化剂失活。
为了克服Rh损失的问题。将n(配体)∶n(Rh)增加至原来的2倍,同时将反应时间延长为之前的2倍,实验结果见表3。
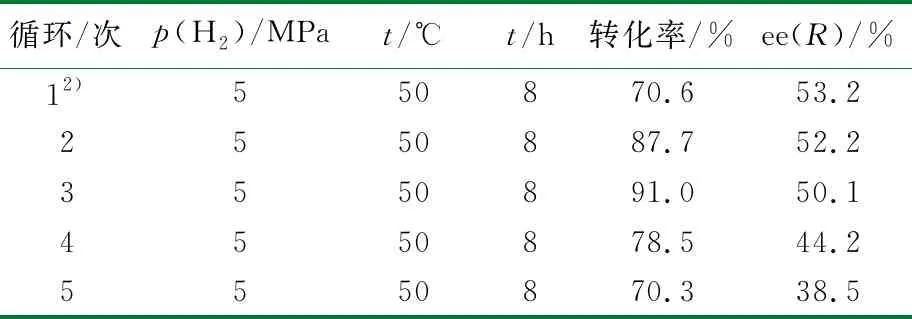
表3 Rh-配体Ⅲ在[EMIM]BF4/苯两相体系中的循环1)
由表3可知,底物的转化率得到了极大地提升,前3次循环过程中转化率呈现增加的趋势,主要原因是由于增加了配体的量,使得配体将贵金属Rh包裹的更加严密,占据了底物在金属螯合配体上的位置,使得底物与Rh配位的机会降低,所以会导致刚开始转化率低。随着循环次数的增加,过量的配体在循环过程中部分被氧化分解,致使与Rh金属螯合的配体量降低,进而提升了底物与催化剂螯合的机会,底物转化率得到提升。在第3次循环后,转化率达到最高值,并且对映选择性仍然保持较高的水平。催化剂在循环5次以后转化率和选择性略有降低,但也保持与表2中相当的催化活性。表3中铑流失为3.1%,比表2低,是由于过量的手性膦配体与Rh结合的更加紧密,有效降低Rh损失,从而提高了手性催化剂的可回收性能。
3 结 论
将膦配体Ⅰ~Ⅴ应用于Rh在咪唑基离子液体/苯两相体系的不对称氢化酮基泛内酯反应,考察不对称氢化酮基泛内酯的规律,实现催化剂的循环利用。结果显示,对于带有氨基酸标记的配体,其在氨基酸中的手性中心位置对其催化效率有至关重要的影响。随着氨基酸手性中心远离吡咯烷环,催化活性和对映体的选择性下降,这可能是由于氨基酸中手性中心与Rh之间的负相互作用。配体Ⅲ在[EMIM]BF4/苯两相体系下的催化活性和对映选择性相对最高。循环实验表明,n(配体)∶n(Rh)能增加催化剂的稳定性,降低金属Rh的流失,在[EMIM]BF4/苯两相体系下催化剂回收循环5次仍能够保持较高的催化活性和对映选择性。
