食物过敏小鼠模型研究进展
2020-09-09王峥李秀敏苗晋鑫
王峥,李秀敏,苗晋鑫*
(1. 河南中医药大学,中医药科学院,郑州 450000; 2. 纽约医学院,微生物与免疫学系,耳鼻喉系,纽约10595)
食物过敏(Food allergy, FA)是世界第五大公共卫生问题,其临床特征为口腔粘膜、喉咙、胃肠道等组织或器官局部炎症,常伴有皮肤反应,严重时可危及生命[1]。 食物过敏因其反应的严重程度及终身性引起了人们广泛的关注[2]。 研究FA 发病机制、防治手段对改善食物过敏患者病情至关重要。目前,仍缺乏完全模拟人类食物过敏临床特征的动物模型。 不同动物模型对同一食物过敏原识别模式和过敏的敏感性存在差异,在蛋白质致敏研究中,猪和狗的食物过敏模型具有与人类非常相似的过敏反应,但是致敏周期长,致敏剂量大和价格昂贵,且缺乏相关的分子免疫试剂,因此它们更多是用于过敏机制研究而非致敏性评价。 食物过敏小鼠模型体积小,易于繁殖和价格便宜,并有多种小鼠免疫分子试剂及近亲交配和转基因小鼠,已广泛用于各种IgE 介导的过敏性疾病的分子和细胞机制研究。 FA 小鼠模型为研究食物过敏原致敏性发生、发展和治疗食物过敏的基本工具[3-4]。 FA 小鼠模型分为依赖佐剂模型、无佐剂模型、转基因模型和人源化模型。 然而,尚无小鼠模型模拟全部人类FA疾病的病理学特征,使用特定的食物过敏小鼠模型对解决特定食物过敏研究问题至关重要。 本综述旨在总结不同FA 小鼠模型与人FA 疾病的相似性以及应用范围,为食物过敏性疾病的研究提供理论及科学基础。
1 佐剂辅助致敏小鼠模型
小鼠免疫系统是目前研究体内复杂的免疫反应的绝佳模型[5]。 已开发多种特定IgE 产生的过敏小鼠模型,过敏原口服途径是食物过敏小鼠模型常用制备方法[6]。 但是,口服途径对诱导IgE 的敏感性较低。 佐剂辅助致敏可增强免疫激活作用,导致非过敏性蛋白诱导Th2 反应,有助于FA 小鼠模型的成功建立[7]。 本文主要阐述4 种常用的佐剂致敏物,氢氧化铝、霍乱毒素(cholera toxin,CT)、脂多糖(lipopolysaccharide,LPS)、金黄色葡萄球菌肠毒素B(staphylococcal enterotoxin B,SEB)。
1.1 氢氧化铝辅助致敏
氢氧化铝是经典的免疫激活剂。 研究发现通过对BALB/c 小鼠皮下注射1 mg 氢氧化铝佐剂与100 μg 花生粗提蛋白(crude peanut extract protein,CPE),共注射两次,间隔时间为3 周,第二次免疫1周后,皮下注射200 μg CPE 进行激发,成功获得致敏小鼠模型。 结果,该致敏小鼠出现与人类相似的临床症状,腹泻、精神萎靡、挠头搔耳、呼吸急促,肺泡灌洗液中肥大细胞、淋巴细胞、嗜酸性粒细胞数量都显著升高和血清中IgE 表达上升[8]。 研究提示,该模型采用去除脂肪和多糖类物质中的花生粗蛋白对小鼠进行致敏,其致敏性强,能反映花生作为食品引起的过敏反应。 氢氧化铝佐剂价格便宜和购买方便,但其配制方法繁琐, 对pH 值范围要求较高。 值得注意的是采用皮下致敏途径,因佐剂的吸收速度较慢会在注射部位引起较严重的局部反应,导致皮下注射后易形成肿块[9]。
1.2 CT 辅助致敏
Song 等[10]采用 CT 和花生对 C3H/HeJ 小鼠灌胃,结果出现腹泻、体温下降及血浆中组胺、嗜酸性粒细胞数量增加的过敏症状。 利用FAHF-2 药物对CT 辅助致敏的小鼠治疗,小鼠体温恢复正常、外周血中的组胺表达量和嗜酸性粒细胞数量明显减少[10]。
1.3 LPS 辅助致敏
Rodriguez 等[11]在第 0、7、14、21、28 和 35 天对BALB/c 小鼠进行桃蛋白prup 3 和LPS 腹腔注射,结果小鼠出现体温下降、呆滞、呼吸频率增加、IgE抗体水平升高等全身的过敏反应特征。 Th1/Th2 向Th2 偏移是产生过敏的关键因素,食物过敏时Th2型细胞活化增加,IL-4 的生成显著增多, 进而诱导B 细胞生成大量sIgE, 并诱发机体发生过敏性炎症反应[12]。 研究发现,佐剂可以增强某些蛋白质诱导Th2 反应作用,根据LPS 浓度调节反应趋向于Th1模式或增强Th2 反应的诱导[11,13-15]。
1.4 SEB 辅助致敏
SEB 与抗原一起使用可导致系统免疫反应。Ganeshan 等[16]每周1 次对小鼠灌胃100 mg 卵清蛋白(ovalbumin, OVA)和10 mg SEB,最终剂量为100 mL,持续 8 周,在第 9 周后,5 mg OVA 灌胃攻击,成功建立SEB 辅助OVA 致敏小鼠模型。 该小鼠模型血清中IgE、组胺水平升高,嗜酸性粒细胞数量增加、空肠组织出现水肿等临床过敏症状。 SEB 辅助致敏相对于CT 辅助致敏能促进嗜酸性粒细胞数量的增加,并且可通过降低剂量来促进花生的过敏反应[17]。
2 无佐剂小鼠模型
关于食物过敏原的性质以及造成患者缺乏或丧失耐受性的机制信息仍然不足,因此研究人员对无佐剂致敏小鼠模型进行了深入研究。 费巧玲等[18]采用含有OVA 的纱布贴于小鼠背部脱毛皮肤处,经皮肤成功建立小鼠肠道过敏模型。 无佐剂经皮致敏建立的小鼠模型不仅能增加过敏原特异性IgE 抗体的产生还能诱导肠道病理改变。 小鼠肠道过敏模型表现为直肠温度下降、空肠毛细血管炎性渗透、肠黏膜出现轻度糜烂,固有层可见较多肥大细胞聚集、伴随胞膜破裂、肠绒毛损伤,排列紊乱、断裂或缺失。 除了通过皮肤致敏还有无佐剂口服增敏方法,首先采用不含佐剂的80 mg 花生灌胃C3H/HeJ 小鼠,两周后腹腔注射30 mg 花生提取物腹腔注射,小鼠过敏反应表现为体温下降、血清中肥大细胞蛋白酶-1(Mast cell protease 1,Mmcp1)和花生特异性IgE 表达升高。 该模型提供了量化且客观的花生致敏指标,还原了人类食物过敏的方式,因为他们不需要用佐剂来塑造对食物的过敏性免疫反应[19]。
3 转基因小鼠模型
随着科学研究的深入,基因学改变了我们对包括过敏疾病在内的大多数生物学领域的理解。 转基因动物的出现有助于全面认识疾病的本质特点,并且逐渐成为研究人类疾病的发展规律和疾病防治机理的重要工具之一[20-21]。 本文主要探讨Was基因敲除小鼠、Il4rαF709 小鼠和CNS1 基因敲除小鼠三种基因工程小鼠。
3.1 Was 基因敲除小鼠
Snapper 等[22]建立了Was 基因敲除小鼠模型,并发现Was 基因敲除小鼠与Wiskott-Aldrich 综合征蛋白(Wiskott-Aldrich syndrome protein,WASP)缺陷的患者在轻度血小板减少、淋巴细胞减少、缺陷性T细胞活化、肠道固有层炎性细胞浸润、结肠隐窝囊肿等方面具有相同特征。 Lexmond 等[23]在特定食物致敏的不同背景下检测Was-/-小鼠血清中IgE,结果发现,在BALB/c 和C57BL/6 背景下的动物对结肠炎具有抗性,表明结肠炎症不会引起对摄入抗原的致敏。 多敏化是人类食物过敏的标志,可将WASP 缺陷型小鼠模型来定义潜在的多敏化机制。因此,条件删除FOXP3 + Treg 中的Was 导致Th2 型肠道炎症的食物过敏反应程度加重,相比于整体WASP 缺乏小鼠模型更显著,与临床症状相似[24],为研究T 细胞活化缺陷的过敏反应提供良好的动物模型。
3.2 Il4rαF709 小鼠
IL-4 和 IL-13 通过 IL-4 受体 α 链(IL-4Rα)在过敏性疾病中起关键作用。 通过采用苯丙氨酸替换709 位的酪氨酸残基,诱变 IL-4Rα 的抑制性ITIM 基序失活建立 Il4rαF709 小鼠[25]。 该模型破坏Treg 的功能,促进Treg 细胞向Th2 分化及细胞因子IL-4 的表达,形成Th2 介导的过敏反应。 经OVA致敏的Il4rαF709 小鼠出现过敏相关的临床症状,针对OVA 特异性IgE 增加,出现局部或全身性Th2介导过敏反应以及体温下降、腹泻等[26-27]。 病理组织观察发现该小鼠的小肠肥大细胞增殖和绒毛增生。 Il4rαF709 小鼠肠绒毛中粘膜肥大细胞数量较多,这个位置有利于与吸收食物蛋白相互作用,支持肠道肥大细胞扩增并驱动IgE 依赖性过敏反应。
3.3 CNS1 基因敲除小鼠
粘膜界面的促炎和消炎机制之间的平衡与防止过敏、哮喘和肠道炎症相关的不良反应密切相关[28]。 调节性T 细胞可防止粘膜界面特异性自身免疫和炎性病变。 CNS1 基因敲除小鼠通过破坏Treg 分化和功能促进对食物过敏原的致敏作用。非编码DNA 序列1(CNS1)在肠道相关淋巴组织中诱导Treg 的产生中发挥重要作用。 CNS1 基因敲除小鼠由于肠道抗原特异性Treg 细胞的缺乏,胃肠道的免疫平衡可能受到损害。 因此表现出体重下降、IL-4 表达增加,出现 Th2 型过敏反应[29-30]。 其中,CNS1 缺陷小鼠的血清抗体对小肠、大肠、胰腺与食物抗原具有反应性,整个胃肠道出现了不同程度的病变,如隐窝脓肿、胃炎、浆细胞肠炎等。
4 人源化食物过敏小鼠模型
人源化小鼠重建了人源免疫系统,能够更好的模拟人体免疫微环境,是研究免疫发病机制和疫苗开发的理想动物模型[31-33]。 人源化小鼠模型为食物过敏疾病提供可靠的医学研究。 本文介绍常用于食物过敏疾病的人源化小鼠模型,人胸腺植入NSG-SCF/GM-CSF/IL3 小鼠模型、肝和造血干细胞模型、人类免疫细胞或干细胞植入NOD-sciD-γ-/-小鼠和表达人免疫球蛋白E 受体(FcεRI)小鼠模型,研究食物过敏在人体内免疫机制。
4.1 人胸腺、肝和造血干细胞植入NSG-SCF/GMCSF/IL3 小鼠模型
研究发现,将人胸腺、肝和造血干细胞植入NSG-SCF/GM-CSF/IL3 小鼠后,人源化小鼠中人肥大细胞发育并产生于腹膜腔和周围组织,并启动具有包含人恒定区嵌合的IgE 导致小鼠被动皮肤过敏反应(passive cutaneous anaphylaxis, PCA)及被动全身性过敏反应(passive systemic anaphylaxis, PSA),用于研究人类 IgE 依赖性过敏反应[34]。 对 NSGSCF/GM-CSF/IL3 小鼠组织染色,发现小鼠的肺和脾中都含有较多人肥大细胞的标志物(人胰蛋白酶),该小鼠模型中的人类肥大细胞的表型与原代人类肥大细胞相似,并表达CD117、类胰蛋白酶和FcεRI,所以 NSG-SCF/GM-CSF/IL3 小鼠模型独特的优势在于肥大细胞可以进行脱颗粒,且可在体外培养用于其他研究[35]。
4.2 人类免疫细胞或干细胞植入NOD-sciD-γ-/-小鼠
NOD-sciD-γ-/-小鼠的特点是非肥胖糖尿病(non-obese diabetic,NOD),严重免疫缺陷(severe combined immunodeficiency,SCID),并且缺乏通用的γ 链(γc;IL-2Rγ)功能。 该小鼠没有小鼠 T 细胞和B 细胞,缺乏残留的NK 细胞活性,并且存在高植入人细胞的比率[36-37]。 Weigmann 等[38]通过腹腔注射来自过敏原供体的外周血单核细胞建立肠道炎症模型。 在细胞转移后三周,对肠道进行口服过敏原激发,并采用高分辨率视频微型内窥镜系统监测肠道炎症以及组织,发现小鼠肠道粘膜增多,肠壁增厚肥大、炎症细胞浸润等肠道炎症病变。 此模型小鼠建模具有可靠性且重现性好等特点。
4.3 FcεRI 小鼠模型
人类食管树突状细胞和小肠固有层FcεRI 是IgE 的主要受体。 Sallmann 等[39]建立了树突状细胞表面携带人的FcεRI 的人源化小鼠,并采用100 μg OVA 腹腔致敏,研究发现来自α-DC TG 小鼠的树突状细胞对IgE 具有强烈的结合力,同时FcεRI 依赖性增强以及体内发生了T 细胞活化的过程。 α-DC TG 小鼠OVA 特异性T 细胞增殖与野生型相似,体内 DC 上 IgE 与 FcεRI 的结合诱导对 Ag 特异性记忆 T 细胞的增殖。 Platzer 等[40]利用表达人 FcεRI小鼠,连续两次腹膜注射100 μg OVA 致敏,隔日连续3 ~6 次50 mg OVA 灌胃,发现小鼠出现较高的致敏反应。 小鼠肠部组织中肥大细胞特异性蛋白酶及数量、Th2 型细胞因子(IL-4 和 IL-13)和 DC 衍生的炎症介质迅速增加,其中肠和肠粘膜肥大细胞数量是用来评估食物过敏小肠的组织炎症程度;同时在这些实验性食物过敏的小鼠模型中,可分析IgE/FcεRI 结合对肠粘膜炎症反应。 该模型为研究IgE/FcεRI 介导的树突状细胞与过敏性炎症反应提供可靠小鼠模型。
5 结论
小鼠食物过敏模型可分为依赖佐剂模型、无佐剂模型、基因工程模型、人源化模型(表1)。 比较目前可用的食物过敏模型只能部分地模拟食物过敏疾病的特征,不能完全反应临床特征。 食物诱导和佐剂辅助的模型常用于研究食物过敏疾病,除了蛋白质本身的致敏性外,佐剂辅助也会影响蛋白质的免疫原性和过敏原性,此致敏方式较贴近实际生活中食物蛋白摄入的情况;人类IgE 具有高度的物种特异性,并且不会交叉与啮齿动物受体反应,转基因小鼠模型不仅可用于研究某一基因的改变在食物过敏疾病的发生和发展的重要性,还可获得能够对人的IgE 产生的过敏反应模型;人源化小鼠模型可以克服种族特异性,真实的模拟人类食物过敏,表现出更强的针对性,对免疫系统功能失调导致的疾病和新细胞亚群的发现及功能研究提供了很好的模型[41]。 这些小鼠模型为人类食物过敏发病机制、药物开发提供科学基础。

表1 食物过敏小鼠模型Table 1 Mouse model of food allergy
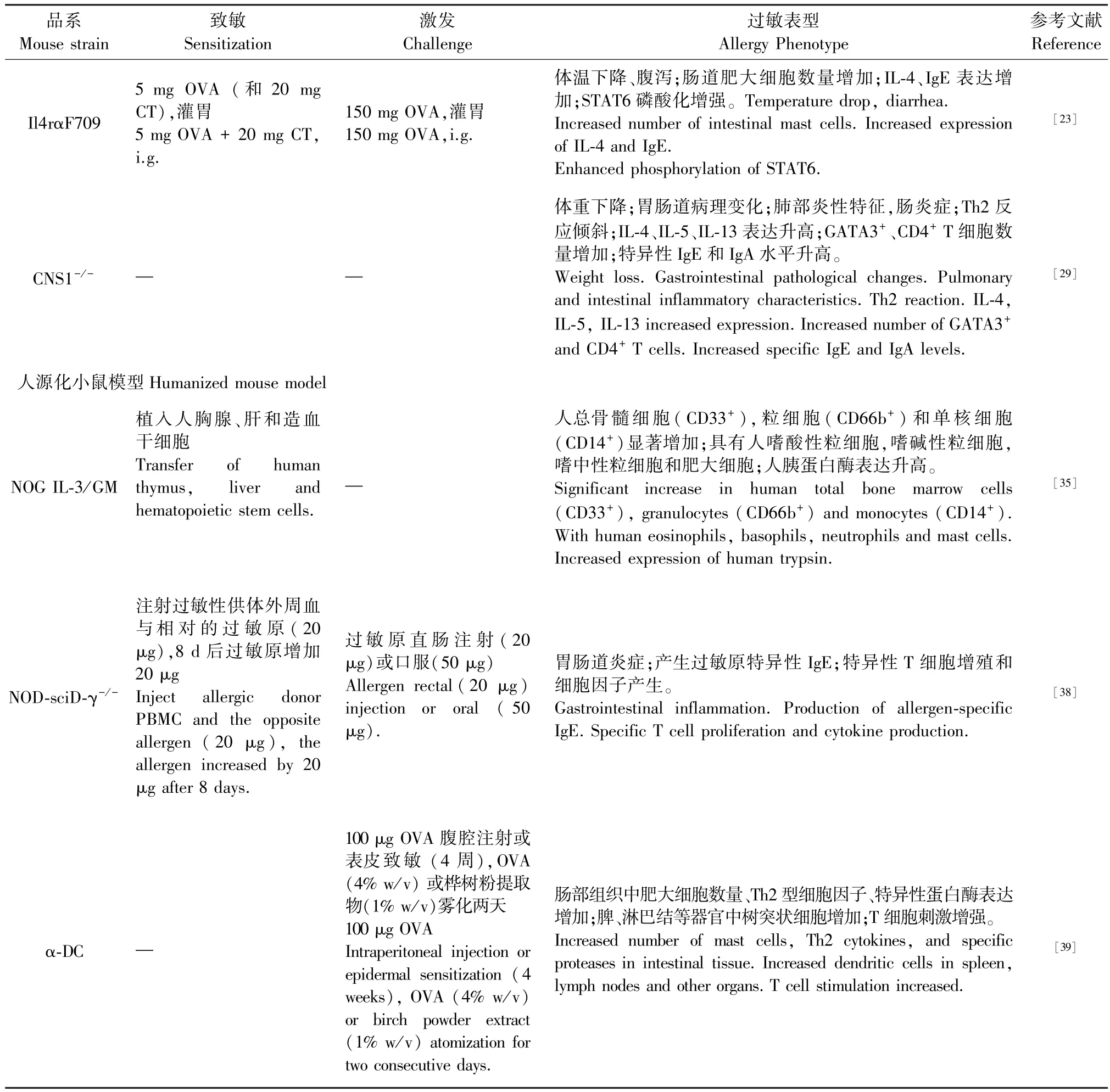
品系Mouse strain致敏Sensitization激发Challenge过敏表型Allergy Phenotype参考文献Reference Il4rαF709 5 mg OVA (和20 mg CT),灌胃5 mg OVA + 20 mg CT,i.g.150 mg OVA,灌胃150 mg OVA,i.g.体温下降、腹泻;肠道肥大细胞数量增加;IL-4、IgE 表达增加;STAT6 磷酸化增强。 Temperature drop, diarrhea.Increased number of intestinal mast cells. Increased expression of IL-4 and IgE.Enhanced phosphorylation of STAT6.[23]CNS1-/- ─ ─体重下降;胃肠道病理变化;肺部炎性特征,肠炎症;Th2 反应倾斜;IL-4、IL-5、IL-13 表达升高;GATA3+、CD4+ T 细胞数量增加;特异性IgE 和IgA 水平升高。Weight loss. Gastrointestinal pathological changes. Pulmonary and intestinal inflammatory characteristics. Th2 reaction. IL-4,IL-5, IL-13 increased expression. Increased number of GATA3+and CD4+ T cells. Increased specific IgE and IgA levels.[29]人源化小鼠模型Humanized mouse model NOG IL-3/GM NOD-sciD-γ-/-植入人胸腺、肝和造血干细胞Transfer of human thymus, liver and hematopoietic stem cells.注射过敏性供体外周血与相对的过敏原(20 μg),8 d 后过敏原增加20 μg Inject allergic donor PBMC and the opposite allergen (20 μg), the allergen increased by 20 μg after 8 days.─过敏原直肠注射(20 μg)或口服(50 μg)Allergen rectal(20 μg)injection or oral ( 50 μg).人总骨髓细胞(CD33+),粒细胞(CD66b+)和单核细胞(CD14+)显著增加;具有人嗜酸性粒细胞,嗜碱性粒细胞,嗜中性粒细胞和肥大细胞;人胰蛋白酶表达升高。Significant increase in human total bone marrow cells(CD33+), granulocytes (CD66b+) and monocytes (CD14+).With human eosinophils, basophils, neutrophils and mast cells.Increased expression of human trypsin.胃肠道炎症;产生过敏原特异性IgE;特异性T 细胞增殖和细胞因子产生。Gastrointestinal inflammation. Production of allergen-specific IgE. Specific T cell proliferation and cytokine production.[35][38]α-DC ─100 μg OVA 腹腔注射或表皮致敏 (4 周),OVA(4% w/v) 或桦树粉提取物(1% w/v)雾化两天100 μg OVA Intraperitoneal injection or epidermal sensitization (4 weeks), OVA (4% w/v)or birch powder extract(1% w/v) atomization for two consecutive days.肠部组织中肥大细胞数量、Th2 型细胞因子、特异性蛋白酶表达增加;脾、淋巴结等器官中树突状细胞增加;T 细胞刺激增强。Increased number of mast cells, Th2 cytokines, and specific proteases in intestinal tissue. Increased dendritic cells in spleen,lymph nodes and other organs. T cell stimulation increased.[39]