高尿酸血症及并其发症大鼠模型的建立
2020-09-09陈林军杨焱吴迪陈万超董国超乔徐馨吴春燕李婷婷
陈林军,杨焱,吴迪,陈万超,董国超,乔徐馨,吴春燕,李婷婷,3*
(1. 上海健康医学院医学技术学院,上海 200237; 2. 上海市农业科学院食用菌研究所,上海 201403;3. 上海海洋大学食品学院,上海 201306)
近年来,随着生活水平的提高,我国居民的生活习惯和膳食结构发生很大改变,高嘌呤和高糖食物摄入的不断增加。 我国高尿酸血症患病率已达13.7%,发病年龄呈低龄化,高尿酸血症及其并发症发病率呈逐年上升趋势。 尿酸是人类嘌呤代谢的最终产物,当血中尿酸水平大于420 μmol /L(7 mg/dL)时即定义为高尿酸血症[1-3]。 尿酸盐在关节腔和组织中沉积,进而引发痛风性关节炎、痛风性肾病,高尿酸血症已是当前影响人类健康的一种严重的代谢性疾病[4]。 因此建立稳定的高尿酸血症及肝肾损伤动物模型,对人类预防高尿酸血症、筛选相关治疗药物尤为重要。
人类由于缺乏尿酸酶,因而尿酸是嘌呤代谢的最终产物。 但是其他大多数哺乳动物体内固有尿酸酶,可将尿酸降解为尿囊素而随尿液排出体外,故大多数动物体内血尿酸值较低,建立高尿酸血症的动物模型是非常困难的[5]。 迄今为止,高尿酸造模方法存在观察周期较短,不稳定的问题,国内外尚无公认的高尿酸血症动物模型。 本研究采用给予尿酸酶抑制剂氧嗪酸钾,同时增加体内尿酸前体(次黄嘌呤、酵母)的量,以及高果糖摄入同时抑制肾小管尿酸的分泌联合造模的方法,通过五个动物模型组筛选大鼠血清尿酸升高并维持较长时间的建模方法。 通过大鼠血清中尿酸(uric acid,UA)、尿素(urea,Urea)、肌酐(creatinine,Cr)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)等水平的检测来考察与评价其建立持续、稳定的高尿酸动物模型的可行性,并同时对大鼠踝关节组织、肾组织形态学观察来比较不同高尿酸血症造模法对肾、踝关节继发性损伤的效果。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级雄性 Sprague-Dawley 大鼠(下称 SD 大鼠)48 只,(6 ± 1)周龄,体重(190 ± 10)g,购自上海西普尔-必凯实验动物有限公司【SCXK(沪)2019-0812】,饲养在上海健康医学院实验动物中心【SYXK(沪)2018-0029】,室温维持 25℃恒温,动物自由饮水及摄食。 所有操作均根据美国国家卫生研究院(NIH)发布的实验室动物护理和使用指南(8th Edition, 2011, ISBN 10: 0-309-15400-6)进行且均符合上海健康医学院动物实验伦理学要求(审批号:2019-HXXM-05-3048)。
1.1.2 试剂与仪器
氧嗪酸钾(Potassium Oxonate,PO,阿拉丁,P137112);次黄嘌呤(Hypoxanthine,H,H108384);酵母膏(Yeast extract,YE,Y110984);盐酸乙胺丁醇片(EMB,特一药业集团股份有限公司,国药准字H44023635);普通大鼠饲料(辽宁省沈阳前民动物实验饲料厂,GB14924.3-2010);氧嗪酸钾联合酵母混合饲料(2%氧嗪酸钾,12%酵母膏,定制于北京博泰宏达生物);尿酸试剂盒(尿酸酶法、CH0101054、迈克生物股份有限公司);尿素试剂盒(尿素酶-谷氨酸脱氢酶法、CH0101051、迈克生物股份有限公司)等。
离心机(eppendorf,centrifuge 5424,美国),全自动生化分析仪(HITACHI,7080 Automatic Analyzer,日本), PRECICE 全自动数字切片扫描系统(PRECICE 500,北京优纳科技有限公司,中国)。
1.2 方法
1.2.1 动物分组
将48 只雄性 Sprague-Dawley 大鼠(下称 SD 大鼠)随机分为6 组(每组8 只),分别为空白对照组(Control 组)、氧嗪酸钾组(OA 组)、氧嗪酸钾+次黄嘌呤组(OA+H 组)、氧嗪酸钾+酵母膏组(OA + YE组)、10%果糖+乙胺丁醇组(10% Fru + 0.2% EMB组)、2%氧嗪酸钾联合12%酵母特殊饲料组(OA PO组)。 所有动物适应生活环境,自由进食和饮水,1周后开始实验。
1.2.2 造模方法
Control 组给予正常饲养,OA 组给予250 mg/(kg·d)氧嗪酸钾腹腔注射,OA + H 组给予氧嗪酸钾 250 mg/(kg·d)联合次黄嘌呤 100 mg/(kg·d)腹腔注射, OA + YE 组给予氧嗪酸钾250 mg/(kg·d)腹腔注射联合酵母膏3.5 mL/(kg·d)灌胃,除OA PO 组喂食氧嗪酸钾联合酵母特殊饲料,10% Fru +0.2% EMB 组饮用果糖加乙胺丁醇的水外,其余组别SD 大鼠均摄取正常饲料和饮用正常水,造模方法详见表1。 每周尾部采血1 次,连续造模5 周。
1.2.3 检测指标及处理
采血前12 h 禁食、不禁水,每周对SD 大鼠尾部静脉抽血每只0.5 mL,37℃水浴30 min,以3000 r/min 离心 15 min,取血清 200 μL,按照尿酸、尿素、丙氨酸氨基转移酶和天门冬氨酸氨基转移酶试剂盒(maccura,上海)的操作说明,并采用自动生化仪测定血清中各生化指标的水平。
1.2.4 大鼠肾及关节病理组织学检查
大鼠处死后,取全肾及膝关节,全肾用生理盐水清洗后,浸泡在福尔马林溶液中固定。 SD 大鼠膝关节浸润EDTA 脱钙液中12 d,达到用针可以轻松刺穿的程度后,进行固定。 取肝、肾、膝关节组织进行脱水、石蜡包埋、制片(4 μm)、HE 染色、利用PRECICE 全自动数字切片扫描系统观察。
1.3 统计学分析
应用SPSS Statics 统计学软件进行统计分析,实验数据以平均值± 标准差()表示,组间比较采用单因素方差分析,以P<0.05 表示差异有显著性;P<0.01 表示差异极具有显著性。
2 结果
2.1 大鼠一般情况观察
空白组大鼠饮食正常,毛色光滑,反应灵敏,体重正常;5 个造模组随着时间的推移,体重相对空白对照组有明显减轻,毛色发黄,食量减少,排尿量明显增多,且1 月后造模组开始出现大鼠踝关节红肿等炎症,脚踝行动不灵活现象,且OA PO 组大鼠体重减轻最明显,精神萎靡,易怒,且脚踝肿胀程度明显高于其他造模组。
2.2 大鼠血清中尿酸值、尿素值变化
2.2.1 不同造模组大鼠血清中尿酸值变化
与空白组相比较,除OA PO 组外,其余模型组尿酸值总体没有升高反而略微有所降低,无统计学意义;建模 1 周,模型组 OA、OA + H、OA + YE、10%Fru + 0.2% EMB 与空白组接近,OA PO 组尿酸反而降低,可能是氧嗪酸钾作为一种尿酸酶的竞争性抑制剂,大鼠体内尿酸浓度快速升高时,可能反馈性促进尿酸酶的表达或者活性增加[6];建模5 周,OA PO 组尿酸值与空白组比较有显著的升高,且差值具有统计学意义;OA、OA + H、OA + YE、10% Fru+ 0.2% EMB 模型组与空白组相比较尿酸值持续降低,出现模型组尿酸值不升高反而降低的异常现象,可能与大鼠体内的尿酸酶活力反馈性升高有关。 (见表1)
2.2.2 不同造模组大鼠血清生化指标的比较
血尿素(Urea)与肌酐(Cre)都是反应肾功能的重要指标,丙氨酸氨基转移酶(AST)和天门冬氨酸氨基转移酶(ALT)是反映肝功能的生化指标[7]。造模5 周后,各组实验终点时血清生化指标见图1。造模组的血清肌酐和尿素氮水平明显低于健康对照组,氧嗪酸钾联合酵母特殊饲料组(OA PO 组)血清中肌酐、尿素水平大幅提升,伴有严重的肾损伤,血肌酐水平显示已经出现肾衰现象。 同时,丙氨酸氨基转移酶和天门冬氨酸氨基转移酶水平显著降低,说明肝也伴有明显损伤。 其他各模型组尿素氮和肌酐与对照组相比,氧嗪酸钾 + 次黄嘌呤组(OA+ H 组) 尿素水平有显著升高,肾出现严重损伤。氧嗪酸钾组(OA 组)、氧嗪酸钾+次黄嘌呤组(OA +H 组) 丙氨酸氨基转移酶有降低,肝出现损伤。10%果糖+乙胺丁醇组(10%Fru + 0.2%EMB 组)天门冬氨酸氨基转移酶水平降低,肝也出现损伤。

表1 每周各组大鼠血清中尿酸水平变化(μmol/L,n=8)Table 1 Changes of serum uric acid level in rats of each group every week(μmol/L,n=8)
2.3 大鼠肝及关节病理形态学观察
2.3.1 大鼠肝形态观察及HE 染色
大鼠肝组织大体标本见图2,肉眼观察可见,空白对照组肝为棕红色,包膜光滑,质地柔软;模型组肝颜色略微发黄,肝体积有增大,质地变硬,OA PO组较为严重。 大鼠肝组织HE 染色显示,空白对照组未见肝细胞脂肪变性,未见明显炎症性细胞浸润;模型组 OA 组、OA + H 组、OA + YE 组、OA PO组局部肝汇管区可见少量炎症细胞浸润,说明OA组、OA + H 组、OA + YE 组、OA PO 组对 SD 大鼠肾均有不同程度损伤,其中氧嗪酸钾混合饲料组损伤最严重。
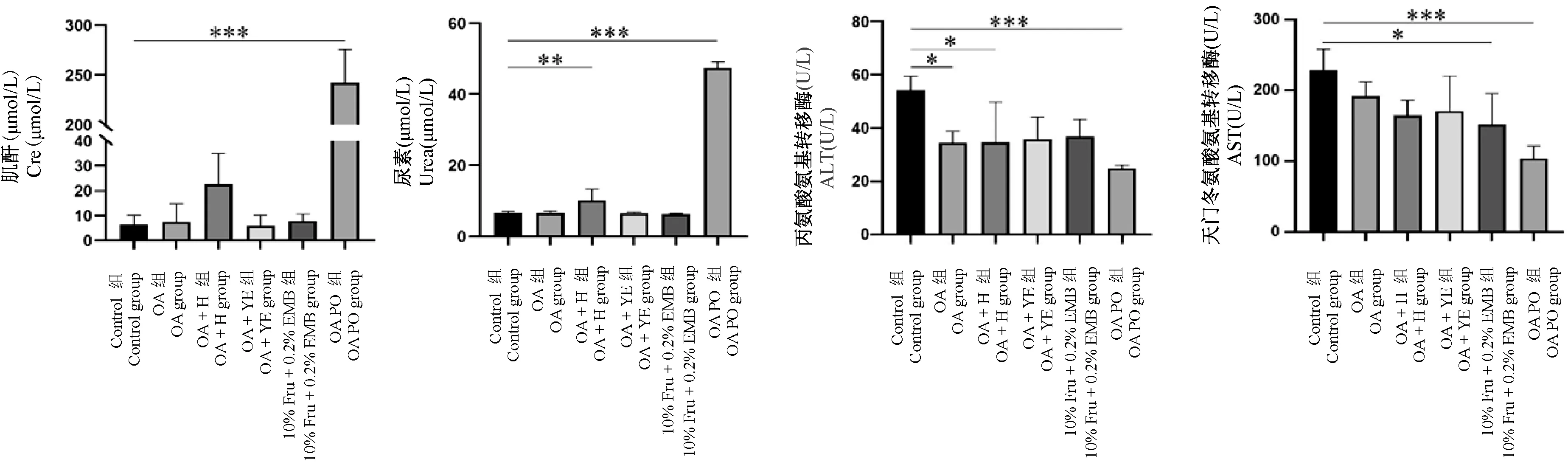
注:大鼠在实验终点时血清生化指标与Control 组比较,*P <0.05,** P <0.01,***P <0.001。图1 大鼠在实验终点时血清生化指标的比较Note. Compared with Control group, *P < 0.05,**P < 0.01,***P < 0.001.Figure 1 Comparison of serum biochemical indicators in rats at the end of experiment

图2 各组大鼠的肝及HE 染色病理切片(箭头:炎细胞浸润)Figure 2 Livers and HE stained pathological sections of rats in each group(Arrows indicate inflammatory cell infiltration)
2.3.2 大鼠肾形态观察及HE 染色
大鼠肾组织大体标本见图3,肉眼观察可见,空白对照组肾色暗红,表面光滑,外观无肿胀造;模组肾均有肥大,呈鼓型,肾色发黄,OA PO 组尤为严重,且外观表面细颗粒状。 对大鼠肾组织进行病理组织学检查,根据HE 染色显示,空白对照组大鼠肾结构正常,肾小球大小正常,肾小管结构清晰完整,无异变,无结晶积累,间质内未见异常; OA、OA +H、OA + YE 各模型组均出现肾小球内不同程度的尿酸钠盐结晶沉积,肾小管排列不规则不明显,OA + H组肾小管周围炎性细胞浸润;模型10% Fru + 0.2%EMB 组有少量的尿酸钠盐沉积,肾小管局部扩张;模型OA PO 组肾小球硬化,内有大量的尿酸钠盐结晶积累,间质严重扩张,所有肾小球发生病变,肾小管上皮细胞胞质空泡非常明显,说明OA 组、OA + H 组、OA + YE 组、OA PO 组对SD 大鼠肾都有不同程度损伤,且氧嗪酸钾混合饲料损伤最严重。
2.3.3 大鼠踝关节滑膜肌组织病理学观察
滑膜是关节囊内的一层很薄的组织,当关节内部受到刺激时,滑膜就会首先发生炎性反应,引起积液、发热肿大等症状运动表现欠佳,导致关节屈伸困难。 痛风性滑膜炎,正是因为尿酸结晶这一刺激物,沉积至滑膜所引起的[8]。 选取空白对照组及OA、OA + H、OA + YE、10% Fru + 0.2% EMB、OA PO 各模型组的踝关节滑膜肌进行病理组织学检查(图4),根据HE 染色显示,空白对照组大鼠关节滑膜 2 ~ 5 层排列规整、紧致、有序; OA、OA + H、OA+ YE、10% Fru + 0.2% EMB、OA PO 各模型组关节滑膜增厚,排列散乱、无序、松散,其中OA + YE 组有大量的中性粒细胞浸润,其他模型组有轻微炎症细胞,这与造模组大鼠脚踝出现红肿炎症表象一致。 虽然 OA、OA + H、OA + YE、10% Fru + 0.2%EMB 模型组尿酸值波动幅度小,且有几个时间段尿酸值有略微降低。 但是大鼠取材前已出现步态异常,踝关节肿胀,病理观察也出现炎细胞浸润等关节炎症状[9]。 吴燕升等[10]研究报道,氧嗪酸钾造模后,大鼠会出现一个短暂性的尿酸升高随后降低的现象,一般会在12 h 内恢复到正常水平。 所以我们推断由于大鼠体内尿酸酶的作用,OA、OA + H、OA+ YE、10% Fru + 0.2% EMB 这 4 个模型组 12 h 后大鼠血清尿酸值降低,检测不到高尿酸,但是踝关节已经出现痛风性关节炎症状。

注: 红色箭头:尿酸钠沉积结晶;黑色箭头:病变肾小管;蓝色箭头:病变肾小球。图3 各组大鼠的肾及HE 染色病理切片Note. Red arrow, deposition and crystallization of sodium uric acid. Black arrow, diseased renal tubules. Blue arrow,diseased glomeruli.Figure 3 Kidney and HE stained pathological sections of rats in each group

图4 各组大鼠踝关节滑膜肌组织HE 染色病理切片(圈出部分为大鼠踝关节滑膜组织)Figure 4 HE stained pathological sections of of ankle joints in rats of each group(Circled portion is synovial tissue from rat ankle)
采用氧嗪酸钾联合酵母特殊饲料组(2%氧嗪酸钾,12%酵母膏),第5 周已经达到维持较长时间的高尿酸水平。 通过肾组织、踝关节HE 染色,肾组织肾小球内有大量尿酸钠晶体沉积,肾小管上皮细胞可见明显的胞质空泡,排列紊乱,管腔扩张,说明肾损伤非常严重,关节滑膜略微增厚,排列散乱,少量中性粒细胞浸润。 与其他模型组相比,氧嗪酸钾混合饲料组血尿酸、血尿素、血肌酐、肾损伤效果都较为明显。 且建模方法更接近人类痛风疾病的发病机制,可以最大程度上的模拟临床上形成的痛风症状有利于研究人类高尿酸相关疾病的发病机制以及治疗药物靶点的设计。
3 讨论
建立高尿酸血症动物模型,主要通过增加尿酸来源、抑制尿酸排出、抑制尿酸酶的活性来进行[11-12]。 本实验建立了5 种造模方法,氧嗪酸钾组(OA)、氧嗪酸钾 + 次黄嘌呤组(OA + H)、氧嗪酸钾+酵母膏组(OA + YE)、10%果糖 + 0.2%乙胺丁醇组(10% Fru + 0.2% EMB)这四种造模方法均未能形成持续稳定的高尿酸模型,造模可行性较小。其原因可能是氧嗪酸钾所诱导的动物体内尿酸水平在一日内并不稳定,且SD 大鼠尾部静脉采血时间延时很长,不能保证在同一时间点给全部模型组采血,个体也存在差别,导致尿酸值有较大的差异。给予SD 大鼠氧嗪酸钾+酵母混合饲料,成功的诱导了大鼠高尿酸血症合并肝肾损伤模型。 大鼠体内存在尿酸酶,所以大鼠高尿酸模型往往存在不稳定的问题,氧嗪酸钾是目前国内外最常用的高尿酸血症造模药物。 Yukio 等[13]每隔两小时连续腹腔注射给予大鼠250 mg/kg 的氧嗪酸钾,可明显提高血中尿酸水平,但是尿酸值随后很快降低。 有报道称果糖可致血尿酸迅速升高,且果糖是目前唯一已知的可增加血尿酸的糖类,乙胺丁醇也可作为抑制尿酸排泄的药物[14]。 本实验使用了果糖联合乙胺丁醇造模,但是5 周依然没有成稳定的高尿酸模型。 本实验建立的氧嗪酸钾联合酵母特殊饲料的高尿酸模型,与人类痛风临床现象高度相似,大大提高了模型的稳定性以及可重复性,减少了灌胃、注射等实验难度,并且能更好的模仿人类高尿酸的发病过程,且该方法操作简便,稳定,易于操作。
本研究使用氧嗪酸钾、酵母膏等建立高尿酸血症动物模型,从生化以及病理学检查发现OA PO 混合饲料组尿酸值升高且维持较长时间,肾、心脏等器官发生病变,是一种高效、便利的高尿酸血症联合肾损伤的动物模型,极具研究价值和医疗用途前景。 据统计,我国高尿酸患者目前已经达1.2 亿,痛风患者8000 万人,且患病人数逐年增加[15-16]。 目前,国内外还没有有效的治疗痛风的药物,动物疾病模型在研究人类致病机理中起到了关键作用,该模型的建立对高尿酸药物的预防及药物的筛选及开发有着非常重要的意义。