异丙肾上腺素诱导心脏肥大大鼠的血清代谢组学研究
2020-09-09汤喜兰徐国良董伟李洪铭邱俊辉孙楠刘芳刘思宇李冰涛
汤喜兰,徐国良,董伟,李洪铭,邱俊辉,孙楠,刘芳,刘思宇,李冰涛*
(1. 江西科技师范大学药学院,南昌 330013; 2. 江西中医药大学中医基础理论分化发展研究中心,南昌 330004; 3. 江西中医药大学现代中药制剂教育部重点实验室,南昌 330004)
心脏肥大是心脏血流动力学压力和容量超负荷及神经体液因素等引起的主要病理生理反应,表现为蛋白质合成增加,肌节致密重组,心肌细胞体积增大,是各种心血管疾病心肌重构过程中的关键阶段。 持续的心脏肥大最终可导致心力衰竭,增加心血管疾病的发病率和死亡率,威胁人类健康[1]。因此,心脏肥大的发生机制是心血管疾病研究的重点。
异丙肾上腺素是一种β-肾上腺素能受体激动剂,可作用于心肌组织,引起心肌损伤、心肌梗死、心肌肥厚甚至心力衰竭等[2]。 异丙肾上腺素诱导的大鼠心脏肥大模型是心脏肥大药物评价的常用模型,尤其适用于研究心脏肥大过程中心肌结构和功能的适应性[3],受到国内外学者的持续关注。 代谢组学是一门新的组学研究技术,可以帮助我们了解各种心血管疾病状态下发生的整体代谢和心脏特异性代谢的变化,明确心血管疾病的分子标志物和代谢组学特征,已广泛应用于心血管疾病研究[4-5]。
本研究拟采用超高效液相色谱-四级杆-飞行时间串联质谱技术检测异丙肾上腺素诱导的心脏肥大大鼠血清代谢物的变化,通过主成分分析寻找潜在的生物标志物并进行代谢通路分析,探索心脏肥大大鼠体内的代谢变化,为心脏肥大的防治提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物
16 只 SPF 级 SD 雄性大鼠,5 ~ 6 周龄,体重200 ~220 g,由湖南斯莱克景达实验动物有限公司提供【SCXK(湘)2016-0002】,饲养于江西中医药大学实验动物科技中心屏障系统【SYXK(赣)2017-0004】。 饲养条件:温度(22 ± 2)℃,湿度 50% ±5%,12 h 光照/黑暗循环,自由摄食饮水。 所有操作均符合江西中医药大学动物实验伦理要求,满足3R原则(审批号:JZLLSC2017_0109)。
1.1.2 试剂与仪器
异丙肾上腺素(上海源叶生物科技有限公司,TP0395)。
XS203S 万分之一电子天平(瑞士梅特勒-托利多),TGL20 M 台式高速冷冻离心机(盐城市凯特实验仪器有限公司),安捷伦6538 A 超高效液相色谱-四级杆-飞行时间串联质谱(Ultra high performance liquid chromatography-quadrupole-time of flight mass spectrometry, UHPLC-Q-TOF-MS, Agilent, 美国),色谱柱为 ZORBAXExtend-C18 柱(2.1×100 mm,3.5 μm, Agilent)。
1.2 方法
1.2.1 动物分组与造模
16 只大鼠按体重随机分为正常组和模型组,每组各8 只。 参考文献[6],加以调整,给予模型组大鼠腹腔注射异丙肾上腺素30 mg/(kg·d),连续14 d建立大鼠心脏肥大模型。 正常组大鼠腹腔注射等体积生理盐水。 以心脏重量指数包括心脏重量与体重比值(HW/BW)、左心室重量与体重比值(LVW/BW)以及右心室重量与体重比值(RVW/BW)判断大鼠心脏肥大模型是否成功。 实验过程中,所有大鼠给予普通饲料进行正常饲养,每两天称重及更换垫料。
1.2.2 样本采集与制备
观察记录大鼠一般行为学变化,包括精神状态,被毛,饮食等。 末次注射异丙肾上腺素后,大鼠禁食不禁水12 h,次日早晨麻醉,腹主动脉取血,取心脏组织并称重。
血清样本的制备:血液4℃静置2 h,4℃离心10 min(3000 r/min),分离血清。 各取 100 μL 血清样本进行混合制备QC 样本。 从各血清样本(含QC)取100 μL 血清,加入甲醇 300 μL,涡旋混匀 30 s,4℃恒温静置3 h,离心15 min(15 000 r/min,4℃),取上清于1.5 mL EP 管,真空浓缩离心,加水-甲醇浓度(水 ∶甲醇 =85 ∶15)200 μL 复溶,涡旋混匀30 s,离心15 min(15 000 r/min,4℃),取上清于样品瓶,进样。
1.2.3 色谱和质谱条件
安捷伦UHPLC-Q-TOF-MS;色谱柱为ZORBAX Extend-C18 柱(2.1 × 100 mm, 3.5 μm,Agilent),流动相A 为 0.1%甲酸水,流动相B 为0.1%甲酸乙腈,进样量4 μL,柱温35℃,样品室温度4℃,流速0.4 mL/min,梯度洗脱条件:0 ~ 4 min,98% ~ 88%A,4 ~ 14 min,88% ~ 19% A,14 ~ 17 min,19% ~9% A,17 ~ 18 min,9% ~ 0% A,18 ~ 20 min,0% ~98% A,20 ~ 23 min,98% ~ 98% A。
质谱条件:正离子模式下采集谱图对前处理的样品进行分析,为保持仪器稳定性,精密度和重现性,使用仪器配套的参比液进行实时校正,采用Dual ESI 源,正离子模式下(4000 V),干燥气温度350℃,干燥气流速:10 L/min;扫描(Full Scan)方式,扫描范围:m/z 50 ~ 1200,喷雾室压力:35 psig;碎片电压:120 V;锥孔电压:60 V。 仪器使用参比自动校正,参比液以 5 μL/min 的速度通过自动传输入口,参比离子m/z 121.05973 和m/z 922.09798。
1.3 统计学分析
心脏重量指数采用Graphpad prism 6.0 进行统计分析,数据以平均值± 标准差(¯x ± s)表示,两组间比较采用t 检验,P<0.05 代表差异具有显著性。采用Profinder B.06.0 软件对原始质谱数据进行格式转换(转化为.cef 格式数据),数据导入MPP 软件进行峰提取、匹配、对齐和标准化处理,然后将处理后数据导入SIMCA-P 12.0 进行主成分分析(PCA)和偏最小二乘法分析(PLS-DA),以相关性系数[P(coor)>0.8]和变量重要性(VIP >1)为条件,进一步通过组间t 检验筛选差异代谢物(P<0.05),采用Human Metabolome Database (HMDB)数据库对差异代谢物进行定性,利用MetaboAnalyst 4.0 软件进行相关代谢通路分析。
2 结果
2.1 大鼠一般情况及心脏重量指数变化分析
正常组大鼠精神状态良好,毛发有光泽,体重稳定上升。 心脏肥大模型组大鼠精神萎靡,动作迟缓,毛发失去光泽,体重增长缓慢,明显低于正常组大鼠体重增长(见图1)。 与正常大鼠相比,模型组大鼠HW/BW、LVW/BW 及 RVW/BW 显著增加(P<0.05),见图2。
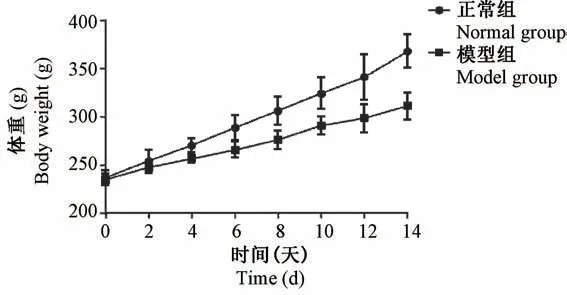
图1 大鼠体重变化Figure 1 Body weight changes in rats
2.2 大鼠血清代谢轮廓分析
图3 显示了正常组大鼠与模型组大鼠血清样本的总离子色谱图。 从两组总离子流图的血清样品分析中,可以看出样品出峰均匀,强度适中,说明此时液相质谱条件适合正常组及模型组的血清样品分析。
2.3 样品及设备稳定性分析
本研究采用QC 控制样品检测过程中样品及设备的稳定性。 采样前,运行1 次QC,采样过程中,每检测8 个样品运行1 次 QC,共运行3 次 QC 样品。图4 显示了3 次QC 样品总离子流图的叠加,可以看出主要样品峰的强度、保留时间都能重合,没有差异,说明样品检测过程中样品及仪器均稳定。
2.4 大鼠血清代谢物主成分分析
用主成分分析方法考察异丙肾上腺素对大鼠血清内源性代谢物质的影响,正离子模式下PCA 得分图显示正常组与模型组分离明显,组内聚集程度较好,提示与正常组相比,异丙肾上腺素诱导的心脏肥大大鼠内源性代谢物发生了显著变化(见图5)。
2.5 潜在生物标志物筛选
为进一步研究异丙肾上腺素诱导的心脏肥大大鼠血清中的内源性代谢物质,我们采用基于正交信号校正偏最小二乘法的U-plot 来初步筛选符合异丙肾上腺素诱导心脏肥大模型大鼠血清中内源性物质状态特征的生物标志物群,选择相关性系数大于0.8 且VIP 大于1 的变量作为候选生物标志物变量,并对两组中的候选生物标志物变量进行峰面积t检验,将P<0.05 的化合物作为差异显著的潜在生物标志物,结果见图6。

注:与正常组相比,*P < 0.05。 (图 7 同)图2 大鼠心脏重量指数比较Note. Compared with normal group,*P <0.05.(The same in the Figure 7)Figure 2 Comparison of rat heart weight index

图3 正离子模式下大鼠血清的总离子色谱图Figure 3 UHPLC-Q-TOF-MS spectra of rat serum samples in ESI+ mode
图4 QC 样本叠加总离子流图Figure 4 Superposition of total ion chromatogram of QC samples
2.6 潜在生物标志物鉴定
共得到13 个生物标志物,按照前期文献[7-8],采用HMDB 数据库来确定生物标志物,共鉴定出10个潜在生物标志物,3 个未通过鉴定。 10 个潜在生物标志物分别为鞘氨醇-1-磷酸、二高-γ-亚麻酸、D-果糖-1,6-二磷酸、脱氧腺嘌呤核苷、N-乙酰蛋氨酸、植物鞘氨醇、尿囊素、3-酮基-β-D-半乳糖、辛烷和甘油(见表1)。 与正常组相比,心脏肥大模型组大鼠血清鞘氨醇-1-磷酸和二高-γ-亚麻酸下调,其余8 个潜在生物标志物上调(见图7)。

注: :正常组; :模型组。图5 正离子模式下大鼠血清PCA 得分图Note. , Normal group. , Model group.Figure 5 PCA of metabolites in rats serum in ESI+ mode
2.7 生物标志物代谢通路分析
将鉴定的 10 个潜在生物标志物导入MetaboAnalyst 4.0 进行 Pathway Analysis 分析,结果显示生物标志物主要参与鞘脂代谢、甘油脂代谢、半乳糖代谢、不饱和脂肪酸的生物合成和嘌呤代谢(见图8)。

图6 潜在生物标志物筛选图Figure 6 Screening for the potential biomarkers in ESI+ mode
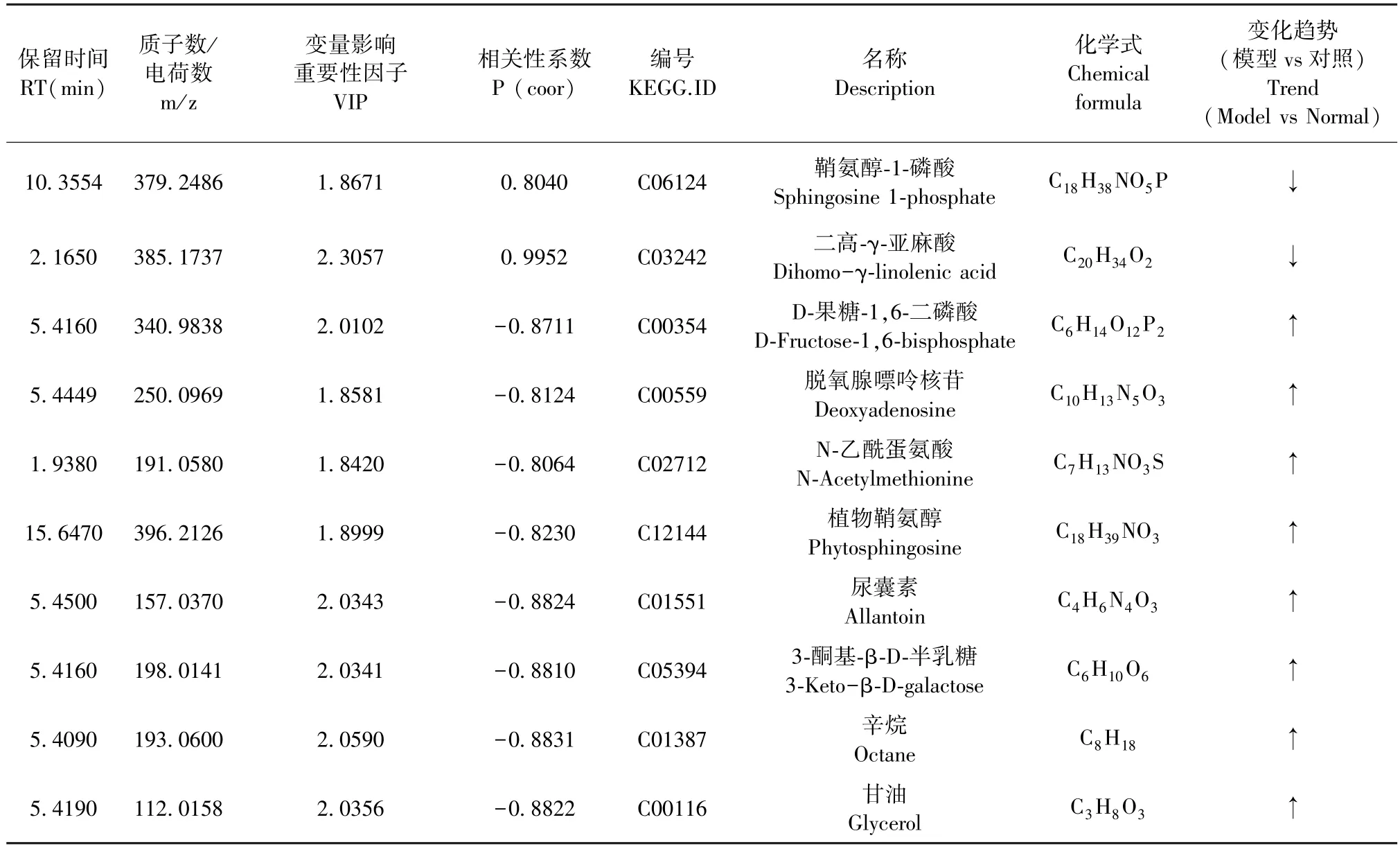
表1 异丙肾上腺素诱导心脏肥大大鼠血清潜在生物标志物Table 1 Potential serum biomarkers of cardiac hypertrophy rats model induced by isoproterenol

图7 潜在代谢标志物的相对含量变化Figure 7 Changes in the relative content of potential metabolic markers

图8 相关代谢通路Figure 8 Relevant metabolic pathways
3 讨论
本研究采用连续14 d 腹腔注射异丙肾上腺素30 mg/(kg·d)建立大鼠心脏肥大模型,研究结果显示,异丙肾上腺素诱导的心脏肥大大鼠的心脏重量、左心室重量和右心室重量显著增加,结果表明模型建立成功。 我们进一步基于UHPLC-Q-TOFMS 技术和数据分析,筛选出异丙肾上腺素诱导的大鼠心脏肥大10 个潜在生物标志物,涉及鞘脂代谢、甘油脂代谢、半乳糖代谢、不饱和脂肪酸的生物合成和嘌呤代谢等代谢通路。
鞘氨醇-1-磷酸和植物鞘氨醇的含量变化反映了鞘脂代谢改变。 鞘氨醇-1-磷酸(sphingosine 1-phosphate, S1P)是神经鞘磷脂经过多步酶促反应生成。 神经鞘磷脂在鞘磷脂酶的催化下生成神经酰胺,在神经酰胺酶的催化作用下生成鞘氨醇,在鞘氨醇激酶的催化作用下生成鞘氨醇-1-磷酸[9]。 S1P参与调节心肌细胞稳态,研究表明血浆S1P 尤其是高密度脂蛋白结合的S1P 含量与心血管疾病呈负相关,可能成为心血管疾病的潜在标志物[10-11]。Liu 等[12-13]研究表明异丙肾上腺素85 mg/kg 皮下注射诱导的大鼠心肌梗死模型和高胆固醇诱导的动脉粥样硬化家兔模型中血浆植物鞘氨醇含量显著升高,另外,植物鞘氨醇蓄积可能是心肌细胞缺氧复氧损伤最重要的特征,它促使心肌细胞线粒体通透性转换孔开放,导致细胞发生凋亡[14]。 本研究中异丙肾上腺素诱导的心脏肥大大鼠血清中S1P下调,植物鞘氨醇上调,与上述文献报道相一致。
心脏衰竭时,心肌糖脂代谢失衡,能量供应不足。 代谢组学研究表明心衰时与能量代谢相关的代谢途径如甘油脂代谢、半乳糖代谢、脂肪酸的生物合成及嘌呤代谢等会发生显著改变[15-16]。 本研究检测到异丙肾上腺素诱导的心脏肥大大鼠血清中糖脂代谢中间代谢产物甘油的含量显著上调,代谢通路分析结果表明甘油所参与的甘油脂代谢途径和半乳糖代谢途径都发生改变。 二高-γ-亚麻酸,属N-6 系列多不饱和脂肪酸,是生物合成前列腺素E1 的前体物质。 研究表明急性失代偿性心力衰竭患者血清中二高-γ-亚麻酸(dihomo-γ-linolenic acid,DGLA)含量、花生四烯酸(arachidonic acid, AA)含量和DGLA/AA 比值越低,存活率越低。 N-6 系列多不饱和脂肪酸水平[17-18],尤其是DGLA 含量和DGLA/AA 比值与急性心血管疾病和急性失代偿性心衰患者的临床预后显著相关[19]。 本研究发现异丙肾上腺素诱导的心脏肥大大鼠血清中DGLA 含量显著下调,进一步代谢通路分析结果表明不饱和脂肪酸合成代谢与异丙肾上腺素诱导的大鼠心脏肥大有关。 另外,心衰时嘌呤代谢也发生明显改变。王真真等[20]研究表明在冠状动脉结扎诱导的大鼠心衰模型中,心肌黄嘌呤氧化酶(xanthine oxidase,XO)表达显著上调,本研究发现在异丙肾上腺素诱导的大鼠心脏肥大模型中,血清脱氧腺苷含量显著增加,二者都体现了嘌呤分解代谢活跃的特点。 脱氧腺苷是腺嘌呤的一种代谢产物,其在心脏肥大发病中的作用尚有待进一步研究。
本文采用代谢组学的分析手段检测了异丙肾上腺素诱导的心脏肥大大鼠血清代谢物的变化,通过多元统计分析,确定了鞘氨醇-1-磷酸、二高-γ-亚麻酸、D-果糖-1,6-二磷酸、脱氧腺嘌呤核苷、N-乙酰蛋氨酸、植物鞘氨醇、尿囊素、3-酮基-β-D-半乳糖、辛烷和甘油10 个生物标志物,这些代谢物主要与鞘脂代谢、甘油脂代谢、半乳糖代谢、不饱和脂肪酸的生物合成和嘌呤代谢等途径有关。 本研究为探索心脏肥大的发病机制和诊断防治提供了实验依据。