氮磷形态对铜绿微囊藻的生长影响
2020-09-09周海东轩玉梅周姣岩
周海东,轩玉梅,胡 涛,周姣岩
(上海理工大学 环境与建筑学院,上海 200093)
蓝藻通常是富营养化湖泊浮游植物的优势种[1],大规模的蓝藻水华降低了水资源利用效能,引起严重的生态破坏及巨大的经济损失。目前,蓝藻优势形成的机理已经成为湖沼学研究的热点问题[2]。氮磷是藻类生长过程中所必需的营养元素[3],它们在水体中的含量直接影响藻类的生长,从而决定了水华的发生及可能形成的规模和程度,但对于氮磷等营养因子具体需要多少量才导致水华的发生,目前还没有定论。同时,在氮磷浓度相近的天然水体中,由于污染物来源、环境条件、水交换和动力条件的不同,会导致水体中氮磷形态出现差异。因此,研究不同的氮磷形态和浓度对浮游植物生长、繁殖的影响,对于明确水体中浮游植物优势种和进一步探讨富营养化水体中藻类暴发的机理具有重要意义。
在我国大部分富营养化水体湖泊中,铜绿微囊藻在数量和发生频率上尤占优势[4],本实验运用光照智能培养箱模拟自然环境,选择铜绿微囊藻作为实验藻种,研究了不同氮磷形态对藻类生长的影响,通过对铜绿微囊藻细胞密度及叶绿素a 质量浓度的实时测定来确定藻的生长状况,研究铜绿微囊藻对氮磷营养盐的响应,同时为淡水湖泊中蓝藻水华的暴发提供理论依据。
1 材料与方法
1.1 藻种及接种
实验所用蓝藻为铜绿微囊藻(Microsystems aeruginosa),购自中国科学院水生生物研究所(武汉)。藻种在实验前需进行扩大培养,提前培养1~2 周,取适量的待接种藻样以5 000 r·min-1速度离心15 min 后弃去上清液,向其中加入15 mg·L-1的碳酸氢钠溶液洗涤后再次离心,重复3~4 次,离心后的藻样经无菌水稀释后在无菌条件下接种,初始藻细胞密度约为106个·mL-1。
1.2 实验方法
培养液的配置以BG11 培养基为基础,首先以BG11 培养基中的NaNO3和K2HPO4为单一的氮源和磷源,质量浓度设置见表1,研究不用氮磷质量浓度对铜绿微囊藻生长的影响。然后依据NaNO3和K2HPO4对铜绿微囊藻生长影响的最优值研究NH4Cl、NaNO3、NaNO2和K2HPO4、β-G-P、ATP 等不同形态的氮源和磷源对铜绿微囊藻生长的影响。每组实验设三个平行样,取平均值。
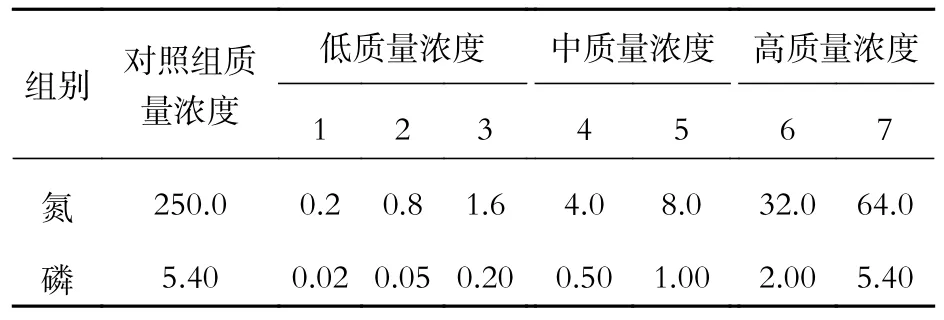
表 1 氮、磷单因子限制实验组中的氮、磷质量浓度Tab. 1 N and P concentrations under N or P limited conditions (mg·L-1)
实验容器选用250 mL 三角烧瓶,向其中各装入培养基100 mL,用1 mol·L-1的HCl 或NaOH调节pH 为8.0 ± 0.1,放置于光暗比为12 h:12 h、光照强度为2 000 Lux、温度为25 ℃的光照培养箱中进行培养。为避免光照不均匀,每天手动摇动4~5 次并将锥形瓶互相交换位置。每隔1 d 按时取样,测定铜绿微囊藻的光密度、叶绿素a 质量浓度及藻密度。
1.3 分析方法
1.3.1 藻细胞密度的确定
取一定量的实验藻种按一定的稀释倍数逐级进行稀释,利用血球计数板将稀释后的藻样进行细胞计数,得到相应的藻细胞数目。
1.3.2 叶绿素a 质量浓度的测定方法
取5 mL 实验液在5 000 r·min-1下离心5 min,弃去上清液,然后加入等体积的体积分数为90%的甲醇溶液混匀,放置在4 ℃黑暗条件下萃取6~8 h,离心取上清液在723N 分光光度计上测定665 nm 处的吸光度,根据式(1)进行计算,即

式中:c为叶绿素a 质量浓度;O665nm为波长为665 nm 时的吸光度。
1.3.3 比增长速率、相对生长常数、平均倍增时间的计算
比增长速率为

式中:μ为比增长速率;Xn、Xn-1分别为计数第n、n-1 天的藻细胞数目;Tn、Tn-1分别为对应于Xn、Xn-1的培养天数。
计算指数生长期内μ的平均值,将其作为该藻种在某一状况下μ的估计值。
相对生长常数K为

式中:Ot、O0分别为最终、最初的吸光度;t为培养时间。
平均倍增时间G为

2 结果与讨论
2.1 氮、磷质量浓度对铜绿微囊藻生长的影响
采用不同质量浓度的NO3--N 和PO43--P 培养基对铜绿微囊藻进行培养,分别测定藻样中叶绿a 质量浓度、藻细胞密度,以及不同NO3--N质量浓度下铜绿微囊藻比增长速率μ、最大比增长速率μmax、相对生长常数K和平均倍增时间G,结果分别如图1、2 和表2 所示。图1(a)中NO3--N 为低浓度时的铜绿微囊藻的藻细胞密度低于中、高浓度时的值;质量浓度为0.2 mg·L-1和0.8 mg·L-1实验组的铜绿微囊藻在第28 天前,生长趋势基本相同,但在第34 天后,0.2 mg·L-1实验组较0.8 mg·L-1实验组的藻细胞密度要高,说明低浓度仍可以保证铜绿微囊藻的正常生长。1.6 mg·L-1较8.0 mg·L-1的铜绿微囊藻的对数增长期更长。质量浓度为32 mg·L-1明显比64 mg·L-1培养时生长趋势更具优势,但是64 mg·L-1时在第16~24 天出现了停滞期,在第26 天生物量突然增加,说明其进入了第二个对数增长期,并且在两培养质量浓度下最大藻细胞密度较其余质量浓度下的都要大。从图1(b)中可知,不同NO3--N 质量浓度在实验初期(1~8 天)为铜绿微囊藻适应期,叶绿素a 质量浓度无明显区别。低浓度实验组中叶绿素a 质量浓度明显低于中、高浓度实验组的。质量浓度为4.0 mg·L-1时,叶绿素a 质量浓度同低浓度实验组的相似,均处于较低水平;质量浓度为8.0 mg·L-1时,叶绿素a 质量浓度在第18 天前并无明显增加,在第18 天后明显增加,在第24 天后突然增加,说明其进入了第二个对数增长期。高浓度实验组中叶绿素a 质量浓度的变化则一直呈现出显著增长的趋势,较其他浓度下的都要大。
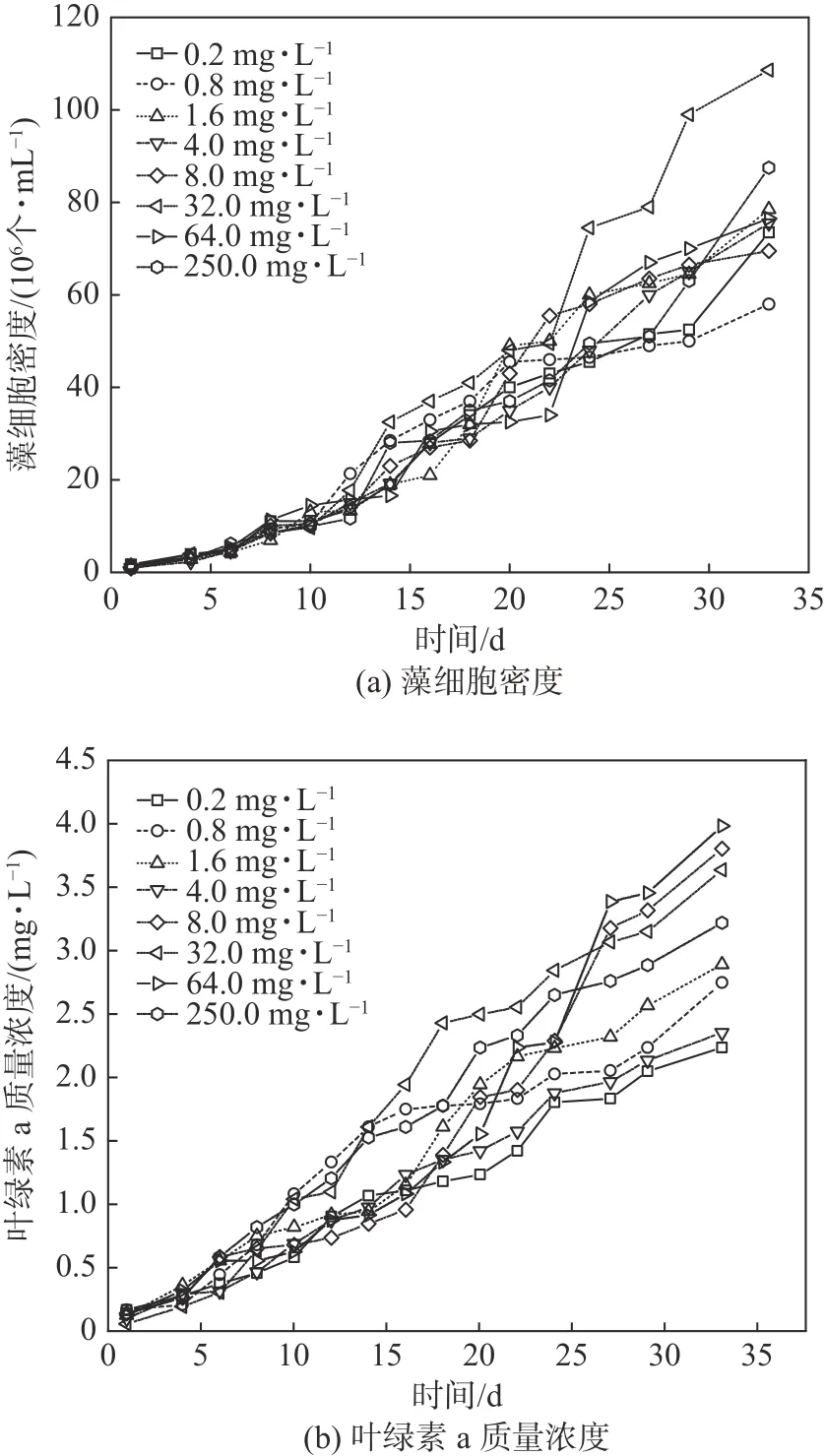
图 1 不同氮质量浓度下铜绿微囊藻生长状况Fig. 1 Growth of Microcystis aeruginosa under different concentrations of nitrogen
由图2(a)中发现,低浓度PO43--P 实验组的最大藻细胞密度相同,生长曲线相似。质量浓度为0.5~2.0 mg·L-1实验组的最大藻细胞密度接近,前期的生长曲线趋势也相似。质量浓度为1 mg·L-1的实验组在第12 天前生长极为缓慢,但在第12 天后细胞数量急剧增加。在第14 天前,各浓度下铜绿微囊藻的生长曲线均较为平缓,未出现明显的快速增长期。但在第14天后,低浓度实验组均出现对数增长期。随着细胞数增多,其生长出现了再次的突增,即进行了第二次的对数增长期[5]。由此看出,实验组均经历了两次蓝藻暴发,表明低浓度的PO43--P 可以使铜绿微囊藻正常生长,而中浓度比高浓度的PO43--P 更能促进铜绿微囊藻的生长。图2(b)中表示在不同浓度下的PO43--P 接种4 天后,各实验组进入不同程度的对数增长期。初期,质量浓度为5.4 mg·L-1实验组的生长趋势较缓慢,叶绿素a 质量浓度较低,铜绿微囊藻处于延滞期,但在第20 天后叶绿素a 质量浓度突然增加,进入对数增长期。质量浓度为0.02 mg·L-1时,前期叶绿素a 质量浓度较高,但在第24 天后,其增长趋势明显变缓,说明该浓度在后期无法提供足够的磷源以促进铜绿微囊藻形成叶绿素a;铜绿微囊藻在中、高浓度(0.5~5.4 mg·L-1)时最大叶绿素a 质量浓度比低浓度时高,说明高浓度的PO43--P 更有利于铜绿微囊藻中叶绿素a 的形成。综合各PO43--P 浓度下叶绿素a 质量浓度的变化,可以得出磷质量浓度为0.2、0.5 mg·L-1时最有利于叶绿素a 的形成,而高浓度(1~5.4 mg·L-1)并不利于叶绿素a 前期的形成[6],但在后期对叶绿素a 的形成有较强的促进作用。
由表2 中可知,在实验范围内,随着NO3--N质量浓度和PO43--P 质量浓度的增加,比增长速率增大,相对生长常数K 随着其初始质量浓度的提高而上升;而当NO3--N 质量浓度为 64 mg·L-1时,PO43--P 质量浓度大于 1.0 mg·L-1时,质量浓度的升高对藻类生长无太大的影响,且G 有延伸趋势。这说明在达到最佳质量浓度前,该藻的增长速率与营养盐的质量浓度正相关;超过最佳质量浓度水平后,随着营养盐质量浓度升高,增长速率将不再升高。从最大比增长速率来看,在NO3--N 质量浓度为0.2 mg·L-1时最大,32 mg·L-1时最小,但其增长速率较为平均,对数期较长,生长较旺盛,说明铜绿微囊藻在低浓度时瞬时增长速率较高,但是对数期后增长速率明显减小,因此最佳NO3--N 质量浓度为32 mg·L-1。PO43--P质量浓度为0.02 mg·L-1和0.5 mg·L-1时最大比增长速率最大,而质量浓度为5.4 mg·L-1时最小,且质量浓度为0.5 mg·L-1时,其平均增长速率也较大。因此,铜绿微囊藻生长最佳PO43--P 质量浓度为0.5 mg·L-1。
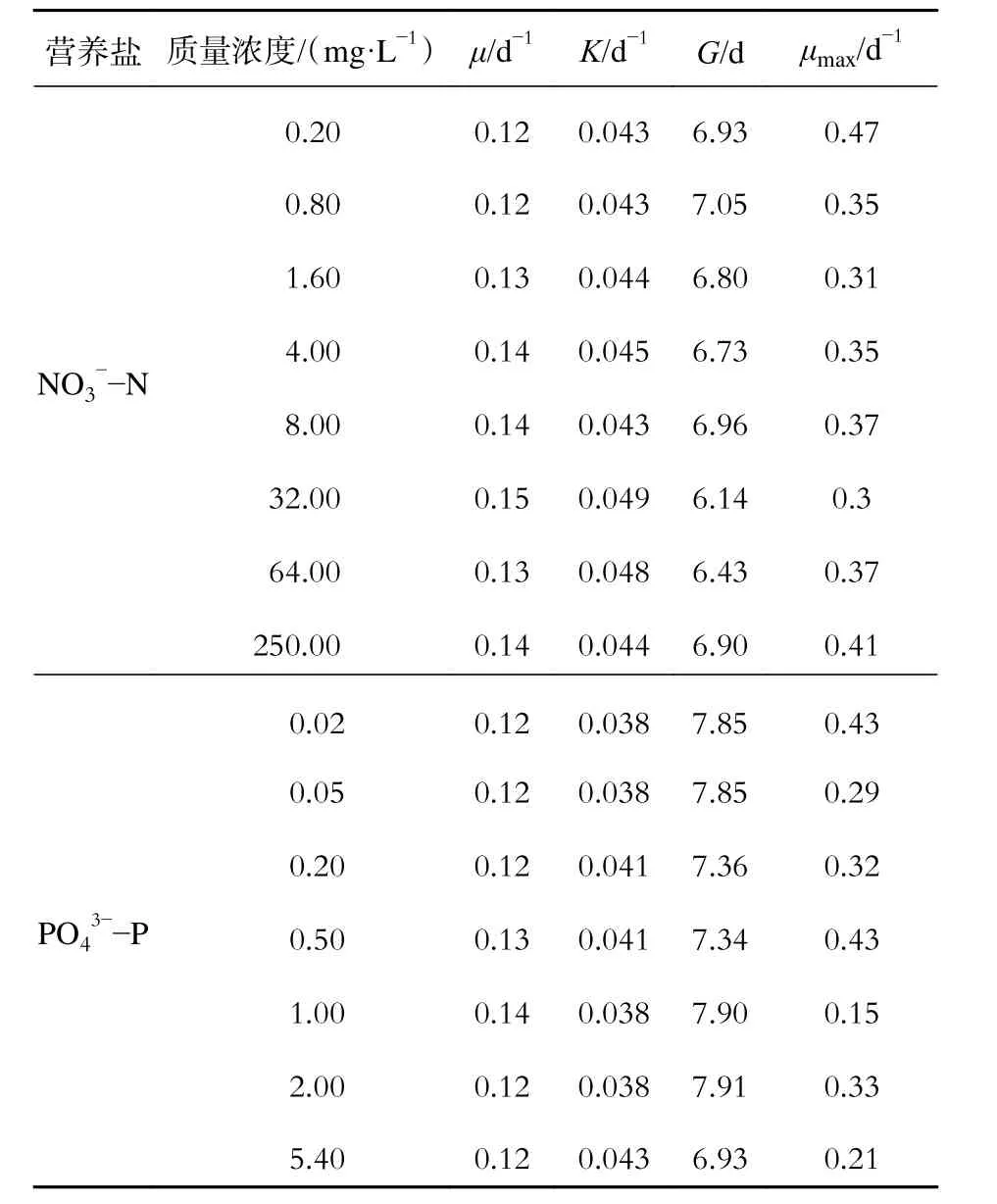
表 2 铜绿微囊藻在不同NO3--N 和PO43--P 质量浓度下的生长情况Tab. 2 Growth of Microcystis aeruginosa underdifferent NO3--N and PO43--P concentrations
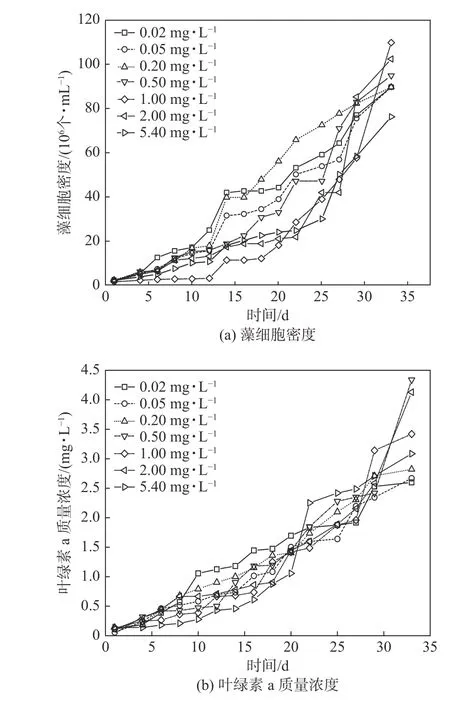
图 2 不同磷质量浓度下铜绿微囊藻生长状况Fig. 2 Growth of Microcystis aeruginosa under different concentrations of phosphorus
虽然不同的浮游藻类在其生长过程中对营养盐有各自不同的需求,但在多数湖泊中,浮游藻类的生长状况与水体中营养盐浓度变化的趋势一致;受条件限制,不同实验组的结果差异很大,一些研究证明水体中营养盐的增加会导致其中附着藻类的生物量、生产力的显著增加,而其他的则表明两者之间的相关性不显著。营养盐浓度对热带藻类生长影响的研究[7]表明,氮、磷营养盐浓度的增加对微囊藻的生长均有利,藻类的最大细胞产量均有明显的增长;磷浓度的增加对三种菌株中MC 藻的暴发和生长具有明显的促进作用。饲料磷含量高低对水质以及浮游生物组成的影响[8]探究结果显示,高磷含量(13.5 g·kg-1和8.4 g·kg-1)主要会引发铜绿微囊藻的暴发,而低磷含量(8.7 g·kg-1和11.4 g·kg-1)则主要会引发食用藻类的暴发,这表明磷含量的高低在一定程度上会决定铜绿微囊藻的暴发。Baldia 等[9]研究发现铜绿微囊藻的最佳生长氮磷质量浓度分别是8.71、0.22 mg·L-1;也有研究[10]表明,在BG11培养基中添加高浓度的氮(1 g·L-1NH4Cl)后,铜绿微囊藻的生长被显著抑制(相关系数P < 0.01),但同时添加不同质量浓度的磷(0.36~10 mg·L-1KH2PO4)显著提高了铜绿微囊藻的生长(P < 0.01),不同磷质量浓度处理之间无极显著差异,氮磷平衡是影响铜绿微囊藻生长的重要因素。本实验数据显示,适合铜绿微囊藻生长的氮磷质量浓度更高。值得注意的是,本实验和以上实验中营养元素的质量浓度是有差异的。这种差异表明氮磷质量浓度对藻类生长有共同的影响。有研究表明,水体中营养盐状态和浮游生物的光合作用活性之间存在着十分密切的相互作用[11]。由于叶绿素体是微藻进行光合作用的场所,而氮又是组成叶绿体的主要元素,因此,氮的缺乏势必会影响微藻的光合作用。由于磷元素参与多种物质代谢过程中酶的合成,故可溶性蛋白和碳水化合物的合成可能会受磷所占比例的影响。
2.2 氮磷形态对铜绿微囊藻生长的影响
以上不同质量浓度下NO3--N 和PO43--P 的研究可知,铜绿微囊藻生长的最佳氮质量浓度为32 mg·L-1,磷质量浓度为0.5 mg·L-1;在此质量浓度下研究了NH4Cl、NaNO3、NaNO2三种氮源和K2HPO4、β-G-P、ATP 三种磷源对铜绿微囊藻生长的影响,分别测定藻样中叶绿素a 质量浓度及藻细胞密度,结果如图2、3 所示。
图3(a)表明,在实验的前6 天三种氮源对于藻细胞密度的增长贡献极小,在第6 天后,均呈现出明显的升高,特别是在第10 天后以N 和NO2--N 为氮源培养下的藻细胞密度均呈现快速增长的趋势,但是NO3--N 氮源相对于N 氮源对于藻细胞密度的增长作用更为持久,并且较NO2--N 和NH4+-N 作为氮源对藻细胞密度的影响较大;而NH4+-N 对藻细胞密度的增长影响最为缓慢,后期藻密度仅为NO3--N 为氮源实验组的1/2。由图3(b)中固定质量浓度下氮源对于铜绿微囊藻叶绿素a 质量浓度的影响可知,在实验的前6 天三种氮源形态对于叶绿素a 质量浓度的变化一致;随着时间的延长,叶绿素a 质量浓度整体呈现增长趋势,在前20 天,NO3--N较NO2--N 对铜绿微囊藻中叶绿素a 的增长趋势较快,但在第20 天后,两者呈现相反趋势,表现为经NO2--N 处理的藻体内叶绿素a 质量浓度与经NO3--N 处理的相比要高,约为NH4+-N 实验组的2 倍;NH4+-N 处理的藻体内叶绿素a 质量浓度则一直以较为平缓的趋势增长,且一直低于NO3--N 和NO2--N 处理的藻体内叶绿素a 质量浓度,最终达到的质量浓度仅与NO3--N 和NO2--N 实验组培养到第24 天的持平。由以上分析可知,适于铜绿微囊藻在氮质量浓度为32 mg·L-1情况下生长的最佳氮源为NO3--N,依次为NO2--N 和NH4+-N。
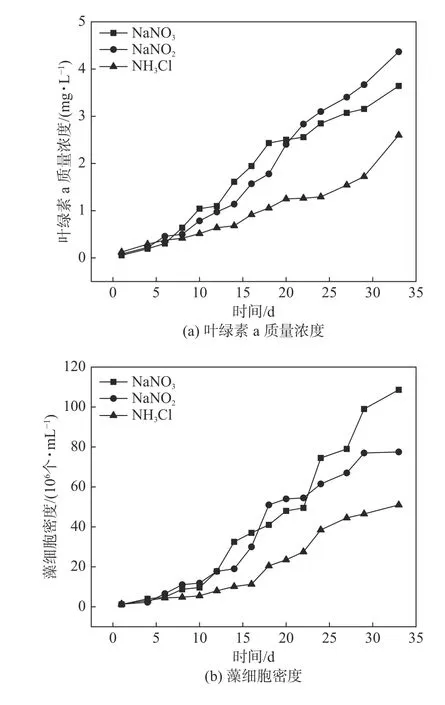
图 3 不同氮形态下铜绿微囊藻生长状况Fig. 3 Growth of Microcystis aeruginosa under different nitrogen species
由图4(a)中发现,在培养期的前12 天,三个实验组中铜绿微囊藻的藻细胞密度增长趋势相同且数值相近,第12 天后,三组均出现了明显的波动增长趋势;ATP 实验组在第26 天处于优势增长状态,但随着K2HPO4实验组在第22 天后的快速增长,最终K2HPO4实验组在第26 天后藻细胞密度超过ATP 和β-G-P 实验组,占据了优势生长状态;β-G-P 实验组在第22 天前的藻细胞密度高于K2HPO4实验组,随着K2HPO4实验组在第22 天后的变化,在培养后期β-G-P实验组的藻细胞密度则一直低于ATP 和K2HPO4实验组的藻细胞密度。图4(b)表现出三种磷源对培养的铜绿微囊藻产生的叶绿素a 质量浓度均表现出一个波动增长的过程,且三者的波动增长周期相近;培养前期,K2HPO4和β-G-P 实验组较ATP 实验组中铜绿微囊藻对于培养基的适应时间长,分别在第12 天、6 天和4 天后出现明显的增长趋势,且ATP 实验组对于藻内叶绿素a 质量浓度的增长一直处于优势状态;在培养24 天后,各实验组中叶绿素a 质量浓度表现出明显差异,β-G-P 实验组较K2HPO4实验组在后期对于铜绿微囊藻体内叶绿素a 的产生具有优势。总体而言,适于铜绿微囊藻在磷质量浓度为0.5 mg·L-1下生长的最佳磷源为ATP,其次为K2HPO4和 β-G-P。
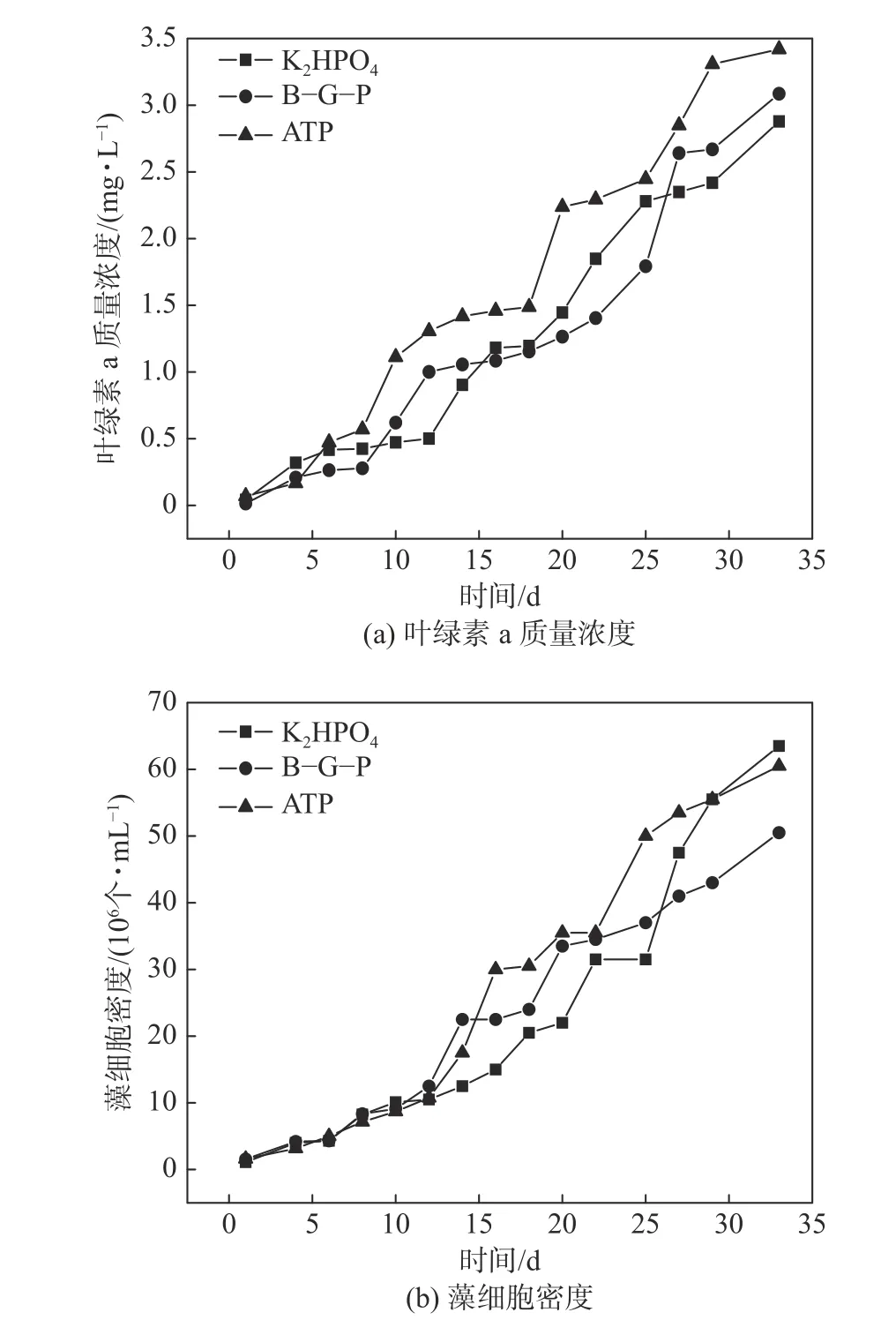
图 4 不同磷形态下铜绿微囊藻生长状况Fig. 4 Growth of Microcystis aeruginosa under different phosphorus species
氮磷是影响水体中浮游植物生长的重要限制因子,由于种属及质量浓度不同,藻类在对不同形态氮源和磷源的利用程度上也存在差异[12]。王正芳[13]在对蓝藻生长的氮磷影响及控制机理研究中发现,水体中总氮、总磷含量并不能作为藻华发生及控制的判别依据,氮磷的存在形态也起着关键作用。氮磷的不同形态、不同质量浓度均会对铜绿微囊藻的生长产生不同的影响,每种形态的营养盐对铜绿微囊藻的最佳生长状态的质量浓度是有所区别的,适宜藻生长的最佳氮磷形态为NO3--N 和PO43--P。在对不同的氮盐形态的研究中,多数研究都发现藻类会优先利用NH4CI,当水体中铵盐质量浓度高于硝酸盐1~2 μmol·L-1时,铵盐会抑制浮游植物对硝酸盐的吸收,且细胞中的硝酸还原酶也会受到抑制[3,14]。也有学者认为,微藻最容易利用的是铵态氮盐,因为铵盐可以在谷氨酰胺合成酶和谷氨酸合成酶的作用下,通过转氨基作用迅速合成氨基酸,直接被微藻所利用[15]。关于浮游植物对亚硝酸盐利用的研究一般会结合硝酸盐被还原的过程,因为在微藻吸收利用硝酸盐时会进行一系列转化:硝酸盐—亚硝酸盐,亚硝酸盐—铵盐,在此过程中微藻会释放一定量的亚硝酸盐。陈卫民[16]在研究亚硝酸盐对铜绿微囊藻生理特性的影响时发现,在亚硝酸盐单独存在的条件下,质量浓度小于5 mg·L-1的亚硝酸盐对铜绿微囊藻的生长没有明显影响,随着培养基中亚硝酸盐质量浓度逐渐升高到20 mg·L-1,亚硝酸盐通过抑制铜绿微囊藻的光合作用和升高藻体内氧自由基质量浓度的方式抑制藻的生长。对伊利湖的莫米、桑达斯基海湾以及圣大玛丽湖[17]中藻类水华的暴发与氮源关系的研究表明,铵离子质量浓度对蓝藻水华的暴发影响最大,蓝藻的生长速率最快;其次为尿素、氨基酸和丙氨酸对蓝藻暴发的影响;硝酸盐的影响则最弱,蓝藻增长速率最低;后期通过稳定同位素15N 的培养研究同样表明,蓝藻在其他氮离子存在的情况下,对于铵离子的吸收利用率最高。
在硝酸盐存在的条件下硝酸盐能够抑制藻对亚硝酸盐的吸收,并且亚硝酸盐还会被氧化为硝酸盐,表明此条件下可以诱导铜绿微囊藻生成亚硝酸氧化还原酶。亚硝酸盐的吸收实验显示在铵盐存在的条件下,藻对亚硝酸盐吸收的半饱和常数减少,表明铵盐能够刺激藻对亚硝酸盐的吸收,增加藻细胞内的亚硝酸盐含量。也有学者认为微藻细胞对硝酸盐的吸收能力要大于铵盐,因为在硝酸盐存在条件下微藻能更好地合成蛋白质。肖华山等以(NH4)2SO4、NH4NO3、NaNO3、KNO3、尿素分别作为氮源培养紫球藻(Porphyridium cruentum),结果发现,NaNO3和KNO3作为氮源有利于微藻合成蛋白质,而铵盐则不利于蛋白质的合成,并且NaNO3和KNO3缺乏时,细胞会停止蛋白质的合成。此外,王素琴等[18]的研究表明,在正常的培养条件下,与尿素和氯化铵相比,硝酸钾是促进小球藻(Chlorella)生物合成叶黄素的最佳氮源,小球藻细胞中的叶黄素含量可以达到0.85 mg·g-1。
关于藻类对有机磷的利用可能有两条途径:一是直接吸收利用,主要是对于小分子的有机磷;二是对于较大分子有机磷,则需经过如碱性磷酸酶等水解后吸收利用。在对不同磷盐形态的相关研究中已有实验表明,微小亚历山大藻(Alexandrium minutum)、铜绿微囊藻、湛江叉鞭金藻(Dicrateriazhanjiangenis)和小球藻等可以利用磷酸葡萄糖、磷酸甘油和ATP 等作为磷盐的来源[19-20],这说明许多浮游植物都能利用有机磷化合物作为营养物质来源。李英等[21]研究东海原甲藻对不同磷源的利用特征时提出东海原甲藻对ATP 和G-6-P 可能是直接吸收,而对G-P可能是第二条利用途径。除了胞外的磷酸盐对藻体生长有影响外,胞内磷酸盐也是影响藻生长的主要因子[22]。
本研究表明,铜绿微囊藻在不同形态的氮磷营养盐下均能够持续增长,并且随着培养时间的延长,培养基内营养盐质量浓度不断下降,但是铜绿微囊藻一直呈增长趋势,说明藻类在适应期后,体内积聚的营养物质有助于藻在后期的持续增长;对于不同形态营养盐所选取的培养期的质量浓度相同,这也从一方面表现出研究的局限性,即藻类由于在不同形态营养盐下生长所需的最佳质量浓度存在差异,因此也会对本实验结果存在一定的影响;此外,由于不同藻类对于生长所需的最佳营养盐形态以及营养盐质量浓度等存在差异,因此铜绿微囊藻的生长所需的营养盐质量浓度和最佳营养盐形态与其他藻类不同。
3 结 论
通过对氮、磷质量浓度与形态的研究可以发现:
(1)绿微囊藻在不同质量浓度NO3--N 培养下生长的最佳质 量浓度为32 mg·L-1;在质量浓度为32 mg·L-1下,NO3--N、NH4+-N 和NO2--N三种氮盐中,对于铜绿微囊藻生长最佳氮源为NO3--N,其次为NO2--N 和NH4+-N。
(2)绿微囊藻在不同K2HPO4质量浓度下生长的最佳质 量浓度为0.5 mg·L-1;在质量浓度为0.5 mg·L-1下,ATP、K2HPO4和 β-G-P 三种磷源中,对于铜绿微囊藻生长最佳磷源为ATP,其次为K2HPO4和 β-G-P。
