卵巢功能异常患者血清中AMH、FSH、PRL、FINS、睾酮、E2 的临床意义分析
2020-09-08周利娟常璐
周利娟,常璐
(许昌市中心医院产科,河南 许昌461000)
卵巢储备功能异常疾病的发病率明显的上升,部分地区的流行病学分析可见,卵巢储备功能异常疾病的发病率可超过485/1 万人左右[1]。 临床上的观察研究发现,卵巢储备功能异常疾病导致的多器官功能障碍或者不良心血管临床结局的风险也明显的上升[2]。 临床上缺乏对卵巢储备功能异常疾病患者病情评估的血清学指标,通过对相关血清学指标的分析研究,能够为临床上卵巢储备功能异常疾病的诊断和治疗工作提供参考。 抗苗勒氏管激素(AMH)是富含500 多个氨基酸的糖蛋白家族成员,作为转化生长因子家族成员,其能够通过影响到颗粒细胞的活性,参与到起始卵泡的募集和发育成熟过程,进而影响到卵泡的成熟和体内的性激素水平[3,4]。 部分研究者探讨了AMH 在多囊卵巢综合症(PCOS)患者中的表达情况,认为在PCOS 患者中,AMH 的表达可明显上升[5],但缺乏对于AM H的表达与其他性激素水平的关系研究。 为了揭示AMH 的表达与卵巢储备功能异常疾病的关系,本次研究选取2017 年1 月至2018 年6 月在我院治疗的PCOS 患者87 例,探讨了AMH 的表达,报告如下。
1 资料与方法
1.1 一般资料 选取2017 年1 月至2018 年6 月在我院治疗的PCOS 患者87 例,POF 患者62 例,纳入标准:⑴PCOS 诊断符合中华医学会制定的标准[6];⑵POF 诊断符合:40 岁以前至少有4 个月以上闭经,≥2 次血清卵泡刺激素(FSH)>40U/L,雌二醇(E2)<15pg/ml,泌乳素(PRL)正常,甲状腺和肾上腺功能正常;⑶患者及家属知情同意。 排除标准:⑴近3 个月使用过激素治疗; ⑵合并有肝肾功能障碍、恶性肿瘤、免疫系统疾病等。 同时选取健康女性80 例作为对照组,各组受试者年龄等一般资料比较差异无统计学意义(P>0.05),见表1。

表1 各组受试者一般资料比较
1.2 实验方法 采集患者入院后24h 内或者治疗后6~8h 内的肘部静脉血4ml,1500r/min 离心15min,收集上清液,在每个聚苯乙烯板中加入上述液体0.1ml,4℃过夜孵育,加入磷酸盐缓冲液(PBS)洗涤3 次,每次3min,在每个聚苯乙烯板孔中加入AMH 蛋白抗体(1:800 购自南京伯斯金生物公司),37℃孵育30min,加入磷酸盐缓冲液(PBS)洗涤3次,每次3min,每孔中加入TMB 溶液底物0.1ml,37℃20min,加入2M 硫酸0.05ml 终止反应,采用DG 5033A 酶标仪(南京华东电子科技公司)进行OD值检测。
在入院后第二天常规采集患者肘部静脉血4ml, 自然凝固后采集上层清亮液体,-20℃放置冰箱保存。 采用贝克曼库尔特公司生产的DX800 免疫发光仪器及配套试剂进行PRL、FINS 和T、LH、E2、PRL、FSH 等的检测,室内质量控制符合标准。
1.3 统计学处理 统计分析采用SPSS19.0 软件,计量资料采用(x±s)表示,多组间比较使用方差分析,两两比较采用LSD-t 检验;相关性采用Pearson 相关分析。 检验水准α=0.05。
2 结果
2.1 各组血清AMH、FSH 等指标比较 PCOS 组血清AMH、PRL、FINS 和T 水平明显高于正常组和ROF 组(P<0.05);ROF 组血清FSH 和LH 明显高于正常组和PCOS 组(P<0.05),而E2明显低于正常组和PCOS 组(P<0.05)。 见表2。
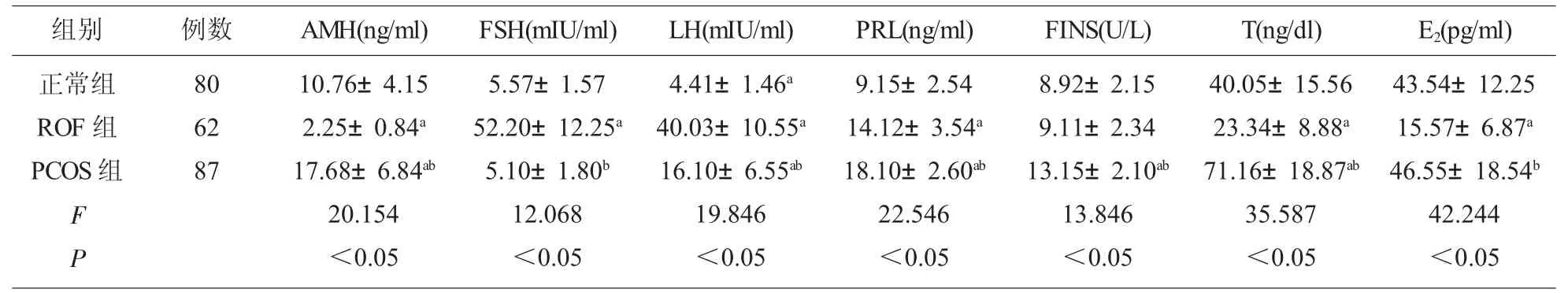
表2 各组血清AMH、FSH 等指标比较
2.2 ROF 组血清AMH 与其他指标相关性分析 将ROF 组血清AMH 与FSH、LH 等指标进行相关分析,结果显示:ROF 组血清AMH 与FSH 呈负相关(r=-0.544,P<0.05),其余指标未见相关性(P>0.05)。
2.3 PCOS 组血清AMH 与其他指标相关性分析将PCOS 组血清AMH 与FSH、LH 等指标进行相关分析, 结果显示:PCOS 组血清AMH 与LH、T、FINS 呈正相关 (r=0.346、0.411 和0.432,P<0.05),其余指标未见相关性(P>0.05)。
3 讨论
强烈的精神情感应激、手术创伤等,均能够促进卵巢储备功能异常疾病的发生,特别是在具有基础性下丘脑-垂体-卵巢轴功能障碍的患者中,卵巢储备功能异常疾病的发病率可进一步上升[7]。 临床上相关疾病的发生,能够在影响到患者性激素水平的同时,还能够增加心血管系统疾病或者其他代谢性疾病的发病风险,影响到远期不良临床结局的发生率[8,9]。 越来越多的研究发现,基础细胞因子或者分子生物学水平的改变,能够在卵巢储备功能异常疾病的发生过程中发挥重要的作用。 其中细胞因子的改变,能够在卵泡的发育成熟、起始卵泡的募集或者颗粒细胞的分化等过程中发挥作用。 而本次研究通过对于卵巢储备功能异常疾病患者体内AMH 的表达分析研究,具有下列方面的价值:⑴能够深入揭示临床上卵巢储备功能异常疾病的发病机理;⑵能够为临床上卵巢储备功能异常疾病的病情评估提供血清学参考指标。
AMH 是糖蛋白家族成员, 其能够通过其羧基末端的丝氨酸蛋白结构,诱导起始卵泡向生长卵泡的转换障碍,并影响卵泡对于卵泡雌激素(FSH)的敏感性,从而干预卵泡颗粒细胞的成熟和性激素囊泡的释放。相关研究也发现,AMH 的表达上升能够抑制卵泡细胞的募集,降低卵泡细胞内DNA 的修复损伤能力,进而导致卵泡生理功能的丧失[10]。 部分研究者探讨了AMH 在PCOS 或者卵巢早衰(ROF)患者中的表达情况,认为AMH 的表达上升与PCOS 患者的性激素水平的紊乱或者妊娠结局的改变密切相关[11],但缺乏对于AMH 的表达与卵泡刺激素(FSH)、泌乳素(PRL)、空腹胰岛素(FINS)和睾酮(T)的关系研究。
本次研究发现, 在PCOS 患者中血清AMH、PRL、FINS 和T 的表达浓度均明显上升,高于对照组及ROF 组, 比较差异有统计学意义, 提示了在PCOS 患者中存在明显的相关激素水平的波动,其中PRL、FINS 和T 的表达上升主要与雌激素负反馈调节的机制异常有关,而AMH 的上升主要由于卵泡颗粒细胞皮层损伤导致的细胞内糖蛋白的释放有关。 在ROF 患者中LH 及FSH 水平均明显上升,而E2 水平明显的下降,这主要由于ROF 患者体内E2 水平下降诱导的垂体促性激素相关成分如LH 或者FSH 的释放增多有关。谭容容等[12]研究者也发现,在PCOS 患者中,AMH 的表达浓度可上升40%~45%左右, 同时在病程较长或者性激素紊乱程度较高的患者中,AMH 的表达浓度可持续性的上升。 相关关系分析研究可见,ROF 组血清AMH 与FSH 呈负相关, 提示了AMH 的表达与性激素水平的关系,分析其基础方面的原因,考虑由于AMH 的下列几个方面的作用有关[13-15]:⑴AMH的表达上升能够影响到细胞色素P450 芳香化酶的合成, 进而导致患者体内性激素FSH 的水平波动; ⑵AMH 的表达能够通过影响到体内游离雌激素的转化活性,进而反馈性影响到FSH 的水平。最后本次研究还发现,PCOS 组血清AMH 与LH、T、FINS 呈正相关,提示了AMH 的表达与PCOS 患者的性激素水平同样存在密切的联系, 这主要由于AMH 的表达波动, 能够通过影响到性激素的代谢和转化速度,影响到性激素的结合状态,进而影响到LH、T 等激素的波动情况。临床上可以通过检测AMH 的水平,进而评估PCOS 患者的综合性病情。
综上所述,在PCOS 患者中AMH 的表达水平明显的上升,同时在PCOS 患者ROF 患者中AMH的表达与患者的性激素水平密切相关。
