两种养殖模式水质因子及微生物群落结构研究
2020-09-07张雷鸣原居林郭爱环练青平顾志敏
张雷鸣 ,原居林,倪 蒙,刘 梅,郭爱环,练青平,顾志敏*
(1.上海海洋大学 水产与生命学院,上海 201306;2.浙江省淡水水产研究所 农业部淡水渔业健康养殖重点实验室,浙江 湖州 313001)
【研究意义】水质管理是水产养殖过程中十分重要的环节,是养殖生物赖以生存的基础[1],水质的优劣受池塘水量、养殖生物、投喂饵料及生物代谢物等综合因素影响。因此,保持水质健康稳定,有效管理水质是养殖动物健康成长的关键[2]。池塘内循环流水养殖模式(internal-circulation pond aquaculture,IPA)是通过对养殖池塘进行工程化改造,形成高密度循环水养殖水槽和池塘生态粗养区相结合的新型复合养殖系统[3]。该系统在流水式养殖槽中精养鱼类,并收集处理精养区产生的残饵、粪便等固体废弃物。同时,利用粗养区构建水生态处理系统以提高池塘自净能力,从而维持良好水质,达到养殖用水循环利用。微生物群落在水域生态系统的物质循环和能量流动过程中发挥着重要的作用,其变化与水环境因子密切相关,能一定程度的反应水体的生态环境状况[4]。在养殖池塘中,微生物在有机物的分解、氮磷等营养元素的转化等过程中发挥着重要的功能,病原微生物的种类和数量也直接影响着养殖生物的健康和收益。【前人研究进展】目前,对池塘微生物群落的研究已有很多,有学者分别对团头鲂(Megalobrama amblycephala)[5]、吉富罗非鱼(Genetic Improvement of Farmed Tilapia)[6]、虾蟹贝混养池塘[7]微生物群落结构进行研究。【本研究切入点】但目前对IPA 模式微生物群落的研究尚未见报道。【拟解决的关键问题】本研究以加州鲈鱼(Micropterus salmoides)为研究对象,采用Illumina HiSeq2500 测序平台分别对IPA模式和UPA 模式微生物群落进行研究,从而更全面的分析IPA 模式的水域生态环境,为该模式的水质管理调控提出指导和参考。
1 材料与方法
1.1 实验地点与实验鱼
实验于2018 年5—12 月在浙江省湖州市某家庭农场进行,IPA 模式池塘面积20 000 m2,共有3 条长25 m×宽5 m×深2.5 m 的养殖槽,UPA 模式池塘面积为5 300 m2。在IPA 模式的3条养殖槽分别放养规格为(8.52±1.2)g/ind 的健康鱼种25 000 尾,在UPA 模式放养相同规格的鱼种共20 000 尾,确保单位面积667 m²养殖密度保持一致2 500 ind。
1.2 水样采集和处理
从2018年5月开始对池塘的水质进行监测,每15 d采集1次水样,到2018年12月结束共采集11次。IPA 模式水样采集点在每条养殖槽后端和生态粗养区,在各个采样点用5 L 的采水器采集不同深度水样合计15 L 的水样混合均匀后各取250 mL 样品;UPA 模式采用五点法采集样品。水温和pH 现场测定,其它理化指标带回实验室测定。另外,在每条养殖槽后端和传统养殖池塘采取水样,每个水样0.5 L,立即用孔径为0.22µm 的醋酸纤维素滤膜过滤收集水体中的微生物。将过滤好的滤膜保存在灭菌的50 mL离心管中,-20 ℃保存用于微生物宏基因组DNA的提取。
1.3 水样微生物宏基因组DNA的提取
采用酚氯仿法提取水样微生物宏基因组DNA,之后采用细菌基因组提取试剂盒(Solarbio,北京)的方法过柱处理。提取好的DNA 采用Nanodrop 2000(ThermoFisher,美国)测定其浓度,将合格样品(OD260/280=1.8~2.0,浓度≥50 ng/µL,总量≥2 µg)送至生工生物工程(上海)股份有限公司进行高通量测序。
1.4 数据处理与分析
采用Illumina HiSeq 测序平台进行高通量测序分析,通过barcode 区分样品序列,并对各样本序列做QC,然后去除非特异性扩增序列及嵌合体。利用Usearch软件RDP classifier贝叶斯算法对97%的相似度水平下的OTUs 进行生物信息统计分析,将所有样本序列按照序列间的距离进行聚类,后根据序列之间的相似性将序列分成不同的操作分类单元(OTU)。根据OTUs 聚类结果,对每个OTU 的代表序列进行注释,根据物种注释结果,在门、纲、目、科、属级别上生成物种相对丰度柱形累加图。分别统计4个样品中均存在的OTU,找出其核心微生物菌群(core microbiome)。同时,结合环境因素进行典范对应分析(CCA),得到显著影响微生物群落变化的环境影响因子。结合环境因素进行CCA分析,筛选水生动物常见潜在病原微生物,得到显著影响潜在病原微生物群落变化的环境影响因子。使用mothur计算α-多样性指数,包括Shannon,Simpson,Chao1,ACE指数。
2 结果分析
2.1 渔获物
结果表明,IPA模式和UPA模式在养殖开始时加州鲈鱼的单位面积重量相同,都为168.75 kg/hm2,养殖结束时IPA 模式的加州鲈鱼单位面积质量为12 174.5 kg/hm2,小于UPA 模式大口黑鲈养殖结束时的单位面积质量15 424.5 kg/hm2。
2.2 水质因子
两个不同养殖模式总氮含量变化趋势一致,9月1日开始升高,在11月1日含量达到最高,之后含量有所回落;IPA 模式总磷的含量变化比UPA 模式更稳定,UPA 模式的总磷含量在实验期间一直高于IPA模式,且波动较大,两个养殖模式的总磷含量都是10 月15 日最高;UPA 养殖模式总氨氮含量一直高于IPA模式,且总氨氮含量最高值都出现在10月份;在养殖初期到9月份,UPA养殖模式高锰酸盐指数含量高于IPA模式,9月份之后IPA模式含量高于UPA养殖模式,且两个模式最高含量都出现在11月份;两个养殖模式亚硝态氮含量趋势基本一致,在10月份最高后又迅速降低回落;两个养殖模式总有机碳含量变化趋势基本一致,在10月份达到最高;养殖期间,IPA模式的溶氧含量一直高于UPA模式;IPA模式的pH值在养殖初期高于UPA模式,9月15日之后,两模式的pH值趋向一致(图1)。
2.3 高通量测序数据
IPA 模式和UPA 模式2 个水样经高通量测序后共得到93765 条可用于分析的序列(total seq),包含8 137 条嵌合体序列(chimeras),9 条非靶区域序列(out target),946 条对比到细胞器组织序列以及84 673条可用于构建OTUs的处理后剩余序列(表1)。
2.4 IPA模式水体细菌群落结构特征
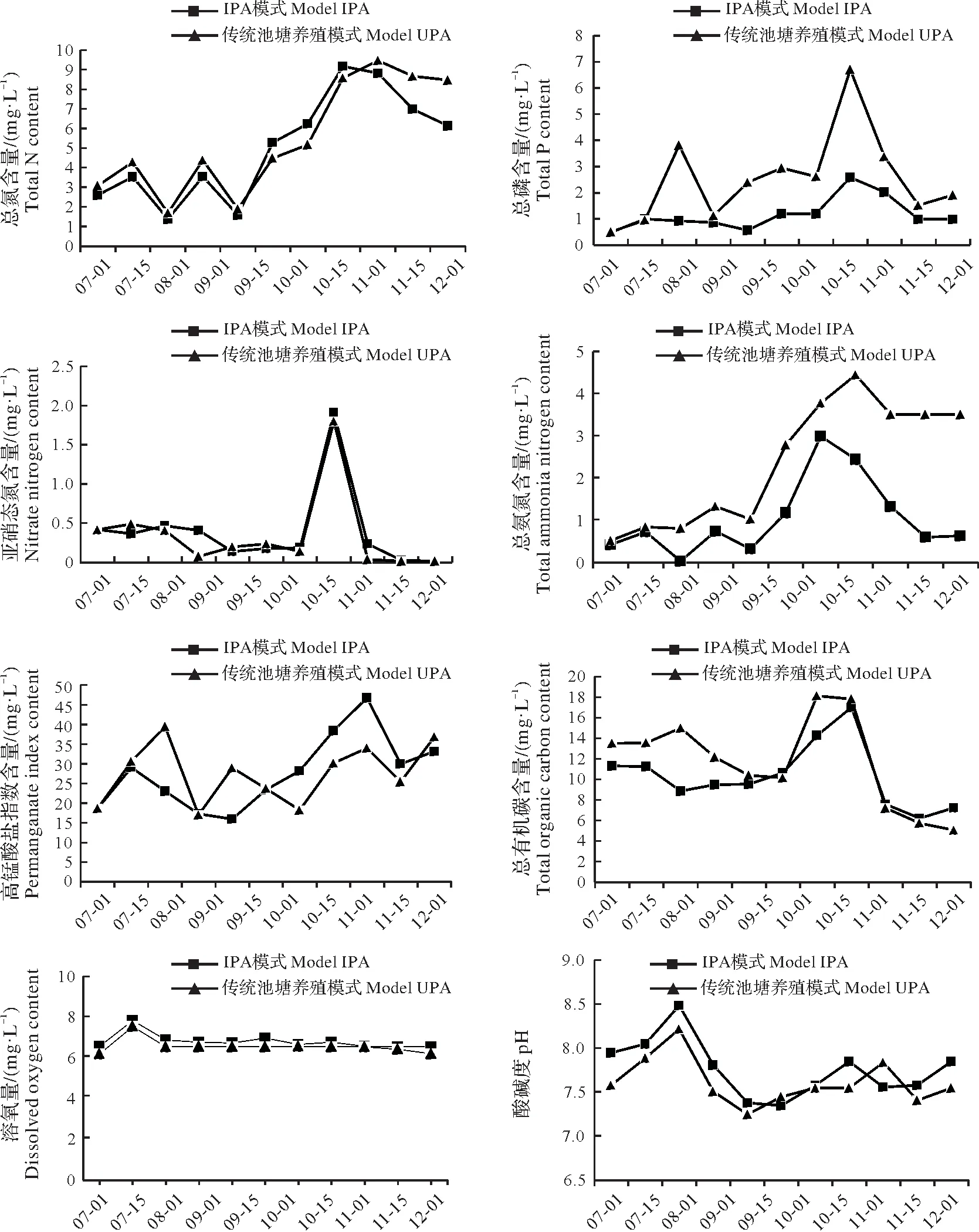
图1 IPA模式养殖槽和UPA模式水质因子变化Fig.1 Ranges of the water quality factors in model IPA and model UPA

表1 去除嵌合体与靶区域外序列统计Tab.1 Elimination of chimera and target region sequence statistics
图2表明了各样品“门”水平的细菌群落组成情况。A1样品优势菌群为放线菌门、变形菌门、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflex)、candidate division WPS-2、厚壁菌门,相对丰度分别为25.98%、20.55%、17.78%、11.67%、11.07%、5.61%;A2 样品优势菌群为酸杆菌门、变形菌门、放线菌门、厚壁菌门,相对丰度分别为29.59%、29.11%、14.88%、5.96%、5.25%。优势纲中A1 的第一优势纲为放线菌纲(Actinobacteria),其次为未确定纲(unclassified)、酸杆菌门中的Acidobacteria_Gp1纲和α-变形菌纲(Alphaproteobacteria),相对丰度分别为25.97%、17.69%、12.48%、10.89%;A2 的第一优势纲为Acidobacteria_Gp1纲,其次为放线菌纲、α-变形菌纲和未确定纲,相对丰度分别为15.05%、14.82%、13.74%、12.48。A1、A2的优势目除未确定目外,都为放线菌目,相对丰度为17.86%、10.02%;A1 样品的优势科为未确定科(37.26%)和Acidimicrobineae_incertae_sedis 科(9.78%);A2 样品的优势科为未确定科(40.45%)和链霉菌科(Streptomycetaceae)(7.17%)。
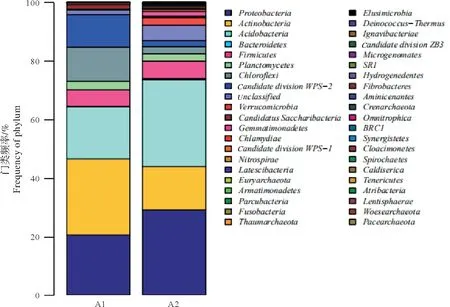
图2 两种模式池塘水体“门”水平的细菌群落组成Fig.2 Composition of bacterial community at phylum level of pond water in mode IPA and model UPA
图3表明了各样品“属”水平的细菌群落组成情况。A1、A2的优势属均为未确定属(unclassified),相对丰度分别为33.16%和29.24%;A1中WPS-2_genera_incertae_sedis、Aciditerrimonas、Gp1、纤线杆菌属(Ktedonobacter)同样占有较大比例,其相对丰度为:11.07%、8.01%、4.47%、3.8%;而在A2 中除第一优势属外,Gp1、Gp2、嗜酸链霉菌属(Streptacidiphilus)、WPS-2_genera_incertae_sedis同样占有较大比例,其相对丰度为:14.02%、5.48%、4.8%、2.07%;两种模式中主要潜在病原微生物及其含量如表2 所示。由表2 可以看出两种模式中潜在病原微生物种类及数量极少。
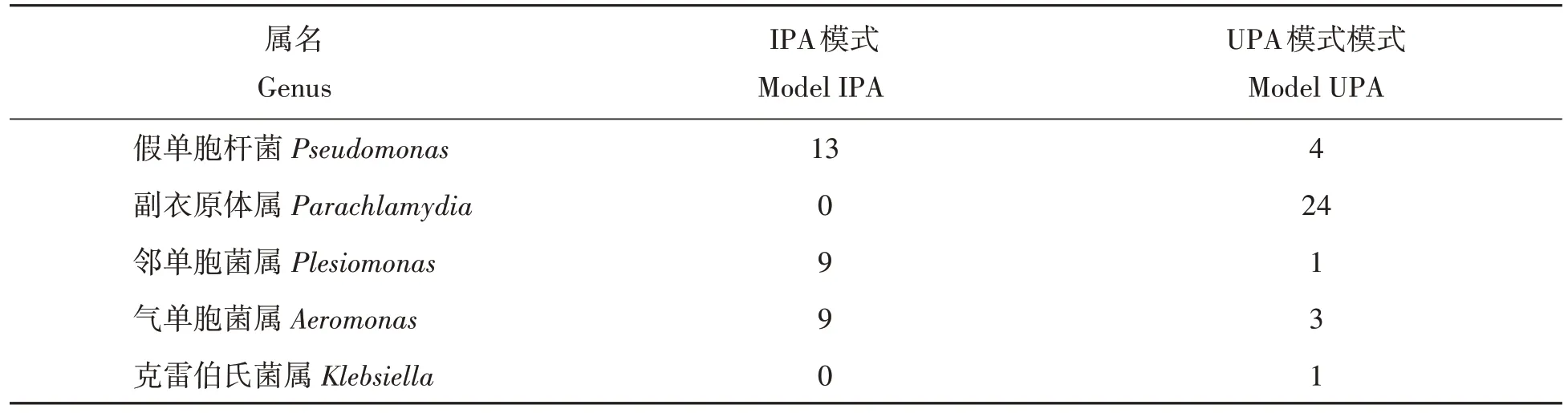
表2 两种模式水体中潜在病原微生物种类及含量Tab.2 The difference of harmful pathogenic bacteria among model IPA and model UPA
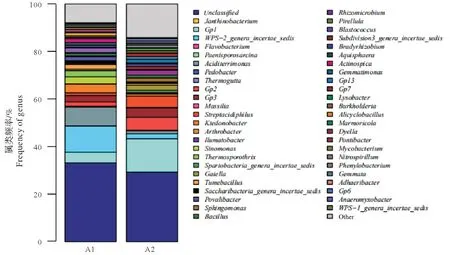
图3 两种模式池塘水体“属”水平的细菌群落组成Fig.3 Composition of bacterial community at genus level of pond water in mode IPA and mode UPA
2.5 水体微生物群落的多样性分析
表3 显示了IPA 模式和UPA 模式微生物群落多样性状况。结果表明,IPA 模式的Chao1 指数和ACE指数(1 524.74 和1 607.31)均低于UPA 模式(2 635.61 和2 723.95);而IPA 模式Shannon 多样性指数(6.30)高于UPA模式(5.22),IPA模式Simpson指数(0.02)高于UPA模式(0.01)。
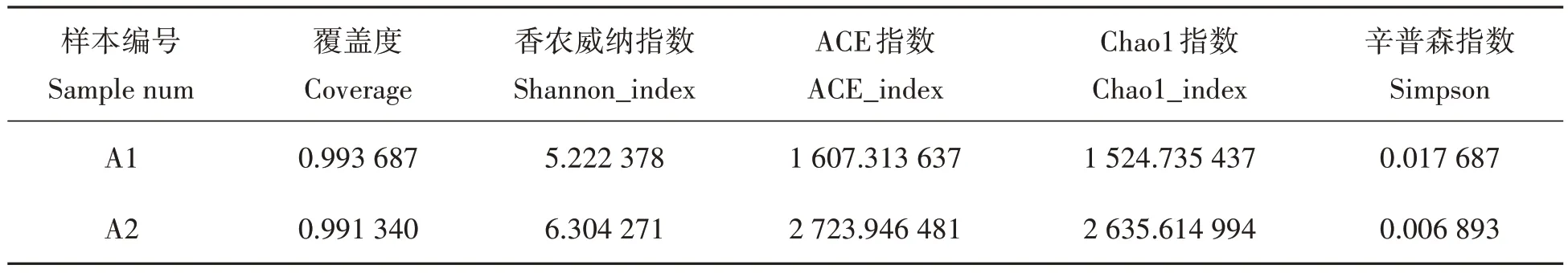
表3 IPA模式和UPA模式水体微生物α多样性指数Tab.3 Alpha-diversities of microorganism of pond water in model IPA and model UPA
2.6 微生物群落与环境因子的关系
图4(a)为IPA 模式中20 个核心微生物与水质因子的CCA 排序图。结果显示,Aciditerrimonas(S3)、Gp1(S4)、纤线杆菌属(S5)、Sinomonas(S6)、Thermosporothrix(S7)、Gp3属(S8)、Tumebacillus(S9)、Blastococcus(S10)与亚硝态氮和总氨氮相关性显著;未确定属(S1)、WPS-2_genera_incertae_sedis(S2)等剩余优势属与高锰酸盐指数、总有机碳和总磷相关性高;;
图4(b)为UPA模式中10个核心微生物与水质因子的CCA排序图。结果显示,未确定属(Q1)、Streptacidiphilus(Q4)、Gp3(Q5)、Subdivision3_genera_incertae_sedis(Q12)、Aciditerrimonas(Q13)与高锰酸盐指数相关性高;Gaiella(Q6)、Rhizomicrobium(Q7)、WPS-2_genera_incertae_sedis(Q8)、鞘脂单胞菌属(Q9)、芽单胞菌属(Q10)与总磷、亚硝态氮和总氨氮相关性高;杆菌属(Q14)、Gp13(Q15)、大理石雕菌属(Q16)、Nitrospirillum(Q17)、厌氧粘细菌属(Q18)、慢生根瘤菌属(Q19)、Spartobacteria_genera_incertae_sedis(Q20)与总氮显著相关。
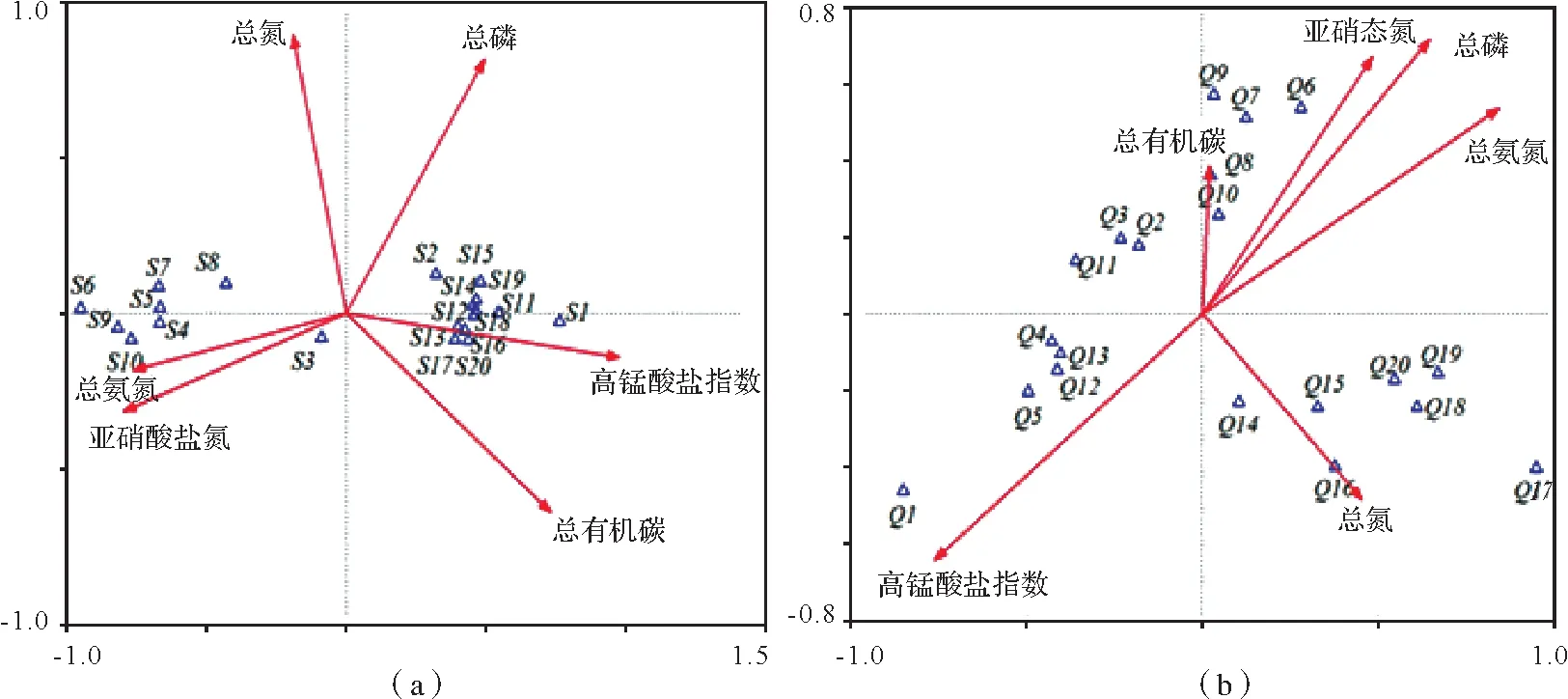
图4 IPA模式和UPA模式微生物群落与环境因子CCA排序Fig.4 Canonical correspondence analysis of bacterial community-environmental relationship in model IPA and model UPA ditional aquaculture pond
3 结论与讨论
3.1 微生物群落结构特征
在两组水样中,变形菌门均为优势菌群之一,这与李晓[5]、范立民[6]研究的罗非鱼和团头鲂养殖池塘细菌群落结构结果一致;且本研究中变形菌门中的α-变形菌纲在IPA 模式和UPA 模式中都占有很大比例。Steven 等[8]认为,α-变形菌纲通常是湖泊和河流的主要菌群,本研究结果也证实了Steven 等的观点。其次,对于放线菌门来说,有研究表明放线菌门是淡水浮游细菌群落中最重要的群落组成之一[9-10],尽管目前为止对其具体的作用还知之甚少。已有的研究表明放线菌门为池塘养殖的重要优势菌群,本研究中两种模式放线菌门的相对丰度最高在10%~20%左右,这与郑瑶瑶[11]的池塘养殖草鱼细菌群落研究结果一致。在两种养殖模式中,UPA 模式中的酸杆菌门丰度高于IPA 模式。酸杆菌门是新进分出来的一门细菌,属于兼性厌氧的嗜酸菌,在土壤中广泛分布,在废水环境中也有分布[12]。另外有研究表明,在一定范围内,氮含量与酸杆菌多样性呈正比,氮含量增加,酸杆菌多样性增加[13-14]。由水质数据得知,养殖期间UPA 模式的总氮、氨氮含量高于IPA 模式,这可能是UPA 模式中酸杆菌门相对丰度高于IPA 模式的原因。绿弯菌门是IPA 模式中特有的优势门,绿弯菌门是一种能通过光合作用产生能量的微生物[15],由前文水质和浮游植物数据得知,IPA 模式水质更加透明,浮游植物密度及生物量高于UPA 模式,光合作用的效果强于UPA模式,这可能是IPA模式中绿弯菌门成为特有优势门的原因。
两种模式监测出的50 个核心微生物(属水平)中(图3),共有未确定属、Gp1、Gp2、Gp3、Aciditerrimonas、WPS-2_genera_incertae_sedis等27个共有微生物属,说明两种模式核心微生物属存在较大差异,这可能受因为两种养殖模式水质因子的影响。例如,嗜酸链霉菌属是一链霉菌属的一个新种,且常见于酸性环境中[16],本研究UPA 模式中嗜酸链霉菌属的相对丰度明显高于IPA 模式,其原因可能是UPA 模式水体pH 值低于IPA 模式,相比IPA 模式水质偏酸,导致酸链霉菌属丰度高于IPA 模式。两种模式核心微生物中病原微生物含量极少,说明两种养殖模式爆发病害的风险较低。
水体中的细菌群落的丰度和多样性与水质环境密切相关[17]。本研究中,传统养殖模式ACE 指数和Chao 指数高于IPA 模式,说明UPA 模式微生物总数量高。研究表明,Shannon 多样性指数越高,Simpson指数越低,生物多样性越复杂。UPA 模式的Shannon 多样性指数高于IPA 模式,Simpson 指数低于IPA 模式,说明UPA 模式的微生物群落物种多样性更复杂。这可能是因为IPA 模式的生态粗养区对池塘水质净化作用明显,IPA模式的总氮、总磷和总氨氮指标优于UPA模式,UPA模式水质中营养物质高于IPA模式,利于微生物的繁殖生长。
3.2 微生物群落和水质因子的关系
CCA 分析表明,IPA 模式核心属中未分类属(S1)、WPS-2_genera_incertae_sedis(S2)、Aciditerrimonas(S3)与总磷相关性高,这与汪永明[18]对淡水河流浮游细菌群落结构特征的研究结果相一致;IPA 模式核心属中S3~S10 与亚硝态氮与总氨氮相关性显著,UPA 模式中大部分优势属与亚硝态氮相关性显著,这与杜岩岩[19]、王雪[20]对水库和湖泊细菌群落结构特征的研究结果相一致,这对今后IPA 模式水质和水体微生物群落的管理和调节具有指导意义。
