慢病毒介导稳定表达禽β-防御素9的DF-1细胞系的建立及初步应用
2020-09-07熊修琦李芳果殷冬冬宋祥军祁克宗
熊修琦,耿 姝,李芳果,殷冬冬,薛 媚,邵 颖,涂 健,宋祥军,祁克宗
(兽医病理生物学与疫病防控安徽省重点实验室,安徽 合肥 230036)
【研究意义】近年来,我国养殖业抗生素的滥用不仅造成致病菌耐药性的产生,增大兽医临床用药的难度,而且造成畜禽产品药物残留超标,危害人类健康[1]。因此,研究能够代替抗生素的无污染、无残留及无毒副作用的新型抗菌制剂已成为畜牧业亟待解决的重要问题[2]。【前人研究进展】禽防御素(AvBDs)属于β-防御素,是一类在禽体内广泛分布的内源性阳离子短肽[3-7]。由于禽类异噬性细胞缺乏氧化机制,AvBDs 构成的非氧化机制在禽类机体的天然免疫系统中发挥着重要作用[8]。研究表明,AvBDs 能够有效抑制细菌、真菌、原生生物、病毒等病原体,具有广谱抗微生物活性[9-10],且因其特殊抗菌机制,不易产出耐药性[11-12],因而AvBDs 具有潜在的临床应用价值。AvBD9 具有很强的抗微生物活性,能够杀灭大肠杆菌、沙门氏菌、葡萄球菌、空肠弯曲杆菌、产气荚膜梭菌和白色念珠菌等多种微生物[13]。【本研究切入点】AvBD9 在机体表达量低,提取天然AvBD9 操作繁琐,提取率较低;化学合成成本高,不适合临床生产使用[14];原核表达方式操作简便,但易形成无生物学活性的包涵体,限制了AvBDs的生产与研究[15],因此,可以通过建立稳定表达AvBD9 的细胞系弥补上述缺点,同时也是制备具有生物活性AvBD9 的有效途径之一。【拟解决的关键问题】本研究利用慢病毒表达载体系统,构建真核表达重组质粒pLOV-eGFPAvBD9,通过转染293T细胞,包装慢病毒,并将重组慢病毒感染DF-1细胞,经嘌呤霉素筛选,获得稳定表达AvBD9 的DF-1 细胞系,并用其产物培养耐药大肠杆菌,检测其抗菌活性。该细胞系的建立为抗生素替代品的生产制备提供了新思路,同时也为进一步开展AvBD9相关的研究提供依据。
1 材料和方法
1.1 菌株、质粒与细胞
DH5α感受态细胞购自宝生物工程(大连)有限公司;慢病毒系统pLOV-CMV-eGFP-EF1a-PuroR、psPAX2和pMD2.G载体质粒、pET-32a-AvBD9质粒以及293T细胞和DF-1细胞均由本实验室保存;耐药禽致病性大肠杆菌由兽医病理生物学与疫病防控安徽省重点实验室分离鉴定。
1.2 主要试剂
ClonExpress ⅡOne Step Cloning Kit 购自南京诺唯赞生物科技有限公司;胶回收试剂盒购自生工生物工程(上海)股份有限公司;无内毒素质粒提取试剂盒购自天根生化科技(北京)有限公司;Lipofectamine2000 购自Invitrogen 公司;嘌呤霉素、ECL 发光试剂盒购自碧云天公司;HRP 标记的兔抗鼠IgG购自武汉博士德公司;AvBD9多克隆抗体血清由本实验室制备。
1.3 引物设计
根据Genbank 发表的鸡源AvBD9基因序列(登录号NM_001001611)和同源重组酶设计原则(下划线为同源臂序列),引物序列见表1。
1.4 重组表达质粒pLOV-eGFP-AvBD9的构建
以实验室保存的pET-32a-AvBD9质粒为模板,pLOV-AvBD9-F/R为引物,扩增含有同源臂的AvBD9成熟肽基因,PCR 程序为98 ℃10 s;98 ℃10 s,55 ℃5 s,72 ℃20 s(循环35 次);72 ℃10 min。以pLOVCMV-eGFP-EF1a-PuroR 载体为模板,pLOV-F/R 为引物,扩增载体使其线性化,PCR 程序为98 ℃10 s;98 ℃10 s,55 ℃5 s,72 ℃9 min(循环35次);72 ℃10 min。将扩增的含有同源臂的AvBD9基因的PCR产物与pLOV-eGFP 线性化产物进行凝胶电泳,并胶回收,按照ClonExpress ⅡOne Step Cloning Kit 操作说明将产物进行同源重组。将同源重组产物转化至DH5α感受态细胞中,挑取PCR 鉴定阳性菌液送至上海生工生物工程有限公司进行序列测定,经鉴定正确的重组质粒命名为pLOV-eGFP-AvBD9。
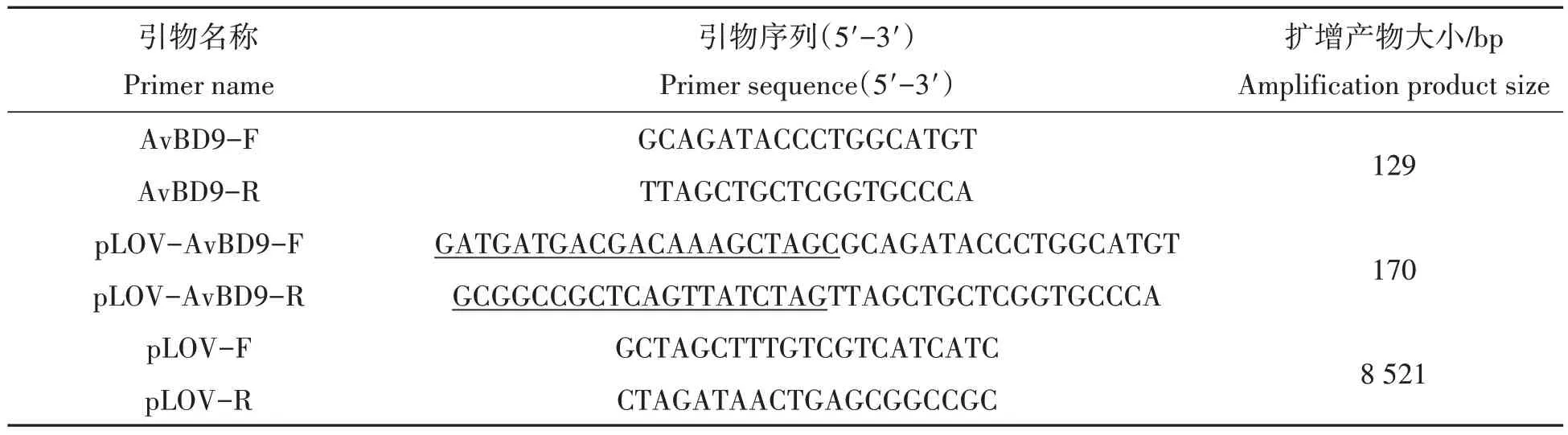
表1 引物序列Tab.1 Primer sequences
1.5 慢病毒的包装
使用无内毒素质粒提取试剂盒分别提取重组质粒pLOV-eGFP-AvBD9、包装质粒psPAX2 和外膜质粒pMD2.G。将293T 细胞接种至10 cm 培养皿,在37 ℃、5%CO2的培养条件下进行培养,当细胞密度达到90%时,按照Lipofectamine 2000 转染试剂说明书操作,利用Lipofectamine 2000 转染试剂将25 µg pLOV-eGFP-AvBD9 重组质粒、15µg 包装质粒psPAX2 和15µg 外膜质粒pMD2.G 共转染293T 细胞,6 h后更换细胞培养液,48 h 后收集细胞上清即为AvBD9 慢病毒上清,4 ℃保存备用。同时以转染空载体pLOV-eGFP、pSPAX2 和pMD2.G 质粒包装的慢病毒感染的DF-1 细胞为阴性对照,正常的DF-1 细胞为空白对照。
1.6 嘌呤霉素工作浓度的确定
将DF-1细胞平铺于6孔板中,至细胞培养密度达到90%时,更换分别添加1,2,3,4,5µg/mL浓度嘌呤霉素的细胞培养液,置于CO2培养箱中继续培养,每2 d 更换一次培养液,观察细胞存活状态,培养6~10 d后以细胞全部死亡的嘌呤霉素最低浓度为最佳筛选浓度。
1.7 表达AvBD9细胞系的构建和筛选
待DF-1 细胞密度长至80%左右,用材料和方法1.5 中收集的上清液进行感染,感染24 h 后,重复感染1次。加入含工作浓度的嘌呤霉素的细胞培养液进行筛选,感染24 h后,用含重组病毒样颗粒的上清液重复感染一次。第2次感染24 h后,使用含工作浓度的嘌呤霉素培养基进行筛选,每隔1 d弃去细胞培养上清液,更换含嘌呤霉素的新鲜培养液。用含工作浓度的嘌呤霉素培养基连续传5代进行加压筛选,以得到稳定表达的细胞系。
1.8 AvBD9基因组mRNA转录水平检测
收集第20 代DF-1-pLOV-eGFP-AvBD9 细胞,用Trizol 法提取细胞总RNA,用反转录试剂盒将细胞总RNA 反转录获得cDNA。以反转录的cDNA 为模板,用引物AvBD9-F和AvBD9-R 进行PCR 扩增,PCR产物用20 g/L琼脂糖凝胶电泳检测,同时设置空白组和对照组。
1.9 DF-1-AvBD9细胞系传代稳定性检测
收集DF-1-AvBD9细胞上清液5 mL,冷冻干燥浓缩后取50µL与SDS上样缓冲液混匀,煮沸10 min,进行SDS-PAGE,并转膜至PVDF 膜,5%(v/v)脱脂奶粉封闭过夜,加入制备1:500 稀释的AvBD9 抗体血清37 ℃孵育1 h,TBST 清洗3 次,10 min/次,加入HRP 标记的IgG 二抗,室温孵育1 h,TBST 清洗3 次,10 min/次,最后利用ECL显色。同时设置阴性对照和空白对照。
1.10 重组AvBD9抗药活性检测
收集稳定表达AvBD9 细胞系和转染空载体的不含抗生素的细胞培养上清液,分别设为试验组和对照组。将培养的耐药大肠杆菌菌数调整为1×104CFU/mL 组,之后分别取10µL 已定量的耐药大肠杆菌菌液分别混入实验组和对照组的培养液各200µL,不同时间37 ℃孵育后,用酶标仪在600 nm 波长下读取吸光度。取试验组吸光度与对照组吸光度的比值,将此比值做为耐药大肠杆菌的存活率,每组实验均重复3次,并统计分析。
将供试细菌培养至对数生长期并调整浓度为104CFU/mL,培养条件同上,并制备扫描电镜样品,将离心及PBS 清洗后的细菌置于2.5%戊二醛溶液中固定2 h,于乙醇中进行梯度脱水,每次10~15 min,脱水后的样品浸泡在100%丙酮中进行真空干燥,然后进行黏台,镀金,用扫描电镜观察并拍照。
2 结果与分析
2.1 重组表达载体pLOV-eGFP-AvBD9的构建
根据材料和方法1.4,扩增出8 521 bp的线性化的pLOV-eGFP 载体以及170 bp 的含有同源臂的AvBD9基因,条带大小与预期相符(图1)。菌液PCR 验证为阳性的真核表达质粒pLOV-eGFP-AvBD9 克隆菌株测序结果表明,AvBD9基因未发生碱基突变、缺失或移码。
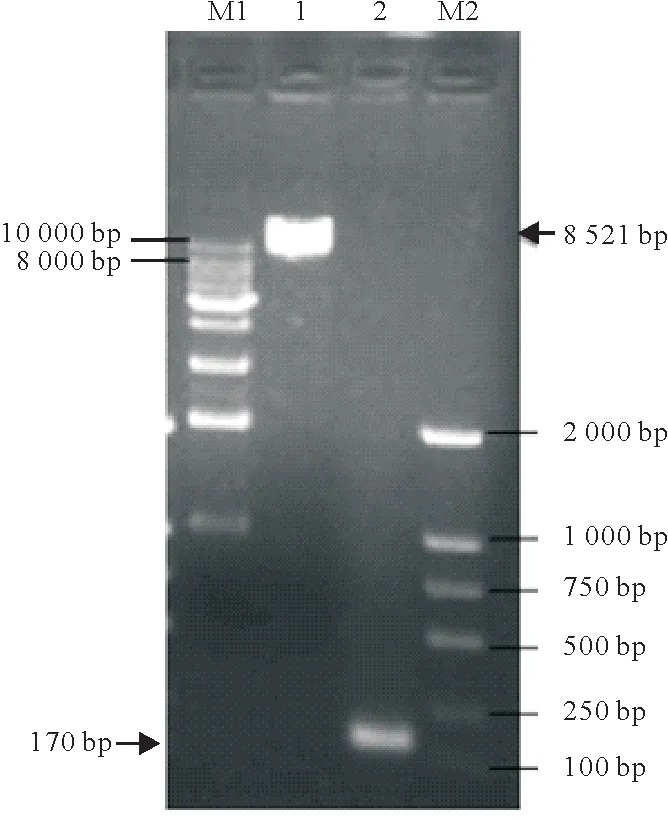
图1 pLOV-eGFP载体线性化以及含同源臂的AvBD9基因PCR扩增产物电泳结果Fig.1 Electrophoresis of linear amplification of pLOV-eGFP vector and PCR amplification product of AvBD9 gene containing homology arm
2.2 嘌呤霉素对MDBK细胞最小致死浓度测定
实验结果表明,DF-1 细胞在更换不同浓度的嘌呤霉素抗性培养基培养24 h 后,出现明显的生长停滞。第3 天时DF-1 细胞大量死亡。当第10 天时,2,3,4,5µg/mL 组中DF-1 细胞均死亡,仅1µg/mL 组中有极少量DF-1 细胞存活。因此,确定嘌呤霉素对DF-1 细胞的最小致死浓度为1µg/mL,并将此浓度的嘌呤霉素作为筛选工作浓度。
2.3 表达AvBD9的DF-1细胞系构建及筛选结果
根据材料和方法1.5,将pLOV-eGFP-AvBD9、pSPAX2和pMD2.G 质粒共转染293 T细胞,24 h后,荧光显微镜下观察瞬时转染后绿色荧光信号分布。取293T 细胞培养上清液感染DF-1 细胞,以1 µg/mL 嘌呤霉素工作浓度进行细胞筛选后得到细胞多克隆,通过3 轮有限稀释法纯化将稳定表达AvBD9 的单细胞克隆扩大培养,获得DF-1-AvBD9细胞系(图2)。
2.4 细胞基因组中AvBD9 mRNA转录水平的检测
提取第20 代DF-1-AvBD9 细胞总RNA,将其反转录合成cDNA。然后用特异性引物AvBD9-F 和AvBD9-R 扩增AvBD9 基因。结果表明,RT-PCR 检测第20 代DF-1-AvBD9 细胞能测出AvBD9基因,而阴性对照和空白对照中均未检测出AvBD9基因(图3),表明在DF-1-AvBD9细胞中AvBD9基因能稳定转录成mRNA。
2.5 AvBD9蛋白在DF-1-AvBD9细胞系的表达
将DF-1-AvBD9 细胞传代至第20 代,选取第20 代的DF-1-AvBD9 细胞系上清,进行Western Blot 检测。Western Blot 结果显示,DF-1-AvBD9 细胞上清中能够检测到AvBD9 蛋白,而空白组DF-1 细胞和对照组DF-1-pLOV-eGFP细胞中均未检测出AvBD9蛋白(图4)。
2.6 重组AvBD9抗药活性检测
细胞培养上清液与耐药大肠杆菌作用不同时间后读取吸光度,结果显示:随着孵育时间的增加,耐药菌的存活率逐渐降低,孵育5 h 时多重耐药大肠杆菌的存活率低于55%,但作用6 h 后,存活率开始上升(图5)。表明AvBD9 的抗菌效果同时间具有相关性。同时,扫描电镜检测抑菌活性发现,对照组菌体完整饱满,表面光滑。经AvBD9作用6 h后的菌体干瘪皱缩,变形扭曲,表面凹凸不平(图6)。扫描电镜显示,AvBD9对供试细菌具有明显的损伤作用。
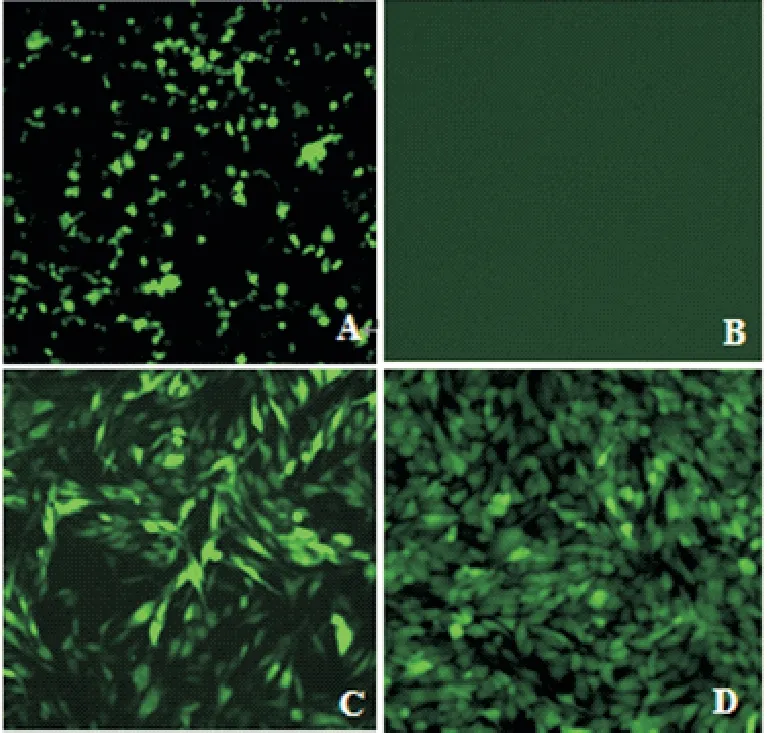
图2 慢病毒包装及细胞系筛选结果图Fig.2 Lentiviral packaging and cell line screening results
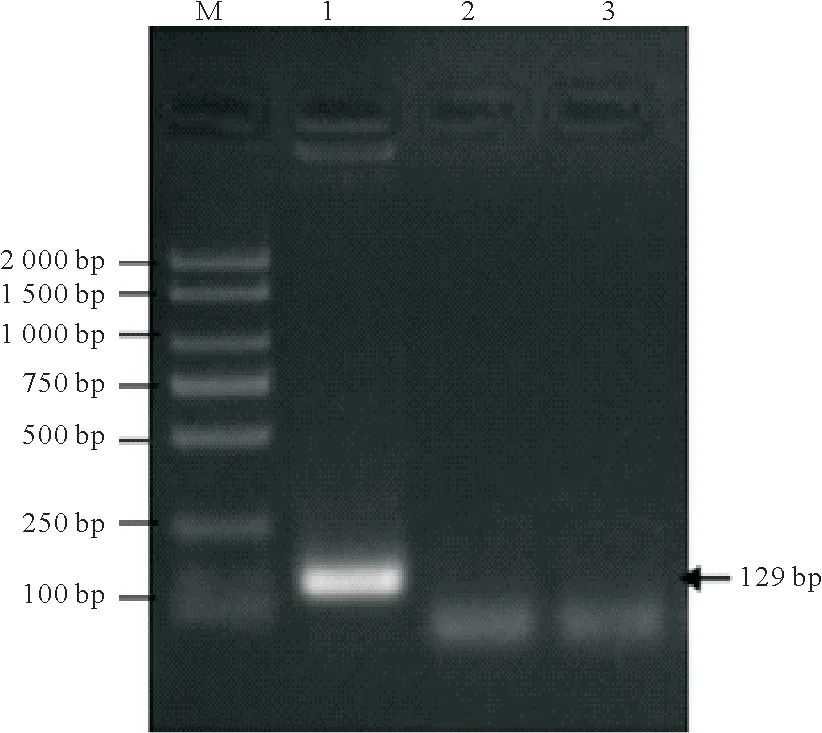
图3 DF-1-AvBD9细胞AvBD9基因检测Fig.3 Detection of AvBD9 gene in DF-1-AvBD9 cells

图4 AvBD9蛋白Western blot检测Fig.4 Western blot analysis of AvBD9 protein
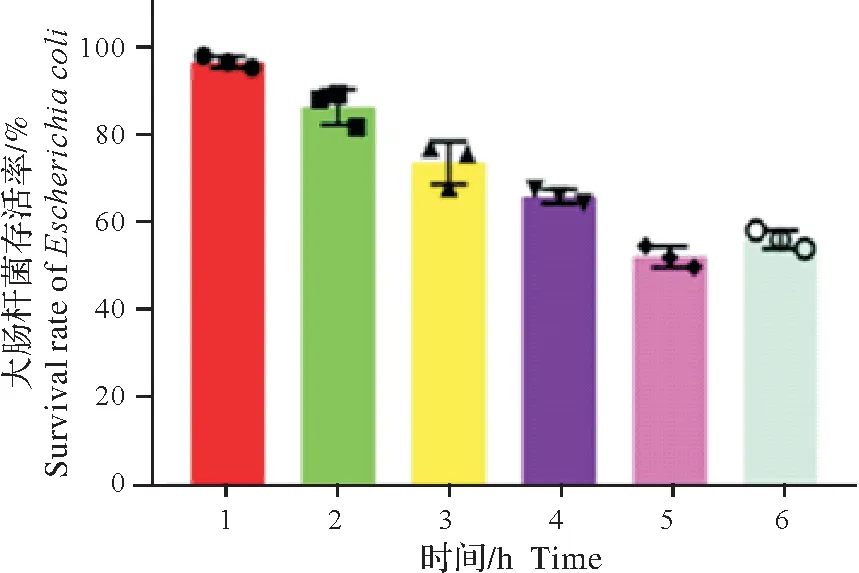
图5 DF-1-AvBD9细胞培养上清的抗菌活性Fig.5 Antibacterial activity of DF-1-AvBD9 cell culture supernatant

图6 扫描电镜检测AvBD9抑菌效果Fig.6 Detection of the antibacterial effect of AvBD9 by scanning electron microscopy
3 结论与讨论
防御素是一种富含半胱氨酸的阳离子肽,大多由20~200个氨基酸组成,能够杀死多种病原体,包括各种细菌、真菌和某些病毒[9]。AvBDs广泛分布于鸡肠道、肝脏、肺脏、肾脏、卵巢、睾丸、胸腺、法氏囊、心脏等器官的组织细胞,在禽体中发挥着重要防御功能。目前,已有多种鸡AvBDs在大肠杆菌表达系统和酵母表达系统中成功表达,如张开娟等[16]在大肠杆菌表达系统中表达了鸡AvBD7,魏海婷等[17]在毕赤酵母中成功表达鸡AvBD2,张永正[18]在大肠杆菌系统中成功表达鸡AvBD9 等。大肠杆菌表达系统和酵母表达系统经条件优化能够达到所需蛋白量,但易形成无生物学活性的包涵体,即便通过复性也难以恢复防御素的天然结构,酵母表达载体存在产物酰胺化不完全影响活性以及AvBDs 易在表达及纯化过程中降解等问题[19-20]。因此,建立一种能持续稳定表达AvBDs的细胞系成为一种有效的选择。
目前,目的基因导入细胞有多种方法,但大部分方法不能将外源基因整合入基因组,且导入的目的基因容易在筛选后的传代培养过程中发生丢失和突变[21],而慢病毒载体可以将携带的外源基因导入宿主细胞中,通过反转录将目的基因整合进入细胞基因组,并稳定表达,具有操作简便、扩增周期短、转染率高、能长期稳定表达的特点,且能够感染分裂和不分裂细胞,适用于难转染的原代细胞(如神经细胞)[22-23],使其在研究中被广泛使用。因此,本研究选择利用慢病毒载体系统制备稳定表达AvBD9 的DF-1细胞系,提供稳定的AvBD9蛋白来源,为克服细菌耐药性和抗生素替代提供研究思路,也为今后研究AvBD9的生物学功能及其在抗病原微生物活性方面提供依据。
