绵羊IRS1基因CDS区克隆、序列分析及其组织表达研究
2020-09-07王建清郝志云沈继源王继卿罗玉柱李少斌
王建清,郝志云,沈继源,王继卿,罗玉柱,胡 江,刘 秀,李少斌
(甘肃农业大学 动物科学技术学院/甘肃省草食动物生物技术重点实验室/甘肃省牛羊基因改良工程实验室,甘肃兰州 730070)
【研究意义】胰岛素受体底物(insulin receptorsubstrates,IRSs)是细胞质蛋白,在下游信号传递中起着重要的级联作用。【前人研究进展】目前在IRSs 家族中共发现6 名成员,分别是IRS1、IRS2、IRS3、IRS4、IRS5 和IRS6。这些蛋白质在N 末端具有较高的同源性,有2 个极其保守的结构域,即血小板-白细胞C激酶底物结构域(pleckstrin homology,PH)和磷酸化酪氨酸结合结构域(phosphotyrosine binding,PTB),前者负责蛋白质相互作用及蛋白质与磷脂相互作用,后者负责与活化受体中的NPXY 基序相互作用[1-2]。胰岛素受体底物1(Insulin receptor substrate 1,IRS1)是细胞胰岛素反应的主要配体和信号转导适配蛋白,在胰岛素(insulin,INS)和胰岛素样生长因子受体1(insulin-like growth factor receptor-1,IGFR-1)向细胞内PI3K/AKT(Phosphoinositide 3-kinase/protein kinase B)和MAPK(mitogen-activated protein kinase)通路传递信号方面起着关键作用[3]。IRS1作为调节β细胞功能的重要信号分子,主要调节胰岛素分泌。例如,IRS1抑制内质网上钙离子ATP 酶,使细胞内钙离子浓度升高,从而激活蛋白激酶C,刺激了胰岛素释放[4]。IRS1 在生物代谢和生长促进中都发挥着重要的功能,缺乏IRS1 的小鼠表现出轻微的糖尿病表型和明显的生长障碍,即小鼠心脏、肝脏和腓肠肌的重量明显减少[5]。马向辉等[6]研究发现IRS1基因对秦川牛体尺及部分肉质性状有显著的影响。此外,Porter 等[7]分析了人乳腺癌标组织中IRS1的表达,发现IRS1在导管原位癌(DCIS)中高度表达。Jiao 等[8]研究发现miR-221 通过靶向PI3KAkt/mTOR 信号通路中的关键基因IRS1,抑制了奶牛乳腺上皮细胞的增殖。由此表明IRS1基因在乳腺发育中也具有重要的生物学功能。【本研究切入点】目前在GenBank中已有绵羊IRS1基因的预测序列,但尚未经过实验证实。同时也尚未见到绵羊该基因的序列特征和mRNA 组织表达研究。【拟解决的关键问题】本研究以泌乳高峰期和空怀期的小尾寒羊为研究对象,利用克隆测序技术获得了绵羊IRS1基因的CDS序列,通过生物信息学分析了其编码的氨基酸序列,利用RT-qPCR 检测了在不同乳腺发育时期,IRS1基因在乳腺、肝脏、心脏、背最长肌、脾脏、肺脏、卵巢和肾脏中的表达模式,以期为阐明IRS1基因的生物学功能提供理论基础。
1 材料与方法
1.1 绵羊组织样的采集
在甘肃省天祝县松山镇金子河绵羊繁育场,选择处于泌乳高峰期(产后第3周)的小尾寒羊和空怀期的小尾寒羊各3 只,所有羊只均为健康无病的3 岁母羊。现场屠宰后分别采集其乳腺、心脏、肝脏、背最长肌、脾脏、肺脏、卵巢和肾脏组织,用DEPC 水冲洗干净后装入2 mL冻存管,然后迅速置于液氮中,带回实验室,于-80 ℃冰箱中保存,备用。
1.2 绵羊组织样总RNA的提取与反转录
按照Trizol Reagent(Invitrogen,CA,USA)试剂盒说明,分别提取小尾寒羊各组织中的总RNA,用20 g/L的琼脂糖凝胶电泳和超微量分光光度计(NanoDrop™One)检测所提RNA 的质量和浓度。检测合格的RNA 按照天根反转录试剂盒(FastKing RT kit with gDNase)的要求进行反转录得到cDNA,置于-20 ℃冰箱中保存备用。
1.3 绵羊IRS1基因的引物设计与PCR扩增
利用人IRS1基因的mRNA 序列(GenBank 登录号为NM_005544.2),在NCBI 中BLAST 搜索绵羊基因组4.0(Ovine Genome Assembly Oar_v4.0),获得与人IRS1mRNA高度相似的绵羊序列。用Primer 5.0设计3 对引物P1、P2 和P3,其中P1 和P2 引物用于克隆扩增绵羊IRS1基因的CDS 全长序列,引物P3 用于RTqPCR 分析,β-actin作为RT-qPCR 的内参基因,这些引物由杨凌天润奥科生物科技有限公司合成,引物具体序列见表1。以一只空怀期小尾寒羊的背最长肌中获得的cDNA 为模板,采用25µL 反应体系进行PCR 扩增:cDNA(约100 ng/µL)1µL、2×F8 FastLong PCR MasterMix 12.5µL、上、下游引物(0.25µmol/L)各0.5µL,加ddH2O 至25µL;PCR 扩增条件为:94 ℃预变性5 min,94 ℃变性15 s,59 ℃退火15 s,72 ℃延伸50 s,共37个循环,72 ℃延伸5 min,4 ℃保存。

表1 绵羊IRS1基因的引物序列Tab.1 Primer sequence for sheep IRS1 gene
1.4 绵羊IRS1基因的克隆和测序
PCR 扩增产物用10 g/L 的琼脂糖凝胶电泳检测,用天根琼脂糖凝胶DNA 回收试剂盒纯化回收目的片段,将回收的目的片段连接至pMD19-T 载体上,连接反应体系为:0.5µL pMD19-T 载体(约50 ng)、2 µL 目的片段DNA(约150 ng)、5 µL solutionⅠ快速连接液、最后用灭菌去离子水补足到10 µL,16 ℃连接30 min。将连接产物加到100µL DH5α感受态细胞中混匀冰浴30 min,42 ℃水浴90 s,取出后立即冰浴5 min,然后向其中加入500µL、37 ℃预热的LB(不含抗生素)培养基,200 r/min、37 ℃培养45 min,吸取200 µL 菌液加到含Amp 抗生素的LB 固体琼脂培养基上,用无菌的弯头玻棒轻轻的将菌液均匀涂开。待平板表面干燥后,倒置平板于37 ℃培养14 h。然后挑取白色单菌落加入1 mL 含Amp 抗生素的LB 培养基中,在220 r/min、37 ℃下培养10 h,用引物P1和P2分别进行菌液PCR扩增(扩增体系及条件参考1.3),对PCR 产物进行琼脂糖凝胶电泳,对于检测到目的条带的PCR 产物所对应的菌液,送至上海生工生物科技有限公司测序。
1.5 绵羊IRS1基因的生物信息学分析
通过在线软件(http://hollywood.mit.edu/GENSCAN.html)预测绵羊IRS1基因的CDS 及其编码的氨基酸序列,并在NCBI 中进行Blast 验证;用MEGA 5.0 构建系统发育树;用在线软件(https://web.expasy.org/protparam)分析绵羊IRS1的氨基酸序列特征;用在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析其蛋白质二级结构;用NetPhos 3.1预测氨基酸序列中潜在的磷酸化位点;利用在线软件(https://string-db.org/cgi/input.pl)分析IRS1的蛋白网络互作关系;利用KEGG和GO分析其生物学功能和参与的代谢通路。
1.6 绵羊IRS1基因的表达量检测
用SYBR Green I 嵌合荧光法,在Applied Biosystems QuantStudio®6 Flex qPCR 仪(Thermo Fisher,USA)中进行qPCR 反应,用于检测IRS1基因的组织表达量,然后用2-△△Ct法进行相对定量分析。qPCR 采用20µL 反应体系,包括2×ChamQ Universal SYBR qPCR Master Mix 10µL、上、下游引物(0.25µmol/L)各0.4µL、cDNA(约50 ng/µL)2µL,加ddH2O 至20µL;反应条件为:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环,然后进行融解曲线分析:95 ℃变性15 s,60 ℃退火60 s,95 ℃变性15 s。绵羊IRS1基因表达量检测所用的cDNA 分别来自泌乳高峰期小尾寒羊和空怀期小尾寒羊的8 个组织,每个组织3个生物学重复。
2 结果与分析
2.1 绵羊IRS1基因的PCR扩增
以小尾寒羊背最长肌中获得的cDNA 为模板,用引物P1 和P2 进行PCR 扩增,扩增产物经10 g/L 的琼脂糖凝胶电泳检测,发现2 条目的条带均接近2 000 bp,与预期结果一致(图1)。
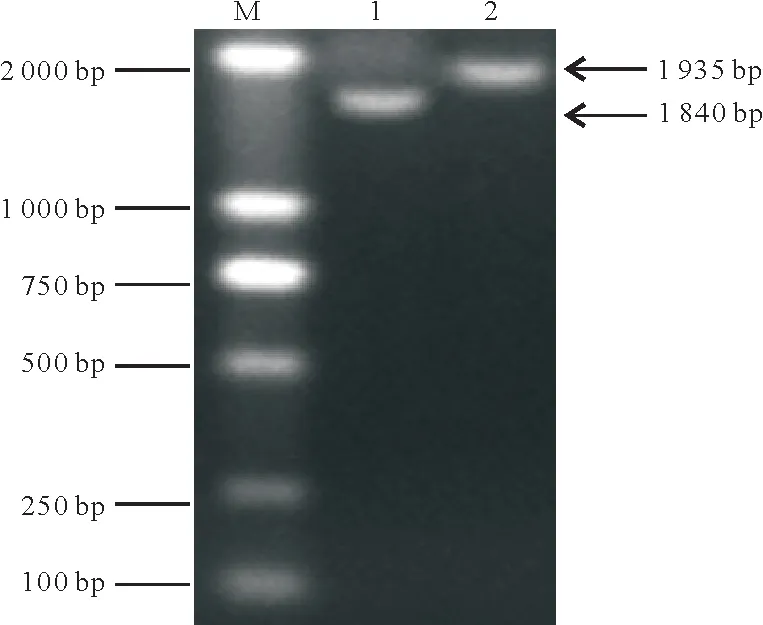
图1 绵羊IRS1基因PCR扩增产物检测结果Fig.1 Electrophoresis results of sheep IRS1 gene PCR product
2.2 绵羊IRS1基因的克隆测序
通过测序发现,引物P1 和P2 扩增的核苷酸片段大小分别为1 840 bp和1 935 bp,将这2段核苷酸序列拼接后,获得了绵羊IRS1基因的CDS及其编码的氨基酸序列。结果表明,该基因的CDS全长3 708 bp,编码1 235个氨基酸,这与NCBI中预测的结果一致。利用BLAST分析发现,该氨基酸序列与山羊IRS1 序列和黄牛IRS1 序列同源性分别高达99.19%和98.22%。在GenBank 中获得山羊(XP_017914353.1)、野牦牛(XP_005890195.1)、黄牛(XP_003585821.1)、马(XP_023498214.1)、猪(XP_020930260.1)、大鼠(NP_037101.1)、小鼠(NP_034700.2)和人类(NP_005535.1)IRS1 的氨基酸序列,结合本研究获得的序列,构建了系统发育树。结果显示,本研究获得的绵羊序列与山羊IRS1序列的亲缘关系最近,其次是野牦牛和黄牛,与猪、马和人的亲缘关系较远,与小鼠和大鼠的亲缘关系最远(图2)。以上研究结果表明,本研究获得的核苷酸序列为绵羊的IRS1序列。
2.3 绵羊IRS1的蛋白理化性质及其生物学功能分析
绵羊IRS1的分子式为C5615H8814N1706O1800S45,分子量为130 462.80,等电点为8.99,包括507个非极性氨基酸(41.1%)和728 个极性氨基酸(58.9%),其中极性氨基酸由124 个带正电荷的氨基酸(Arg+Lys)(10.0%)、108个带负电荷的氨基酸(Asp+Glu)(8.7%)和496个不带电荷的氨基酸(40.2%)组成。在其氨基酸组成中,丝氨酸(Ser)含量最高,占比为14.6%;其次是脯氨酸(Pro)和甘氨酸(Gly),分别占10.7%和10.6%。绵羊IRS1 在哺乳动物网织红细胞内的半衰期为30 h,脂溶指数为56.06,平均亲水性为-0.649,不稳定指数为73.55。说明该蛋白为不稳定的、碱性亲水性蛋白。
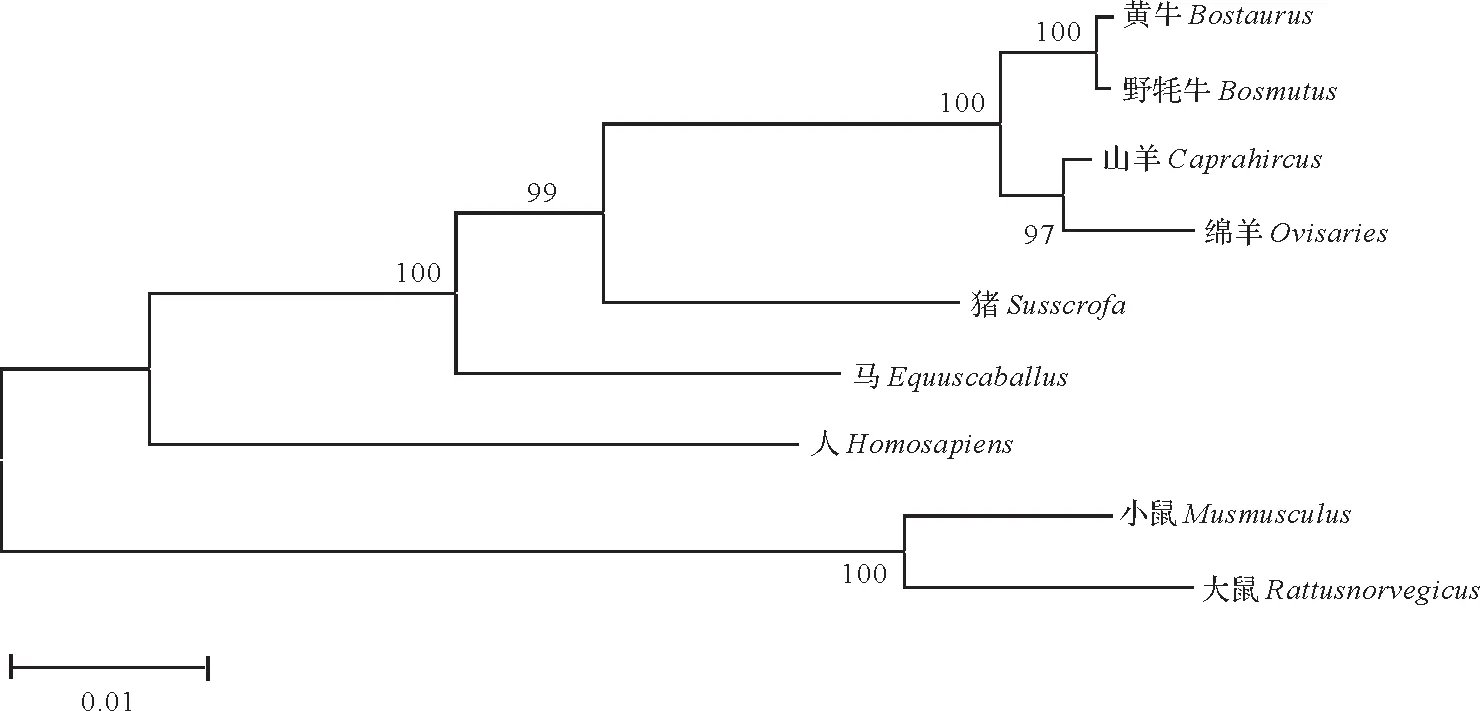
图2 基于IRS1的氨基酸序列构建的系统进化树Fig.2 Phylogenetic tree based on amino acid sequence of IRS1
绵羊IRS1的二级结构中包含14.01%的α螺旋、4.05%的β 转角、67.53%的无规卷曲和14.41%的延伸链。磷酸化位点预测结果显示,绵羊IRS1 包含了150 个丝氨酸(Ser)、36个苏氨酸(Thr)和18个酪氨酸(Tyr)磷酸化位点。GO 功能注释显示,IRS1基因主要参与了蛋白激酶结合及蛋白激酶C 结合等生物学过程。KEGG 分析发现,IRS1基因主要参与了PI3K/AKT和MAPK信号通路。String分析显示,绵羊IRS1同IGFR1、磷酸肌醇-3-激酶调节亚基1(Phosphoinositide-3-Kinase Regulatory Subunit 1,PIK3R1)、丝裂原活化蛋白激酶8(Mitogen-Activated Protein Kinase 8,MAPK8)、丝裂原活化蛋白激酶10(Mitogen-Activated Protein Kinase 8,MAPK10)和生长因子受体结合蛋白2(growth factor receptor bound protein 2,GRB2)存在直接的相互作用(图3)。

图3 绵羊IRS1蛋白网络互作图Fig.3 The protein interaction network of sheep IRS1
2.4 绵羊IRS1基因的组织表达特征
RT-qPCR 检测结果分析发现,绵羊IRS1基因在小尾寒羊各组织中均表达,并且表现出明显的组织特异性。无论是泌乳高峰期还是空怀期的小尾寒羊中,IRS1基因在背最长肌中的表达量最高,其次是肝脏和心脏,在肺脏、肾脏、卵巢和乳腺组织中表达量较低,在脾脏中弱表达。
同时,绵羊IRS1基因表达也表现出明显的时序性。在泌乳高峰期的小尾寒羊中,IRS1基因在乳腺组织中的表达量是空怀期乳腺组织中的表达量的2.77倍(P<0.05),但在除乳腺和脾脏以外的其他6个组织中,该基因在空怀期中的表达量均显著高于泌乳高峰期中的表达量(P<0.05)。同时发现,虽然在泌乳高峰期中,IRS1基因的表达量在卵巢和乳腺组织间无显著差异(P>0.05);但是在空怀期中,该基因在卵巢中的表达量是乳腺组织中的5.49倍(P<0.01)(图4)。
3 讨论与结论
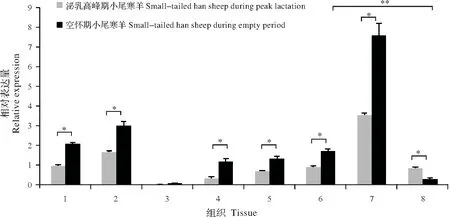
图4 IRS1基因在泌乳高峰期和空怀期小尾寒羊各组织中的相对表达量Fig.4 Relative expression of IRS1 gene in different tissues of small-tailed han sheep during the peak-lactation and non-lactation periods
本研究利用克隆测序等实验方法,首次获得了绵羊IRS1基因完整的CDS序列。该序列全长3 708 bp,编码1235 个氨基酸。绵羊IRS1 的氨基酸序列与山羊和黄牛IRS1 序列的同源性分别高达99.19%和98.22%。绵羊IRS1 的氨基酸组成中,丝氨酸(Ser)含量最高(占14.6%),这与小鼠中的研究结果一致[2]。绵羊IRS1 的平均亲水性为-0.649,属于亲水性蛋白。Sun 等[9]也发现大鼠IRS1 是相对分子质量为131 000 的亲水性蛋白质。绵羊IRS1 的不稳定指数为73.55,为不稳定蛋白,但其半衰期较长(30 h),这与“蛋白质的稳定性与其半衰期呈正相关”[10]的研究结果有一定出入。绵羊IRS1为不稳定蛋白,有2 个方面的原因。一是绵羊IRS1 的氨基酸序列中含有204 个潜在的磷酸化位点。Sprang 等[11]研究发现磷酸化会降低蛋白质的稳定性。二是绵羊IRS1的不稳定性与其二级结构中含有较少的α螺旋有关。研究表明,二级结构中的α螺旋可以增加蛋白质的稳定性[12-13]。在绵羊IRS1的氨基酸构成中含有高比例的脯氨酸(10.7%)和甘氨酸(10.6%),这影响了α 螺旋的形成。研究表明,不同的氨基酸序列形成α 螺旋结构的概率不同。蛋氨酸、丙氨酸、亮氨酸、谷氨酸和赖氨酸都有特别高的α 螺旋形成概率,而脯氨酸和甘氨酸的α螺旋形成概率很低[14],因为脯氨酸可以通过两种途径破坏和扭曲α螺旋,一是不能提供酰胺氢键,另一方面是它对α螺旋的主干进行空间干涉,迫使α螺旋轴弯曲约30°[15]。
KEGG 分析发现,IRS1基因主要参与了PI3K/AKT 和MAPK 信号通路,这2个信号通路都与哺乳动物的乳腺发育和泌乳密切相关。其中PI3K/AKT 是由胰岛素样生长因子1(IGF1)介导的、调节蛋白质合成的信号通路[16],IGF1 与IGFR1 结合后使得IRS1 发生磷酸化,磷酸化后的IRS1 与PI3K 结合生成PIP3,PIP3 可以吸引并激活AKT 激酶[17-18],然后在mTOR 通路上促进乳蛋白的合成[19]。MAPK 激酶是一种丝氨酸/苏氨酸特异性蛋白激酶,MAPK 信号通路主要调节细胞增殖、分化、存活和凋亡,以及有丝分裂[20]。研究[5]表明,在IRS1缺失的小鼠中,PI3K/AKT 和MAPK 通路的信号转导受到影响,并且受影响程度是组织特异性的。因此绵羊IRS1可以通过这2个信号通路调节绵羊乳腺和其它组织的发育。
蛋白互作分析发现绵羊IRS1 同IGFR1、PIK3R1、MAPK8、MAPK10 和GRB2 存在直接的相互作用。其中IGFR1 是PI3K/AKT 信号通路的关键蛋白[21],PIK3R1 和催化亚基(p110a、p110b 和p110d)共同构成了PI3K[22],IGFR1 可以通过PI3K/AKT 信号通路发挥一系列作用[17]。MAPK8(也称为JNK1)和MAPK10(也称为JNK3)是MAPK 激酶的JNK(c-Jun N-terminal kinases)家族成员[23],JNK 可以与IRS1 结合,从而使IRS1 在Ser307 位点处发生磷酸化,最终抑制了INS 刺激的IRS1 酪氨酸磷酸化,促进了MAPK 的激活,增强了MAPK 通路的信号转导[24]。在INS 刺激过程中,GRB2 与IRS1 磷酸化的Y895VNI 基序结合,形成IRS1-GRB2复合物,可以增强INS对MAPK的刺激作用[25]。
RT-qPCR 检测结果分析发现,绵羊IRS1基因在小尾寒羊各组织中均表达,并且表现出明显的组织特异性。无论是在泌乳高峰期还是在空怀期,IRS1基因在背最长肌中的表达量最高,其次是肝脏和心脏,在肺脏、肾脏、卵巢和乳腺组织中表达量较低,在脾脏中弱表达。这与人类上的研究结果一致,张垚等[26]发现IRS1在全身各组织细胞中均表达,并且在骨骼肌中表达量最高。目前IRS1基因的组织表达研究集中在人类肿瘤组织中[27],尚未有该基因在家畜组织中的研究报道。
绵羊IRS1基因也表现出明显的时序表达性,在肝脏、心脏、背最长肌、肺脏、卵巢和肾脏组织中,该基因在空怀期中的表达量均显著高于泌乳高峰期中的表达量(P<0.05),这可能与绵羊在2个时期的雌二醇分泌量差异有关。华蕊等[28]在海南黑山羊中研究发现,与空怀期相比,泌乳期的雌二醇分泌量显著下降,而雌二醇可以增加IRS1mRNA的表达[29]。
同时发现,IRS1基因在泌乳高峰期乳腺组织中的表达量是空怀期中的2.77倍(P<0.05),这表明IRS1基因在促进绵羊乳腺发育和泌乳中发挥着重要作用。研究表明在牛乳腺上皮细胞和小鼠乳腺中,INS具有促进细胞增殖和乳蛋白基因表达的作用[30-32],而IRS1可以抑制内质网上钙离子ATP 酶,使细胞内钙离子浓度升高,从而激活蛋白激酶C,刺激INS 释放[4]。因此,IRS1 可以通过INS 的间接作用促进乳腺上皮细胞增殖。此外,Chen 等[33]研究发现IRS1 可以通过磷酸化激活STAT5,从而参与JAK/STAT 信号转导通路,调控乳蛋白合成和乳腺上皮细胞分化,维持乳腺上皮细胞的存活[34-35]。
本研究首次成功克隆得到绵羊IRS1基因完整的CDS 序列,它全长3 708 bp,编码1 235 个氨基酸。IRS1在小尾寒羊各组织中广泛表达,并且表达出明显的组织特异性和时序特异性。
