一株水霉拮抗菌的筛选、鉴定及抑菌稳定性研究
2020-09-07王旭
王旭
(辽东学院海岸带生物技术研究所,辽宁 丹东 118003)
水霉病是世界性淡水养殖鱼类的病害,各种淡水成鱼、鱼苗和鱼卵都可发生,传染性强,发病率及死亡率高[1]。该病的病原为卵菌纲,水霉属真菌[2]。寄生水霉Saprolegnia parasitica 是目前已发现的最重要的病原菌,其孢子萌发快,侵袭能力强,几乎能够感染包括鲫Carassius auratus 斑马鱼Barchydanio rerio、鲟Acipenser 及鲈Lateolabrax japonicus 等在内的所有淡水鱼类及其卵[3-6]。孔雀石绿曾是治疗水霉病最有效的化学试剂,但其强致畸、致癌及高残留,已被禁用。目前防治水霉病主要采用抗生素、杀菌剂、中草药、氧化剂等[7-13]。这些方法易造成水霉的耐药性、效果不明显、成本高、有效浓度超出安全限量等问题,使用受限[14]。研究发现,有些微生物来源的活性成分可以抑制真菌的生长和感染,且具有绿色、环保、安全、高效的优点[15]。其中,枯草芽孢杆菌Bacillus subtilis、地衣芽孢杆菌Baclicus lincheniformis 等具有非致病、耐储存、使用方便等特点,是目前水产养殖中应用最为广泛的益生菌[16,17]。本试验以寄生水霉为靶标菌,通过平板对峙培养,筛选出抑制水霉生长的芽孢杆菌,并研究其抑菌稳定性,以期为水霉病的生物防治提供优良菌种资源和基础数据。
1 材料与方法
1.1 材料
1.1.1 供试菌株
靶标菌株SMJ-1 及其他寄生水霉菌株SMJ-2、SMJ-3、SMJ-4 分别分离自辽宁省东港市淡水养殖池塘的散鳞镜鲤Cyprinus carpio var.specularis 发病组织和卵,彭泽鲫Carassius auratus var.pengze、大鳞副泥鳅Paramisgurnus dabryanus 的发病组织。经纯化、致病性测定和分子鉴定,确定其均为寄生水霉。待筛选菌株为分离保藏的27 株细菌菌株,保存于辽东学院农学院微生物工程实验室。
1.1.2 培养基
细菌培养采用牛肉膏蛋白胨培养基:牛肉膏5.0g、蛋白胨10.0g、氯化钠5.0g、琼脂20.0g、水1000mL,pH7.2~7.6。水霉培养和平板对峙试验采用PDA 培养基:马铃薯200.0g、葡萄糖20.0g、琼脂20.0g、水1000mL,自然pH。
1.1.3 拮抗菌基因组DNA 提取及16S rRNA 序列扩增试剂
Lysis Buffer for Microorganism to Direct PCR、Premix Taq Version 2.0 (Loading dye mix)、DNA Marker(DL-2000)购自宝生物工程(大连)有限公司,引物27F/1492R(27F:5’-AGA GTT TGA TCM TGG CTC AG-3’;1492R:5’-TAC GGY TAC CTT GTT ACG ACT T-3’)由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 拮抗菌筛选
初筛:采用平板对峙法。将活化后的寄生水霉用直径0.6cm 的无菌打孔器制备菌饼,接种于PDA平板中央,18℃培养24h 后,采用十字交叉法,在距离靶标菌饼2cm 处对称点接待筛选菌株,以不接菌一侧为对照。置于18℃培养箱中培养,至对照一侧长满平板后测量抑菌带宽度,确定待筛菌株的抑菌效果。
复筛:采用发酵液抑菌试验。初筛所得拮抗菌株接种于装量40%的牛肉膏蛋白胨液体培养基中,30℃发酵48h。发酵液经细菌滤器过滤后,按照1∶5 的比例与55℃的PDA 培养基混合均匀,制备平板。冷却后,在平板中央接种寄生水霉菌饼,以无菌水为对照,每个处理3 次重复,于18℃培养至对照长满平板后,测量各处理的菌落直径,计算抑菌率。抑菌率(%)=(对照菌落生长直径-处理菌落生长直径/对照菌落生长直径)×100。
1.2.2 拮抗菌鉴定
1.2.2.1 形态学特征
将纯化的拮抗菌划线接种于牛肉膏蛋白胨培养基上,30℃培养24h,观察菌落形态、颜色等性状。挑取少量菌体制备抹片,经革兰氏染色后,参照《常见细菌系统鉴定手册》[18],在显微镜下观察染色特征、菌体形态及特殊结构。
1.2.2.2 拮抗菌16S rRNA 序列分析
拮抗菌基因组DNA 提取按照Lysis Buffer for Microorganism to Direct PCR 步骤要求进行。16S rRNA 序列扩增采用通用引物27F/1492R,扩增体系和反应程序参照李娟等[19]。扩增产物经生工生物工程(上海)有限公司测序,所测序列在Genbank 数据库中进行Blast 对比分析。运用Clustal X(Version 1.83)和Mega 6.06 软件[19]进行多重序列比对并构建系统发育树。
1.2.3 拮抗菌传代稳定性测定
将拮抗菌菌液以5%的接种量接种于牛肉膏蛋白胨液体培养基中传代培养,每48h 转接1 次,连续传代10 次,每个处理设3 次重复。发酵液抑菌试验测定出发菌株与传代菌株对寄生水霉的抑菌效果,根据抑菌率变化分析传代对拮抗菌抑菌效果的影响。
1.2.4 拮抗菌发酵液热稳定性测定
用牛肉膏蛋白胨液体培养基发酵拮抗菌,将5%的试验菌株菌液接种于装量为40%的500mL 三角瓶中,30℃,120 r/min,培养72 h。发酵液采用无菌滤膜过滤,滤液4℃冷藏备用。
取各发酵滤液15mL 分别加入到20mL 直口离心管中,置于10℃、20℃、30℃、40℃、50℃、60℃和70℃下处理2h。之后,按照1∶5 的比例,将处理后的发酵滤液分别与灭菌后冷却至55℃的PDA 培养基混合均匀制备平板。每个平板中央接种寄生水霉菌饼,每个处理重复3 次,18℃培养至对照长满平板后,测量各处理菌落直径,计算抑菌率,检测不同温度对试验菌株发酵滤液抑菌活性的影响。
1.2.5 拮抗菌发酵液酸碱稳定性测定
拮抗菌无菌发酵滤液制备方法同1.2.4。取发酵滤液15mL 分别加入到20mL 直口离心管中,用1mol/L HCl 和1mol/L NaOH 分别调pH 至5.0、6.0、7.0、8.0 和9.0,室温静置24h 后,将各管中的pH 调回至未经处理的发酵滤液pH6.8。之后按照1∶5 的比例,将处理后的发酵滤液分别与灭菌后冷却至55℃的PDA 培养基混合均匀制备平板。每个平板中央接种寄生水霉菌饼,不经处理的发酵滤液作为对照,每个处理重复3 次,18℃培养至对照长满平板后,测量各处理菌落直径,计算抑菌率,检测不同pH 处理对试验菌株发酵液抑菌活性的影响。
2 结果与分析
2.1 拮抗菌筛选
试验以寄生水霉SMJ-1 为指示菌,通过平板对峙法筛选获得1 株对水霉病原菌具有显著拮抗作用的菌株YB5(图1),其抑菌圈直径达24.6mm,发酵液抑菌率达72.90%。该菌株对其他寄生水霉的拮抗作用试验结果显示:该菌对不同来源的寄生水霉(SMJ-2、SMJ-3、SMJ-4)均表现出显著的抑制作用。
2.2 拮抗菌鉴定
2.2.1 拮抗菌YB5 的形态特征
菌株YB5 在牛肉膏蛋白胨培养基上的菌落呈圆形或不规则形,边缘粗糙,表面粗糙褶皱,白色不透明(图2)。显微镜下该菌革兰氏染色阳性,细胞大小(1.5~1.8)×(0.5~0.6)μm,无荚膜,有芽孢。芽孢位于菌体中央,不膨大,柱状,大小为(0.7~0.9)×(0.5~0.6)μm(图3)。对照《常见细菌系统鉴定手册》,菌株YB5 的形态学特征与已知的芽孢杆菌属Bacillus 一致。
2.2.2 拮抗菌YB5 的16S rRNA 序列分析
以菌株YB5 的基因组DNA 为模板,1492R/27F为通用引物,经PCR 扩增和序列测定获得长度为1208 bp 的碱基序列(GenBank accession number:MN121126)。所测序列在NCBI 数据库中的Blast 结果显示,菌株YB5 与特基拉芽孢杆菌Bacillus tequilensis 的16S rRNA 序列相似性达99%。选取并下载典型菌株序列,以其近源属双芽孢杆菌属Amphibacillus 模式种Amphibacillus sxylans 为外群构建系统发育树。结果如图4 所示,菌株YB5 与特基拉芽孢杆菌聚类在一个分支上,结合其形态结构特征,菌株YB5 鉴定为特基拉芽孢杆菌。
2.3 拮抗菌传代稳定性测定
拮抗菌株YB5 和其传代菌株发酵滤液的抑菌试验结果如表1。拮抗菌YB5 继代培养菌株与出发菌株之间抑菌效果差异不显著(P>0.05),说明该拮抗菌抑菌效果传代稳定。
2.4 温度变化对拮抗菌发酵液抑菌活性的影响
温度变化对菌株YB5 发酵液抑菌稳定性的影响结果如图5 所示,10~70℃范围内样品的抑菌活性无显著性差异(P>0.05),表明在此范围内温度变化对菌株YB5 发酵液中的抑菌物质的活性没有影响,该菌株发酵液对温度变化具有良好的耐受性。
2.5 拮抗菌发酵液酸碱稳定性
pH 变化对YB5 发酵液抑菌活性的影响结果如图6 所示。试验菌株发酵滤液的抑菌活性对酸碱度变化较为敏感,pH<7.0 或pH>8.0,抑菌率显著下降(P<0.05),仅在pH7.0~8.0 范围内抑菌活性较为稳定,表明菌株YB5 发酵液中抑菌物质的活性受pH影响较大,在pH7.0~8.0 范围内抑菌作用稳定。
3 讨论
目前,水霉病的防治仍然缺乏安全有效的方法,以化学药物、抗生素、疫苗以及中草药等进行防治亦存在各自的缺点和不足。利用拮抗菌及其发酵产物能绿色、环保、安全、高效地防治水霉病,已成为水霉病防控研究的主流方向[3]。研究表明,一些细菌如芽孢杆菌和放线菌对水霉菌具有良好的抑制作用。张书俊[20]等筛选出一株能明显抑制水霉菌菌丝体生长与孢子萌发的粘质沙雷氏菌Serratia marcescens 菌株LD038。贺凤等[21]从海底沉积物中分离、筛选水霉拮抗菌株海洋链霉菌Streptomycesmarinensis S26,其产生的活性物质对病原水霉真菌有较强的抑制作用,并对外界环境变化有较强的适应能力。梁永增[22]筛选的芽孢杆菌Bacillus sp.菌株JL04 和短小芽孢杆菌Bacillus pumilus JL50 对水霉菌均具有显著抑制作用,两株拮抗菌对鱼体没有毒性,且传代稳定。本研究从实验室分离保存的27 株细菌中筛选获得一株对水霉具有显著拮抗作用的芽孢杆菌菌株YB5。该菌株对不同来源的多株寄生水霉均显示出明显的抑制作用。对其形态学特征及16S rRNA 基因序列比对分析,可知菌株YB5 为芽孢杆菌属的特基拉芽孢杆菌。该结果是特基拉芽孢杆菌对水霉菌具有拮抗作用的首次报道。
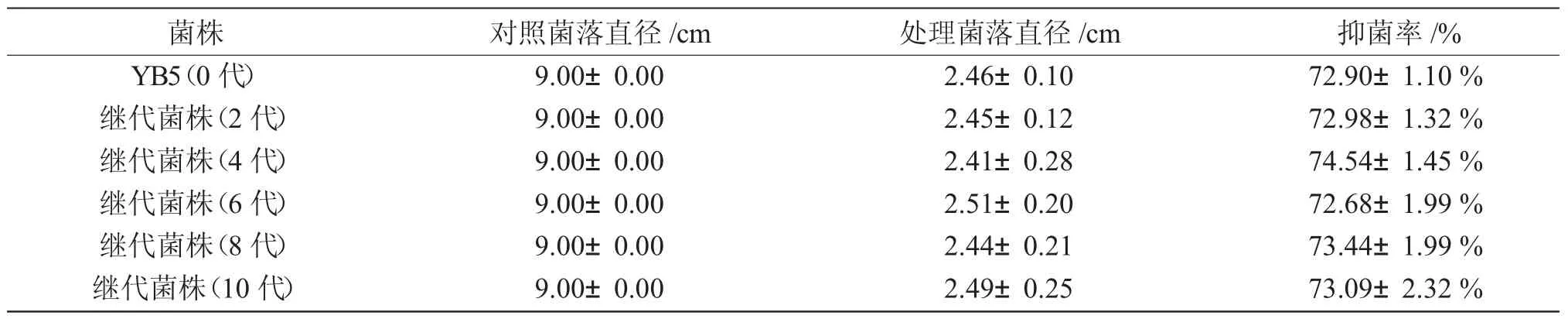
表1 YB5 及其继代培养菌株对寄生水霉的抑制作用Tab.1 Inhibition rate of YB5 and its subculture against S.parasitica
特基拉芽孢杆菌YB5 经传代培养后,对水霉菌拮抗作用稳定,表明其具有良好的传代稳定性。该菌发酵滤液经10~70℃低温及高温处理后,抑菌活性稳定。淡水养殖水体的温度变化范围一般为0~34.6℃[23],菌株YB5 发酵产物表现出对养殖环境温度变化的良好适应性。该菌的发酵产物抑菌活性对环境的pH 波动较为敏感,仅在pH7~8 范围内具有与对照差异不显著的抑菌效果。一般来说,淡水养殖水体的pH 变化范围为6.8~8.5[24],可见该菌的发酵产物在淡水养殖水体中也具有较好的酸碱适应性。本试验为进一步研究开发水霉病生防菌剂提供了优质菌种资源和基础研究数据,后续试验还将对该菌株的安全性及防治效果进行测定,以期为该菌开发为新型生物菌剂奠定基础。
