miR-146b在高糖环境下对肾小球系膜细胞的作用研究
2020-09-07王琼妮纪成尹思琪胡玉燕孙丰田钱晖江苏省检验医学重点实验室江苏大学医学院江苏镇江212013
王琼妮,纪成,尹思琪,胡玉燕,孙丰田,钱晖(江苏省检验医学重点实验室&江苏大学医学院,江苏镇江 212013)
糖尿病肾病是由糖尿病引起的微血管疾病,为糖尿病患者常见且严重的并发症,是终末期肾脏病的主要原因[1]。目前临床上缺乏早期诊断糖尿病肾病的敏感指标,急需寻求新的诊断标志物。微小RNA(microRNAs,miRNAs)是一类非编码小RNA分子,长度为20~25个核苷酸,可通过转录后机制调节基因表达[2]。近年来研究发现,miRNAs在糖尿病肾病进展过程中起着重要的作用[3]。miR-146b位于人类染色体10q24.32,能促进癌症发生并调节炎症及免疫反应[4]。本课题组前期研究发现,miR-146b在急性肾损伤中的表达水平明显升高,并具有潜在的临床诊断价值[5];但对于miR-146b在糖尿病肾病中的研究国内尚未见报道。本研究拟探讨miR-146b在高糖环境下对肾细胞的作用及机制,以期为糖尿病肾病寻找新的诊断指标。
1 材料与方法
1.1主要仪器及试剂 大鼠肾小管上皮细胞(NRK-52E)、大鼠足细胞(podocyte)及大鼠肾小球系膜细胞(HBZY-1)购自中国科学院典藏培养物保藏委员会细胞库。正常培养基(加入L-DMEM培养基使葡萄糖终浓度为5.5 mmol/L)、高糖培养基(加入L-DMEM培养基使葡萄糖终浓度为30 mmol/L)、Trizol试剂购自美国Gibco公司,胎牛血清(美国Excel公司),miScript Ⅱ RT Kit、miScript SYBR®Green PCR Kit、miR-146b、U6引物(德国Qiagen公司),miR-146b模拟物(mimics)、抑制物(inhibitors)及对照序列(NC)购自苏州吉玛公司,LipofectamineTM2000(美国Life Technologies公司),RIPA裂解液(南京诺唯赞生物科技公司),兔抗鼠YAP单克隆抗体、兔抗鼠p-YAP单克隆抗体、兔抗鼠YAP单克隆抗体(美国CST公司),辣根过氧化物酶(HRP)标记的山羊抗兔 IgG二抗(FITC conjugated)、兔抗鼠β-actin单克隆抗体均购自美国SAB公司。CO2培养箱、Nano Drop 1000核酸蛋白测定仪(美国Thermo公司),高速离心机(德国Eppendorf公司),ABI 7500荧光定量PCR仪(美国ABI公司),LAS4000化学发光成像系统、Elite激光共聚焦显微镜(美国GE公司)。
1.2细胞培养及高糖诱导的肾细胞损伤模型构建 NRK-52E、podocyte及HBZY-1细胞均采用含10%胎牛血清的L-DMEM培养基,于5%CO2、37 ℃恒温培养箱中温育,取生长状况良好细胞,经2.5 g/L胰蛋白酶消化后,将2×105个细胞接种于6孔细胞培养板中,实验设为正常组(置于5.5 mmol/L正常培养基培养)及高糖组(置于30 mmol/L高糖培养基培养),每孔加2 mL培养基继续培养48 h,用于后续实验。
1.3HBZY-1细胞转染 取生长状态良好的HBZY-1细胞,经2.5 g/L胰蛋白酶消化后,将1×105个细胞接种于6孔细胞培养板中,实验设为过表达组:包括miR-146b模拟物mimics组(20 nmol/L miR-146b mimics)及NC组(20 nmol/L mimics阴性对照片段);敲减组:包括miR-146b抑制剂inhibitors组(100 nmol/L inhibitors)及NC组(100 nmol/L inhibitors阴性对照片段)。过表达组采用正常培养基培养,敲减组采用高糖培养基培养。置于5%CO2、37 ℃恒温培养箱中继续培养24 h,按照LipofectamineTM2000转染试剂说明书进行转染,转染48 h后收集细胞并提取总RNA及蛋白质进行后续实验。
1.4RNA提取及qRT-PCR反应 采用Trizol试剂提取细胞总RNA,Nano Drop 1000核酸蛋白测定仪测定总RNA浓度及纯度,取吸光度(A260/280 nm)在1.8~2.0间的RNA样本,置于-80 ℃保存。按照miScript Ⅱ RT Kit说明书操作将RNA逆转录为cDNA,置于-20 ℃保存。miR-146b引物(GenBank序列号:NR_030169.1;引物序列:5′-CCUAGGGACU
CAGUUCUGGUG-3′;产物大小为73 bp;退火温度55 ℃)及U6引物(GenBank序列号:NR_004394.1;引物序列:5′-CTCGCTTCGGCAGCACA-3′;产物大小为106 bp;退火温度55 ℃),均由德国Qiagen公司采用Primer Premier 5.0软件设计并合成。以该cDNA为模板,按照miScript SYBR®Green PCR Kit说明书进行qRT-PCR。PCR总反应体系为10 μL,包括10×miScript通用引物1 μL,2×QuantiTect SYBR Green PCR Master Mix 5 μL,miR-146b/U6引物(10 μmol/L) 1 μL,RNase free H2O 2 μL,3 ng/μL cDNA 1 μL。循环参数:95 ℃预变性15 min;94 ℃ 15 s,55 ℃ 30 s,63 ℃ 30 s,40次循环。以U6为内参,miR-146b的相对表达水平以2-ΔΔCt法计算,公式:ΔΔCt=[(样本Ct目的基因-样本Ct管家基因)-(对照组Ct目的基因-对照组Ct管家基因)]。试验重复3次。
1.5western blot检测 取1.3中各组细胞(1×106个),加入100 μL RIPA裂解液提取细胞总蛋白质,Nano Drop 1000核酸蛋白测定仪测定蛋白质浓度。以3∶1体积比加入4×Loading buffer,煮沸10 min后置于-20 ℃保存。以12%SDS-PAGE凝胶进行电泳,每孔蛋白质加样量为150 μg,80 V电泳150 min,350 mA冰浴转膜2 h,50 g/L脱脂奶粉封闭1 h。分别加入兔抗鼠p-YAP单克隆抗体(1∶1 000稀释),兔抗鼠YAP单克隆抗体(1∶1 000稀释),兔抗鼠β-actin单克隆抗体(1∶2 000稀释),4 ℃温育过夜。TBST洗膜,加入辣根过氧化物酶(HRP)标记的山羊抗兔 IgG二抗(1∶2 000稀释),37 ℃温育1 h,TBST洗膜,HRP化学发光底物法进行凝胶成像,采用Image J软件进行灰度扫描及结果判读,试验重复3次。
1.6细胞免疫荧光 取生长状况良好的HBZY-1细胞,经2.5 g/L胰蛋白酶消化,计数2×104个细胞,接种于预先放置细胞爬片的24孔细胞培养板中,试验设为正常组、高糖组(试剂同上),每孔加500 μL培养基继续培养48 h。转染miR-146b的HBZY-1细胞经2.5 g/L胰蛋白酶消化并计数2×104个细胞,接种于预先加入细胞爬片的24孔细胞培养板中,试验设为miR-146b模拟物mimics及NC组;miR-146b抑制剂inhibitors及NC组,试剂浓度同步骤1.3。培养48 h,PBS洗涤后加入4%多聚甲醛室温10 min固定。PBS洗涤5 min,重复3次,0.1% Triton-100破膜20 min。PBS洗涤5 min,重复3次,5% BSA室温封闭20 min。加入兔抗鼠YAP单克隆抗体(1∶100稀释),4 ℃温育过夜。PBS洗涤5 min,每次3次,避光加入HRP标记的山羊抗兔IgG二抗(1∶500稀释),37 ℃温育45 min。PBS洗涤,Hochest 33342染料(1∶200稀释)染核5 min,PBS洗涤,使用激光共聚焦显微镜观察并拍照,Image J软件进行平均荧光强度检测,试验重复3次。
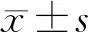
2 结果
2.1miR-146b在不同处理条件下HBZY-1细胞中的表达 与正常组(0.947±0.051)相比,高糖处理后miR-146b在HBZY-1(2.197±0.166)中的表达水平显著升高(t=7.215,P<0.01);而高糖组NRK-52E(0.996±0.056)及podocyte(0.962±0.027)与正常组NRK-52E(1.021±0.020)及podocyte(1.003±0.058)相比差异无统计学意义(t分别为0.421和0.639,P均>0.05)。
2.2高糖诱导HBZY-1后YAP蛋白的表达 western blot结果显示,与正常组(YAP:0.456±0.004;p-YAP:0.628±0.004)相比,高糖组HBZY-1细胞中YAP蛋白(0.753±0.008)的表达水平明显升高(t=32.17,P<0.001),而p-YAP蛋白(0.372±0.005)的表达水平明显降低(t=39.56,P<0.001)(图1A);免疫荧光结果显示,与正常组(25.250±3.100)相比,高糖组中YAP蛋白荧光强度(53.620±4.229)明显升高(t=5.410,P<0.01),且细胞核内YAP蛋白荧光强度明显增强(图1B)。
2.3HBZY-1过表达/抑制miR-146b后YAP蛋白的表达 与mimics NC组(1.009±0.099)相比,mimics组中miR-146b的表达(7.083±0.283)显著升高(t=20.24,P<0.001)。与inhibitors NC组(1.006±0.079)相比,inhibitors组中miR-146b的表达(0.151±0.010)明显降低(t=10.71,P<0.001)。western blot结果显示,正常环境下过表达miR-146b后,与mimics NC组(YAP:0.651±0.003;p-YAP:0.917±0.004)相比,mimics组YAP蛋白(0.883±0.005)的表达明显升高(t=10.71,P<0.001),p-YAP(0.606±0.006)的表达明显降低(t=44.16,P<0.001);而在高糖环境下敲减miR-146b后,与inhibitors NC组(YAP:0.860±0.007;p-YAP:0.638±0.004)相比,inhibitors组YAP(0.706±0.002)的表达明显降低(t=22.15,P<0.001),p-YAP(0.774±0.003)的表达则明显升高(t=25.61,P<0.001)(图2A)。免疫荧光结果显示,与mimics NC组(7.880±0.6196)相比,mimics组YAP荧光强度(25.700±1.589)增强(t=10.45,P<0.001),入核增多;敲减miR-146b后,与inhibitors NC组(26.030±1.074)相比,inhibitors组YAP荧光强度(8.900±1.022)减弱(t=11.56,P<0.001),入核减少(图2B)。
3 讨论
近年来,有关miR-146b作用的研究大多集中于肿瘤、炎症及免疫反应方面[4]。例如在甲状腺乳头状癌中miR-146b通过靶向卷曲螺旋结构域6(CCDC6)促进疾病的发生、发展[6],胃癌中miR-146b通过靶向蛋白质酪氨酸磷酸酶1B(PTP1B)调节胃癌细胞的增殖和凋亡[7]。此外,多项研究表明,miR-146b对于肾脏纤维化疾病具有一定的作用。例如在单侧输尿管结扎的肾纤维化模型中miR-146b表达升高,并可能激活NF-κB参与肾脏纤维化[8];在由镉诱发的肾损伤动物模型中,miR-146b的表达显著升高,表明miR-146b可能是肾脏损伤的生物学标志物[9]。在2型糖尿病患者中,miR-146b表达升高且与糖化血红蛋白具有一定的关联性[10];高糖环境可刺激TNF-α,IL-6和IL-1β等促炎性细胞因子的表达,而这些炎症因子可能是诱导miR-146b表达升高的原因[11]。本研究结果显示,miR-146b在高糖诱导的HBZY-1细胞中表达水平明显升高,提示高糖环境下miR-146b可能主要作用于HBZY-1细胞,影响肾脏皮质中肾小球的功能。
YAP转录共激活因子是Hippo信号通路关键效应分子,调控细胞增殖、分化和组织稳态[12]。目前研究表明,YAP在糖尿病肾病中具有重要作用。有学者发现YAP在肾组织中高表达,并与肌酐、尿素氮、糖尿病肾病分期及病理分级等相关,提示YAP在2型糖尿病肾病肾损害中起重要作用[13]。另有研究发现,高糖培养的肾小球系膜细胞中Hippo途径高度失活,Mst1和Lats1磷酸化的减少促进了YAP蛋白的表达和核易位,从而造成肾小球系膜过度增殖及肾皮质损伤[14]。本研究亦证实了高糖刺激后HBZY-1细胞的p-YAP蛋白表达减少,而YAP蛋白表达升高,且入核增加,YAP入核后则与TEA转录因子(TEAD)联合,介导细胞增殖和细胞外基质合成,促进肾细胞损伤;过表达miR-146b后YAP表达升高,p-YAP表达减少,而敲减后则相反,提示miR-146b在HBZY-1细胞中可能通过Hippo/YAP信号通路发挥作用。NF2基因是Hippo通路的上游元件,有学者证实,miR-146b-3p与NF2基因具有靶向关系[15],而miR-146b-3p与miR-146b-5p序列相似,因此,我们推测miR-146b可能通过靶向NF2基因,调控YAP蛋白的磷酸化情况,进而影响Hippo/YAP信号通路的功能。然而,本研究不足之处在于缺乏体内实验数据,同时未阐明miR-146b是通过何种机制调控Hippo/YAP信号通路,从而影响高糖环境下HBZY-1的功能。因此,我们将在后续研究中构建糖尿病肾病大鼠模型,结合临床数据进一步分析miR-146b作为早期诊断标志物的可能性,并深入研究miR-146b在糖尿病肾病进展过程中可能的生物学功能及作用机制,为糖尿病肾病的诊断及治疗提供新的治疗靶点。
