转录因子FOXQ1 和增殖指数Ki67在进展期胃癌组织中相关性研究*
2020-09-05赵四成李海东吴金东李怀亮侯炜晓张一心江晓晖
赵四成 ,陈 橼 ,李海东 ,陈 铁 ,吴金东 ,李怀亮 ,侯炜晓 ,张一心 ,江晓晖
(1 南通大学附属妇幼保健院普外科,江苏 226018;2 南通大学附属肿瘤医院普外科;3 南通大学研究生院临床医学系)
叉头框 Q1(Forkhead boxQ1, FOXQ1)是 FOX 家族成员之一,定位于人类染色体6p25.3[1]。研究表明,FOXQ1 在肝癌[2]、食管癌[3]、乳腺癌[4]等肿瘤组织中过表达,且与肿瘤转移、预后密切相关。Liang 等[5]发现FOXQ1 在胃癌中高表达,是患者预后不良的独立指标。Peng 等[6]抑制SW480 结肠癌细胞株FOXQ1 的表达,并不能增加细胞凋亡,但与化疗药物5-FU 和奥沙利铂共同处理后,发现抑制FOXQ1 表达可提高化疗药物的杀伤作用,降低SW480 细胞对化疗的耐药性。Ki-67 公认为评估术后化疗疗效的重要指标[7]。本研究收集南通大学附属肿瘤医院2007 年1月—2011 年6 月胃癌组织石蜡标本167 例,分析进展期胃癌组织中FOXQ1 与增殖指数Ki67 的相关性,FOXQ1 在术后辅助性化疗中的临床意义以及对患者RFS 预后的影响,评价FOXQ1 作为评估预后因子的可能性。
1 资料与方法
1.1 一般资料 进展期胃癌167 例,其中女性53例,男性 114 例,年龄 35~83 岁,平均 61.59±11.11岁。纳入标准:(1)肿瘤浸润深度超过粘膜下层的进展期胃癌(T2-4);(2)按中国临床肿瘤学会(CSCO)原发性胃癌诊疗指南(2017.V1)TNM 分期标准为Ib-IIIa 期[8];(3)术前未接受任何抗肿瘤治疗,均行胃癌D2 根治性手术,术后完成SOX 方案辅助化疗6个周期;(4)未合并其他恶性肿瘤及严重内科基础疾病。胃癌术后完成SOX 方案辅助化疗6 个周期后,随访5 年,中位随访时间39.46±28.61 月,记录患者无复发生存期(RFS),RFS 指的是根治性手术到首次复发、转移的时间(含病理及影像学提示远处转移)。
1.2 检测FOXQ1 及Ki67 表达 采用免疫组化SP法检测FOXQ1 及Ki67 表达。兔抗人FOXQ1 单克隆抗体(美国 Abcam 公司)工作液按 1∶300 稀释,兔抗人Ki67 单克隆抗体(美国 Abcam 公司)工作液按1∶250 稀释,辣根过氧化物酶标记羊抗兔二抗(Dako Cytomation,USA)工作液按 1∶100 稀释。具体操作方法见参考文献[2,9]。结果判定:随机选择5 个高倍镜视野,每个视野计数500 个细胞,计算FOXQ1 阳性细胞数占总细胞数的百分率,评判标准参照文献[2]。Ki67 判断标准参照文献[7,9]。免疫组化切片在光镜下进行图像分析,采用IPWIN60 图像荧光分析软件,每张切片观察5 个高倍视野,测量细胞质中FOXQ1和Ki67 表达的平均光密度值。
1.3 统计学处理 运用SPSS 19.0 统计软件处理分析数据。采用χ2检验分析FOXQ1 和Ki67 蛋白表达与临床各参数的关系;采用Pearson 法对FOXQ1 与Ki67 相关性进行分析;采用Kaplan-Meier 和Logrank 检验分析RFS。采用单变量Cox 比例风险回归分析患者的生存差异,单因素回归分析中有意义因素进一步纳入多因素回归分析。P<0.05 为差异有统计学意义。
2 结 果
2.1 FOXQ1 和 Ki67 免疫 组化 染 色 FOXQ1 和Ki67 定位于细胞核中,呈深褐色染色(图1)。将复染后的石蜡切片进行扫描,对切片平均光密度值进行Pearson 相关性分析,发现FOXQ1 与Ki67 蛋白在胃癌组织中的表达呈中度正相关(r=0.77,P<0.001)。见图2。

图 1 FOXQ1 和 Ki67 免疫组化染色(200×)

图2 胃癌组织中FOXQ1 和Ki67 表达相关性
2.2 FOXQ1 和 Ki67 表达水平与临床参数的关系 FOXQ1 和Ki67 与组织学分级、浸润深度T 分期、淋巴结转移、TNM 分期、血管癌栓有关(P<0.05),与年龄、性别、是否神经侵犯无关(P>0.05)。见表1。

表1 胃癌组织中Ki67 及FOXQ1 蛋白的表达与临床参数的关系 例(%)
2.3 术后RFS 影响因素分析 单因素COX 回归分析发现RFS 与患者性别、年龄、神经侵犯无关(P>0.05),但是与肿瘤的组织学分级(HR=0.6,P=0.018)、浸润深度 T 分期(HR=0.492,P=0.005)、淋巴结转移(HR=0.506,P=0.005)、TNM 分期(HR=0.515,P=0.006)、血管癌栓(HR=0.530,P=0.011)、Ki67 高表达(HR=0.296,P<0.001)、FOXQ1 高表达(HR=0.365,P<0.001)有关。将上述有意义因素纳入多因素COX回归分析,显示患者RFS 与FOXQ1 高表达(HR=2.962,P<0.001)、Ki67 高表达(HR=2.416,P<0.001)有关。见表2。Kaplane-Meier 生存曲线分析显示,FOXQ1 和Ki67 高表达患者术后RFS 生存率低于FOXQ1 和Ki67 表达阴性者,差异具有统计学意义(P<0.05)。见图 3。

表2 单因素和多因素回归分析影响GC 患者RFS 预后的相关因子
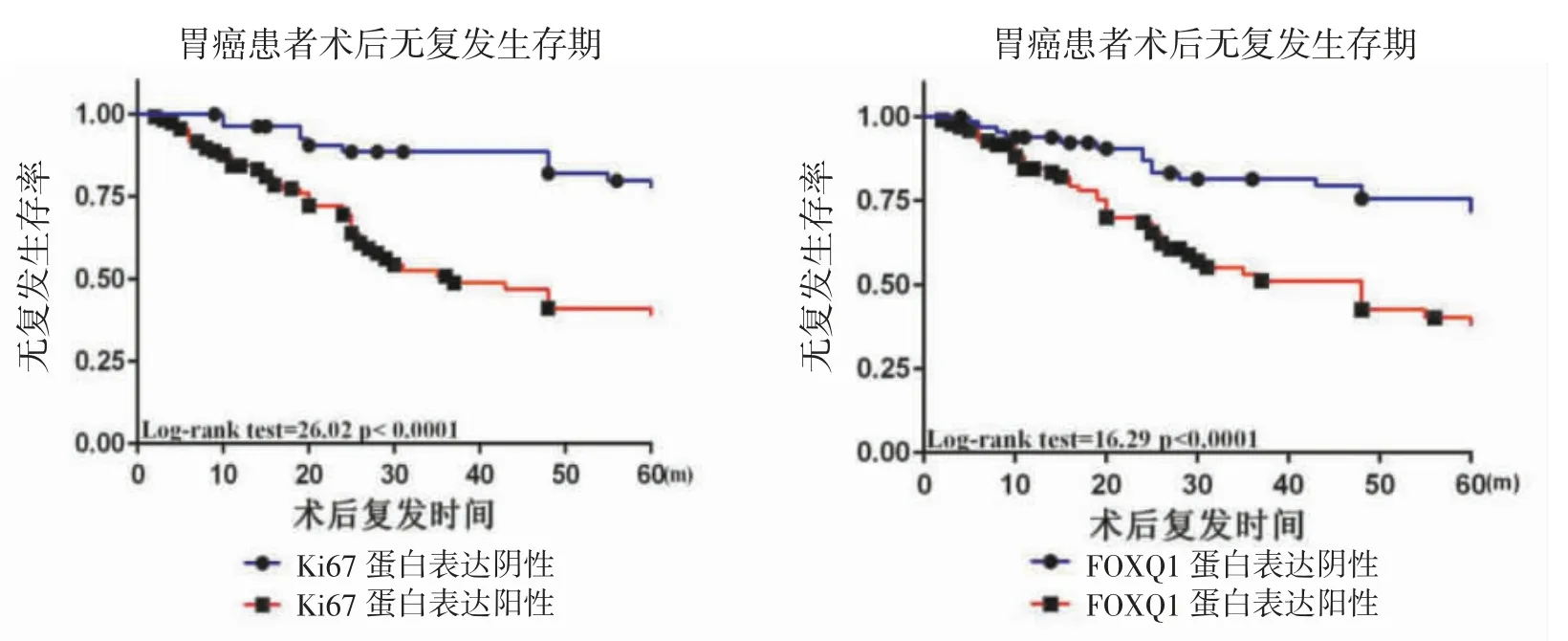
图3 Kaplane-Meier 生存曲线
3 讨 论
我国属于胃癌高发国家,发病率居世界第2 位,死亡率居世界第3 位,高于世界平均水平,每年新增胃癌病例及死亡病例占全世界40%,位居首位[10]。随着我国胃镜检查的普及和诊疗手段的发展,促进了胃癌早期发现、早期诊断、早期治疗,患者总生存率有所提高,但胃癌术后复发的比例依然较高[11]。因此,研究胃癌的耐药基因,优化治疗方案,合理选择化疗药物,显得尤为重要。
FOXQ1 过表达与胃癌的进展密切相关,可作为判断胃癌预后不良的独立指标[5]。有研究检测60 例胃癌组织中miR-1271 表达,发现miR-1271 表达与肿瘤大小、T 分期、N 分期、TNM 分期密切相关,而与FOXQ1 负相关。研究表明,miR-1271 下调胃癌细胞中FOXQ1 的表达,从而抑制肿瘤细胞的浸润、侵袭和转移[12]。还有研究发现,FOXQ1 和同一家族的FOXC2 共同作用,影响胃癌患者的预后[13]。细胞实验发现TAM/FOXG1 通路是影响胃癌发生发展的关键信号通路[14]。还有学者认为FOXQ1 作为上皮-间质转化(EMT)相关蛋白,通过Snail 信号通路发挥重要作用,FOXQ1 过表达影响胃癌的间质表型,从而影响肿瘤细胞的侵袭性[15]。有研究发现,miR-345 是FOXQ1 上游调控miRNA,通过抑制胃癌细胞的EMT 来抑制胃癌细胞转移[16]。过表达FOXQ1 可逆转miR-345 对胃癌转移的抑制作用,而敲除FOXQ1 则可阻止miR-345 基因敲除对胃癌转移的促进作用。Bcl-2 被认为是miR-345 的新靶点,其过表达可以拮抗miR-345 在胰腺癌细胞中的促凋亡作用[17],Bcl-2 可以拮抗多种细胞毒药物引起的细胞凋亡。替吉奥可增加Bax 表达及Bax/Bcl-2 比值,诱导细胞凋亡[18]。Bax 表达及Bax/Bcl-2 比值的高低影响奥沙利铂治疗胃癌患者的总生存率[19]。FOXQ1 过表达可抑制miR-345 表达,从而可能上调Bcl-2 表达,下调Bax 表达及Bax/Bcl-2 比值,达到抑制凋亡的作用。
Ki67 常用于评估肿瘤大小、分级、肿瘤增殖活性以及化疗后肿瘤细胞的坏死情况[7]。本研究以Ki-67 作为参考,评估FOXQ1 高表达对胃癌术后SOX化疗方案的影响,为进展期胃癌患者的术后治疗方案提供参考。结果发现,在胃癌的组织中,FOXQ1 表达与Ki67 表达呈中度正相关;FOXQ1 和Ki67 表达与组织学分级、浸润深度、淋巴结转移、TNM 分期及血管癌栓有关(P<0.05);多因素回归分析显示FOXQ1和 Ki67 高表达影响患者 RFS(P<0.05);Kaplane-Meier 生存曲线分析显示,FOXQ1 和Ki67 高表达患者术后RFS 生存率低于FOXQ1 和Ki67 表达阴性者,差异具有统计学意义(P<0.05)。
综上所述,进展期胃癌组织中FOXQ1 与Ki67表达呈正相关,FOXQ1 及Ki67 高表达影响SOX 化疗方案的效果,与患者术后复发相关,高表达患者RFS 缩短,FOXQ1 联合Ki67 检测可能有助于预测胃癌患者的预后和制定相应的治疗策略。
