胃癌的临床病理特征与KRAS基因突变的相关性
2020-09-05姚书鹏张友满
姚书鹏 李 军 张友满
胃癌是当前常见的消化系统恶性肿瘤,发病周期比较长,多由胃息肉发展而来[1]。现代研究表明胃息肉向胃癌的发展是一个由良性到恶性逐步演变的过程,不过由于各种因素的影响,胃息肉早期诊断率落后于发达国家,患者确诊时大多数已进展到胃癌,因此预后较差[2-3]。随着分子生物学技术、现代免疫组织化学的不断发展,通过检测肿瘤细胞特异抗原等使早期检出胃部疾病已成为了可能[4-5]。鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)是RAS家属的1个基因,位于12号染色体,与肿瘤的血管生成、增殖、迁移均有关系[6-7]。KRAS基因容易发生突变,也是细胞内信号传导通路中重要的“开关”,可产生具有致癌活性的KRAS蛋白,使细胞增殖失控,细胞内信号传导紊乱,引起细胞癌变[8-9]。本文具体探讨了胃癌的临床病理特征与KRAS基因突变的相关性,希望为早期检出胃癌提供参考,也希望明确KRAS基因的作用效果与机制。现总结报告如下。
1 资料与方法
1.1 一般资料
2017年3月至2018年4月选择在本院进行诊治的120例胃癌患者(胃癌组)与120例胃良性病变(良性组)患者,纳入标准:患者临床病历资料齐全,留存有病理组织样本(均经患者知情同意);都符合胃癌或胃良性病变的诊断标准;原发于胃部疾病,非其他部位转移或复发的胃部疾病病例;病理组织样本取样前都未经过任何治疗;研究得到了医院伦理委员会的批准。排除标准:组织病理学不明确的病例;未行手术或活检病例;妊娠孕妇与哺乳期妇女;精神疾病患者;临床资料缺乏者。2组患者的性别、年龄、体重指数等对比差异无统计学意义(P>0.05),见表1。

表1 2组一般资料对比
在胃癌组中,临床分期:早中期48例,晚期72例;淋巴结转移60例;分化程度:高分化60例,中分化40例,低分化20例;远处转移20例;浸润深度:<肌层40例,≥肌层80例。
1.2 标本提取
2组的病理组织取出后经液氮速冻后保存于-80 ℃,病理组织基因组总DNA的提取采用TRIzol试剂(北京天根生化科技有限公司)一步提取法,提取的总DNA置于-80 ℃冻存,具体步骤参照说明书。使用琼脂糖凝胶电泳检测DNA完整性,选择紫外分光光度仪(美国Amersham公司)测定DNA浓度和纯度。
采用美国Invitrogen公司生产的PCR仪行PCR分析,对KRAS基因第2号外显子进行扩增,上游段引物为5'-GCTFGCTCTGATAGGAAAATGAG-3',下游段引物为:5'-AGGCCTGCTGAAAATGACTG-3'。PCR反应体系为25 μl,PCR反应条件:94 ℃预变性10 min,55 ℃退火45 s,72 ℃下延伸45 s,40个循环,然后在72 ℃下延伸10 min。将PCR的产物直接进行纯化处理,应用美国ABI3730XL测序仪进行DNA测序。
1.3 调查内容
调查2组患者的性别、年龄等资料,同时重点调查胃癌患者的临床分期、分化程度、淋巴结转移、浸润深度、远处转移等情况。随访1年,记录胃癌患者的生存情况。
1.4 统计方法
选择SPSS 20.00软件进行分析,计数资料的比较采用卡方检验或方差分析(采用百分比表示),计量数据的比较采用t检验(采用均数±标准差表示),相关性分析采用Cox多因素生存回归分析,所有P值均为双侧,检验水准为α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 KRAS基因突变率对比
胃癌组的KRAS基因突变率为75.0%(90/120),显著高于良性组的15.0%(18/120),差异有统计学意义(χ2=87.273,P=0.000)。
2.2 胃癌组KRAS基因突变率与临床病理特征的相关性
在120例胃癌患者中,不同临床分期、淋巴结转移、分化程度、远处转移、浸润深度患者的KRAS基因突变率对比,差异有统计学意义(P<0.05),见表2。

表2 胃癌患者KRAS基因突变率与临床病理特征的相关性(例,%)
2.3 随访预后
胃癌组患者随访至今,平均随访时间为(15.22±2.48)月,死亡12例,死亡率为10.0%。单因素和多因素Cox回归分析显示KRAS基因突变率、临床分期、淋巴结转移、分化程度、远处转移、浸润深度都为影响胃癌患者预后的危险因素(P<0.05),见表3。
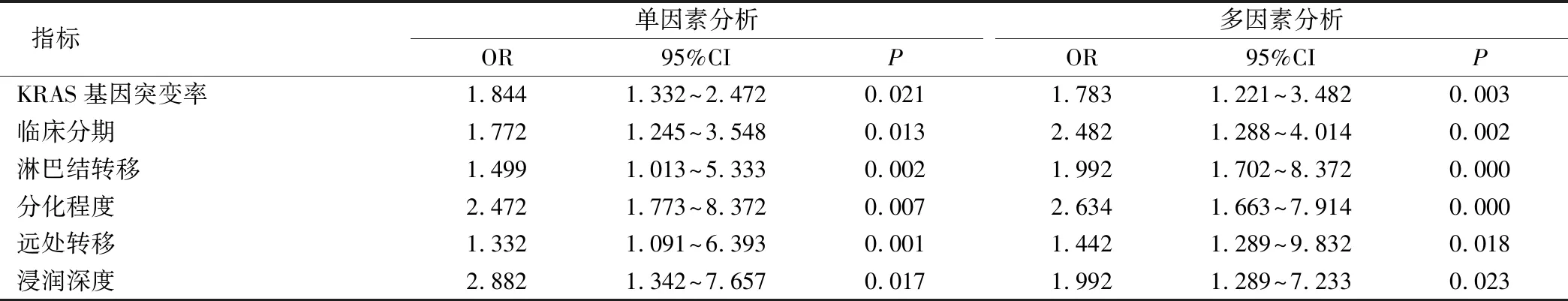
表3 影响胃癌患者预后的Cox回归分析(n=120)
3 讨论
胃癌为临床上比较常见的恶性肿瘤,也是癌症导致死亡的重要原因。当前我国胃癌患者占全球胃癌发病总人数的40%左右,但是胃癌早期诊断率却不到10%,并且由于缺乏有效治疗手段,晚期胃癌的5年生存率长期低于10%[10]。有研究表明胃癌细胞增殖和凋亡是一个多因素、多步骤、多阶段综合作用的发展过程,改进早期检测手段、发展新型分子靶向治疗策略具有重要价值[11-12]。目前对于胃癌发生的研究虽然取得了一定的进展,但是关于胃癌发展、侵袭和转移的分子机制仍然不是特别清楚。
KRAS是RAS基因家族成员之一,长约35 kb,与肿瘤的增殖、迁移、血管生成均有关系[13]。KRAS蛋白在信号肽转导过程中起重要作用,在关键位点发生氨基酸突变从而产生具有致癌活性的KRAS蛋白,使细胞增殖失控,细胞内信号传导紊乱,引起细胞癌变[14-15]。KRAS基因第2号外显子的基因组PCR方法是目前检测KRAS基因突变最灵敏、最可靠的方法。本研究显示胃癌组的KRAS基因突变率与表达阳性率显著高于良性组,表明胃癌组织中KRAS基因突变率比较高。已有研究显示胃癌患者早期症状不显著,多由良性病变发展而来,患者只有在出现腹痛等严重情况时才会到院就诊[16]。与其它肿瘤一样,胃癌的发生归因于基因-环境的相互作用,正是这些基因多态性或修饰性,导致个体对环境因素可产生一定的敏感性[17]。 KRAS基因含有4个编码外显子和1个5'端非编码外显子,KRAS基因突变是肿瘤恶性程度增加的表现[18]。本研究显示在120例胃癌患者中,不同临床分期、淋巴结转移、分化程度、远处转移、浸润深度患者的KRAS基因突变率对比差异有统计学意义。表明KRAS基因突变与胃癌患者临床分期、淋巴结转移、分化程度、远处转移、浸润深度有关。
胃癌已成为世界范围内癌症死亡的主要原因之一,而早期诊断可以改善胃癌的治疗和预后,不过传统常见的血清标志物欠缺诊断特异性[19]。本研究单因素和多因素Cox回归分析显示KRAS基因突变率、临床分期、淋巴结转移、分化程度、远处转移、浸润深度都为影响胃癌患者预后的危险因素。从机制上分析,KRAS基因与人类肿瘤的发生发展关系最为密切,是细胞内信号传导通路中重要的“开关”,KRAS基因突变是锯齿状病变研究中最受关注的分子遗传学改变[20]。KRAS蛋白的突变使KRAS蛋白不能被水解,处于持续激活状态,从而导致疾病的恶化,促使患者死亡[21]。然而本研究也存在一定的缺陷,没有在胃癌发生与发展过程中针对KRAS基因突变情况进行动态的检测,也没有进行细胞学分析,这些将在下一步进行深入分析。
总之,KRAS基因突变在胃癌组织中比较常见,与患者的临床病理特征显著相关,可以作为预测胃癌发生和预后的潜在生物标志物。
